Биотехнология - Ю.О. Сазыкин 2006
Частная биотехнология
Биотехнология лекарственных средств на основе культур растительных клеток и тканей
Общая характеристика
Одним из главных механизмов, поддерживающим стабильность жизни на Земле, является сохранение разнообразия, взаимосвязанного и взаимозависимого сосуществования человека и природы. Так, академик Г. Ф. Гаузе доказал, что устойчивость сообщества тем выше, чем больше число составляющих его видов. Рост городов, вырубка лесов, ухудшение экологии, усиленная эксплуатация дикорастущих и плантационных растений — традиционного источника лекарственных средств приводят к растущему дефициту сырья. Многие виды растений находятся на грани вымирания. Использование культур клеток и тканей растений помогает спасти от уничтожения ставших уже редкими тысячи дикорастущих растений, которые синтезируют необходимые для жизнедеятельности человека вещества.
Культивирование растительных клеток и тканей на искусственной питательной среде в биореакторах помимо решения ряда экономических экологических и технологических задач позволяет, в частности, преодолеть ряд проблем:
✵ свести к минимуму влияние климатических, сезонных и географических условий;
✵ сократить посевные площади в хозяйственном обороте страны;
✵ получать уже известные, присущие интактному растению вещества, например никотин, кодеин, хинин, диосгенин и синтезировать новые биологически активные соединения;
✵ использовать культуры растительных клеток для биотрансформации конечных продуктов.
Использование новых технологий получения биомассы лекарственных растений (содержащих то или иное активное начало) в виде каллусных (лат. callus — толстая кожа, мозоль) и суспензионных культур имеет ряд преимуществ:
✵ стандартность накапливаемого сырья;
✵ высокий выход активного начала (на примере культивирования женьшеня: рентабельность производства стала возрастать при внедрении технологии получения «бородатых корней», где по условиям роста и скопления клеток возникают субпопуляции с повыщенной дифференцировкой — самые продуктивные клетки по биоактивным веществам);
✵ сокращение сроков культивирования для накопления растительной биомассы;
✵ возможность промышленного производства биомассы экзотических растений, малодоступных для нашей страны, например, таких как рауводьфия, диоскорея, унгерия и др.;
✵ использование разных технологических режимов;
✵ использование методов иммобилизации и биотрансформации для повышения выхода продуктов вторичного метаболизма применительно к растительным клеткам.
Однако растительные клетки и ткани имеют свои особенности, затрудняющие работу с их культурами (по сравнению с клетками микроорганизмов):
✵ размеры клеток растений (15-1000 мкм) в 50-100 раз больше, чем клеток бактерий;
✵ в результате роста клеток растений у них появляется большая вакуоль, при этом все физические и химические константы клеток изменяются;
✵ суспензионные культуры состоят из клеток-агрегатов разного размера;
✵ культуры клеток растений имеют целлюлозную стенку, что весьма затрудняет работу биотехнолога с такими культурами.
Промышленный способ выращивания изолированных культур дает возможность за сравнительно короткий срок (30 — 45 сут) получить значительный объем ценного лекарственного сырья, используя каллусные и суспензионные культуры.
Метод получения лекарственных средств на основе культур клеток растений начинается с процесса получения культуры каллусной ткани (или каллуса), образующейся в местах повреждения органов растения (спонтанная пролиферация клеток растения), и используется для получения изолированных тканей и клеток растения. Впервые каллусная культура была получена в 1902 г. Она состоит из сообщества клеток, выращиваемых на искусственной питательной среде. До середины 1950-х гг. культуры каллусных тканей использовали как модельную систему для исследования физиологических и биохимических процессов в работе с изолированными клетками и органами растений.
Через некоторое время было доказано, что культуры клеток растений на искусственных питательных средах могут синтезировать вещества, присущие интактному растению, т.е. могут быть продуцентами БАВ. В этой связи необходимо рассмотреть такое понятие как тотипотентность — способность любой клетки образовывать полноценное растение, что предопределено ее генетическим потенциалом. Все типы дифференцировки — образование отдельных дифференцированных клеток, тканей, органов (органогенез) — возможны, благодаря тотипотентности, т.е. любая растительная клетка содержит полный набор генов организма, из которого она была выделена,
В культуре каллусных тканей морфогенезом называют возникновение организованных структур из неорганизованной массы клеток, поэтому морфогенез в них можно рассматривать как проявление тотипотентности растительных клеток. Каждая клетка каллусной культуры может дать начало целому организму, однако реально детерминируется только одна из 400-1 000 клеток, что, по-видимому, определяется как физиологическим состоянием клетки, так и ее компетентностью.
Существенную роль в дифференциации клеток играют как генотип растения-продуцента, так и условия культивирования. Выращивание изолированных клеток и тканей на искусственных питательных средах в стерильных условиях происходит независимо от принадлежности растений к той или иной таксономической группе. Существуют общие требования к выращиванию объектов в культуре in vitro.
Асептика является обязательной и необходимой для культивирования как отдельных клеток, так и каких-либо фрагментов ткани или органа растения (экспланта). На растительных тканях может оказаться эпифитная микрофлора, которая в дальнейшем обнаружится и в культуре ткани. Внутреннее инфицирование растительной ткани чаще всего встречается у тропических и субтропических растений. Поэтому кроме поверхностной стерилизации с использованием дезинфицирующих веществ применяются и антибиотики, убивающие микробную флору внутри ткани, однако существует серьезная проблема подбора антибиотика направленного действия.
Для успешного культивирования клеток и тканей какой-либо культуры растений необходимо учитывать влияние физических факторов на рост и физиологические характеристики этой культуры на уровне фенотипа и генотипа (рис. 19).
Большинство каллусных тканей растут в условиях слабого освещения, так как они не способны к фотосинтезу. Но в то же время свет может являться и фактором морфогенеза, активирующим процессы вторичного синтеза. В качестве источника света используются люминесцентные лампы. Примером влияния освещенности на метаболизм каллусных клеток является культура чайного растения, у которого под действием света увеличивается биосинтез полифенолов. Однако в культуре клеток Scopolia parviflora тот же свет подавляет образование алкалоидов.
Для большинства каллусных культур также важна оптимальная температура (около 26 С).
Из-за низкой интенсивности дыхания этих клеток потребность их в кислороде соответственно понижена, и необходимость в обеспечении данных культур системой интенсивной аэрации отпадает. В связи с этим при внедрении технологии суспензионного культивирования надо подбирать соответствующие типы биореакторов с объемом не более 20 м3 и с системами особого перемешивания (турбинное, восходящим потоком воздуха, встряхиванием), чтобы не разрушить растительные клетки. При сравнении ферментеров разных типов было установлено, что максимальный синтез вторичных метаболитов в суспензионной культуре происходит при подаче воздуха снизу. Если же выращивают клетки в колбах малого объема, то аэрация достаточна при постоянном перемешивании суспензии.
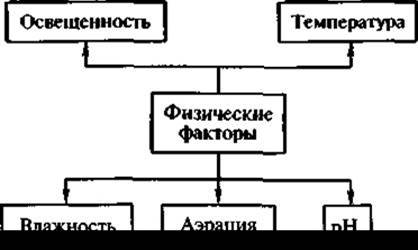
Рис. 19. Физические факторы, влияющие на рост клеточной культуры
Оптимальная влажность для роста культуры обычно составляет 60—70 %. Весьма существенным для обеспечения роста биомассы и синтеза продуктов вторичного метаболизма является подбор ингредиентов среды культивирования. Особое значение для культивирования изолированных клеток и тканей имеют жидкие питательные среды. Они, как правило, многокомпонентны, имеют определенные различия по составу, но в то же время в них обязательно должны быть включены: неорганические питательные вещества — макроэлементы, микроэлементы; источники железа; органические добавки — витамины, фитогормоны, ауксины и цитокинины (регуляторы роста растений, играющие роль пусковых механизмов); источники углеводов — сахароза или глюкоза.
Сахароза или глюкоза особенно необходимы для каллусных тканей, так как они лишены хлорофилла и не способны к автотрофному питанию. Обязательным компонентом питательной среды должны быть ауксины — индолилуксусная кислота, нафтилуксусная кислота и 2,4-дихлорфеноксиуксусная кислота и цитокинины — 6-бензиламинопурин; N-изоптен, 6-фурфуриламинопурин. Ауксины вызывают дедифференцировку клеток экспланта и повышают продуктивность культур клеток, являясь пусковыми механизмами первичного и вторичного метаболизма. Индуцируя клеточное деление, цитокинины по-разному влияют на накопление вторичных метаболитов: одни не реагируют на внесение в среду цитокинина, например культура клеток Datura tatula, другие, например, Scopolia maxima, активно образуют алкалоиды.
Высокое содержание нитратов, ионов аммония, калия, фосфора координирует скорость роста клеток в среде. Истощение среды приводит к снижению как роста клеток, так и процессов вторичного метаболизма. Для синтеза вторичных метаболитов весьма существенно внесение в питательную среду предшественников, стимулирующих определенные ферментативные пути метаболизма. Например, внесение фенилаланина в среду для культивирования клеток увеличивает выход диосгенина на 100%. При приготовлении твердых питательных сред для выращивания каллусных тканей используют очищенный агар-агар — полисахарид, выделенный из морских водорослей.
При получении каллусных культур сначала готовят эксплант — маленькие (2—4 мм) кусочки растительной ткани, не утратившие способность к репродукции. Этот растительный материал тщательно моют, стерилизуют 96% спиртом или 0,1 % сулемой, а затем снова тщательно промывают дистиллированной водой и помещают на синтетическую агаризованную питательную среду. Сосуды закрывают ватно-марлевыми тампонами. Для образования каллуса и роста ткани сосуды переносят в темное помещение, где поддерживают определенную температуру (24— 26 °С) и влажность (65 — 70%), при этом через 2 — 3 нед. на раневой поверхности образуется первичный каллус. Каллусная клетка развивается аналогично другим клеткам, проходя соответственно такие циклы, как деление, растяжение, дифференцировка, старение и отмирание. Кривая роста каллусной ткани имеет S-образный характер и включает пять фаз разной длительности у разных растений (рис. 20).
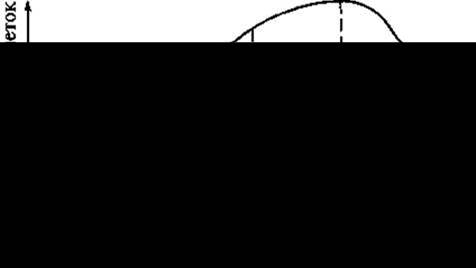
Рис. 20. Кривая роста каллусной ткани. Фазы:
1 — латентная (лаг-фаза — клетки адаптируются и готовятся к делению); 2 — линейная (рост каллусной ткани идет с постоянной скоростью); 3 — экспоненциальная (время максимальной митотической активности; рост клетки ускорен, масса каллуса увеличивается): 4 — стационарная (интенсивность деления резко снижается); 5 — отмирания
Нет однозначного ответа на вопрос, как связан синтез вторичных метаболитов с ростовыми процессами. У большого числа культур вторичные метаболиты синтезируются и накапливаются в значитальных количествах либо во время экспоненциальной фазы, когда ростовые процессы особенно активны, либо в период стационарной фазы роста культуры клеток, когда прирост клеточной массы прекращается. Однако есть культуры (например, клеток Catharanthus roseus), у которых синтез вторичных метаболитов сопровождает весь период роста.
Синтез вторичных соединений может коррелировать с процессом дифференцировки в культуре клеток. Например, в суспензионной культуре Papaver somniferum синтез алкалоидов начинается после того, как в ней дифференцируется достаточно большое количество специализированных клеток млечников, предназначенных для депонирования метаболитов. Культуры же клеток табака и моркови синтезируют большое количество никотина и антоциана соответственно, хотя их клетки слабо дифференцированы. Синтез вторичных метаболитов в культивируемых клетках связан с внутриклеточными органеллами — в основном с пластидами и эндоплазматическим ретикулумом. В клетках, не способных к транспорту метаболитов, продукты вторичного синтеза обычно накапливаются в вакуолях и свободном пространстве.
Важная особенность культивируемой популяции клеток — ее стабильность в отношении синтеза и накопления вторичных метаболитов. Необходимо отметить, что клетки каллусной культуры обычно не транспортируют синтезируемые метаболиты в питательную среду или другие клетки, хотя некоторые культуры составляют исключение, в частности культура клеток мака, которые депонируют алкалоиды в млечники. Очень важно, что каллусные культуры сохраняют многие физиологические особенности растения, из которого они были получены (например, морозостойкость, устойчивость к внешним воздействиям, способность к синтезу вторичных метаболитов и т.д.).
Стабильность синтеза вторичных метаболитов как целевого продукта зависит, как правило, от стадии культивирования и дифференцировки клеток.
Например, дифференцированные корневые каллусы Atropa belladonna синтезируют тропановые алкалоиды, а недифференцированные — уже не способны к их синтезу. Однако недифференцированные клетки Rauwolfia serpentina способны синтезировать индолиловые алкалоиды с достаточно большим выходом метаболитов. Исходя из этого, можно сделать вывод, что морфологическая специализация клеток не является основной предпосылкой для синтеза БАВ.
В настоящее время промышленный синтез вторичных метаболитов на основе суспензионных культур клеток является перспективным и рентабельным, так как производство растительного сырья для него не зависит ни от климатических факторов, ни от повреждения насекомыми. Каллусные культуры выращивают на малых площадях и в дальнейшем используют для синтеза соединений практически всех классов. Причем выход вторичных метаболитов — несопоставимо более высок по сравнению с их синтезом в целых растениях.
Использование технологий получения каллусных культур из растительного сырья дает такие преимущества, как надежность и стабильность по выходу биомассы и продуктов вторичного метаболизма, а также возможность использования каллусной системы для иммобилизации с последующей биотрансформацией. Недостаток только один — необходимость применения ручного труда.
Из сравнения каллусных и суспензионных культур следует, что выход продуктов вторичного метаболизма выше именно в каллусных культурах, но при этом управление процессом культивирования легче осуществлять при работе с суспензионными культурами.
При промышленном выращивании суспензионных культур применяют биореакторы, в которых процессы глубинного культивирования ведут к увеличению биомассы и синтезу вторичных соединений. Выделяют биореакторы, в которых суспензионная культура перемешивается только за счет подачи воздуха, и биореакторы, в которых суспензионная культура перемешивается механическим способом (см. рис. 10).
Культуры растительных клеток в биореакторах выращивают в одном из двух режимов:
✵ первый — периодическое культивирование, при котором по окончании процесса биосинтеза откачивают и используют всю суспензию клеток;
✵ второй — полупериодическое культивирование, при котором в биореактор постоянно добавляют определенный объем свежей питательной среды и одновременно забирают тот же объем либо клеточной суспензии (открытое проточное культивирование), либо отработанной питательной среды, оставляя при этом клеточную массу в реакторе (закрытое проточное культивирование).
В основном растительные клетки выращивают в периодическом режиме. Полупериодическое культивирование используют, когда показано, что нарастание биомассы четко коррелирует с синтезом вторичных метаболитов.
Существуют также две разновидности открытого проточного культивирования:
✵ турбидостат — автоматическое поддержание концентрации клеточной биомассы в реакторе на одном уровне регулировкой скорости протока;
✵ хемостат — в биореактор с постоянной скоростью подается питательный раствор при одновременном откачивании с той же скоростью клеточной суспензии.
Существуют также технологии получения вторичных метаболитов с помощью иммобилизованных клеток каллусной культуры. Их помещают (встраивают) в определенные носители: альгинат кальция; агарозные шарики; трехмерные сетчатые структуры из нейлона, порошкового металла, полиуретана (в частности, такие системы используются для иммобилизации каллусной культуры клеток Digitalis lanata) или адсорбируют в них. Носитель с клетками помещают в питательную среду, клетки при этом остаются живыми. Они прекращают рост, но продолжают синтез метаболитов, выделяя их в среду. Основные условия иммобилизации — выделение метаболитов в питательную среду и свободное извлечение метаболитов, например алкалоидов из питательной среды.
Иммобилизованные клетки по сравнению с суспензионными культурами имеют следующие преимущества:
✵ многократное использование;
✵ четкое отделение биомассы от продуктов метаболизма;
✵ увеличение продолжительности культивирования на стадии активного биосинтеза;
✵ получение большего количества вторичных метаболитов;
✵ сокращение времени ферментации;
✵ увеличение срока работы клеток (иммобилизованные клетки с низкой скоростью роста способны к интенсивной выработке метаболитов).
Довольно часто синтез метаболитов в суспензионной культуре останавливается на промежуточных этапах, не доходя до получения необходимого целевого продукта. В этом случае получение конечного продукта возможно, благодаря процессу биотрансформации, суть которого в изменении промежуточных метаболитов с помощью культур других растений или клеток бактерий с целью повышения биологической активности конкретной химической структуры. Несмотря на то, что биотрансформация очень эффективна в случае применения бактериальных клеток, однако растительные клетки также используют, когда процесс по каким-либо причинам не может осуществляться в клетках микроорганизмов.
В качестве примера можно привести превращение дигитоксина в дигоксин клетками Digitalis lanata. Недифференцированные культуры клеток Digitalis lanata сами по себе не образуют сердечных гликозидов, но могут осуществлять реакции биотрансформации субстратов, добавленных в питательную среду. Растения наперстянки (Digitalis lanata) в большом количестве синтезируют дигитоксин вместо необходимого дигоксина. Для соответствующей биотрансформации с успехом используют недифференцированную суспензионную культуру наперстянки. Иммобилизованные клетки этой культуры способны долгое время с постоянной скоростью трансформировать ß-метилдигитоксин в ß-метилдигоксин (за счет реакции 12-гидроксилирования, катализируемой ферментом, находящимся в клетках Digitalis lanata).
Другой пример: культура клеток женьшеня корневого происхождения способна биотрансформировать (гликозилировать) фенольные соединения (продукты жизнедеятельности суспензионной культуры клеток корня Panax ginseng).
Еще один пример — биотрансформация карденолидов, в которых содержатся гликозиды, используемые в медицине для лечения болезней сердца.
Для успешного осуществления процессов биотрансформации необходимо постоянно проводить селекцию специализированных линий клеток и оптимизировать условия культивирования.
В заключение приведем в качестве примеров используемые в клинической практике лекарственные средства, полученные на основе каллусных и суспензионных культур клеток растений: шиконин (кожные заболевания), дигоксин (сердечно-сосудистые заболевания), берберин (кишечные растройства — в качестве бактерицидного средства), диосгенин (противозачаточное средство), панаксозиды (адаптогени, укрепляющие иммунитет). При производстве настоек женьшеня плантационное выращивание этой культуры по выходу панаксозидов имеет преимущество перед каллусным сырьем, однако препараты, получаемые из каллусного сырья, менее токсичны.