Биотехнология - Ю.О. Сазыкин 2006
Общая биотехнология
Биобъекты: способы их создания и совершенствования
Инженерная энзимология. Иммобилизованные биообъекты
Биотехнология с момента зарождения была основана на ферментативных процессах. Однако вплоть до XX в. сведения о катализаторах белковой природы были минимальны. Лишь в наше время биотехнолог получил возможность опираться на глубокие знания структуры ферментов и механизмов ферментативных реакций.
С одной стороны, использование в биотехнологическом производстве ферментов в изолированном виде резко повысило его уровень в целом, а также предсказуемость результатов на каждой производственной стадии. Однако при этом пришлось решать проблему нестабильности многих ферментов. Дело в том, что изолированные ферменты не защищены системами клеточного гомеостаза, и большинство их в таком виде относительно быстро теряет активность, которая зависит даже от незначительных физико-химических изменений среды.
С другой стороны, при цикличности производственных процессов требуется постоянно повторяющаяся наработка высоко-очищенных ферментных препаратов, что связано с большой затратой сил и средств. Проблема была решена путем создания так называемых «промышленных биокатализаторов» — иммобилизованных ферментов.
В данном случае под иммобилизацией подразумевается связывание фермента с нерастворимым носителем при сохранении функциональной, т.е. каталитической активности фермента. Получение и использование иммобилизованных ферментов в промышленности, в том числе и в фармацевтической, составляет основу инженерной энзимологии. Иммобилизация ферментов не только существенно повышает их стабильность, но позволяет длительно использовать одну партию или серию промышленного биокатализатора.
За последние десятилетия параллельно с иммобилизацией ферментов развивалось и другое направление — иммобилизация целых клеток (прежде всего микробных) для осуществления многостадийного метаболического процесса, например биосинтеза антибиотика. Такие клетки после иммобилизации могут «работать» неделями и месяцами, не теряя при этом жизнеспособности.
Понятие «иммобилизация биообъекта» означает физическое разделение биокатализатора и растворителя, при котором молекулы субстрата и продуктов реакции могут свободно проникать из жидкой среды в твердую, и наоборот. Иными словами, субстрат в токе растворителя подводится к биообъекту, связанному с нерастворимым носителем, а продукт реакции в токе растворителя удаляется от биообъекта и используется как целевой продукт.
В качестве нерастворимого носителя используются неорганические и органические вещества, последние, в свою очередь, могут быть как природными, так и синтетическими.
Биообъект иммобилизуется на носителе:
✵ адсорбцией;
✵ за счет образования с ним ковалентных связей;
✵ включением в формируемый этим носителем гель.
В перечень материалов, применяемых для адсорбции биообъектов, входят: оксид алюминия, карбонат кальция, бентонит, уголь, целлюлоза, коллаген, ионообменные смолы, силикагель и т.д.
При ковалентном связывании ферментов используют агарозу, декстрин, целлюлозу, сополимеры полиакриламида, полиуретаны и т.д. В ряде случаев ковалентное связывание с носителем требует его предварительной активации, в результате которой на поверхности носителя образуются высокореакционноспособные электрофильные группы с нуклеофильными группами на белке (например, амино- и SH-).
При иммобилизации включением биообъекта в гель используют разные полисахариды, например гель альгината кальция (альгинат — гетерополисахарид из морских водорослей), полиакриламид (полиакриламидный гель) и другие полимеры. Весьма важным параметром при иммобилизации является максимальная «нагрузка» носителя, т.е. максимальное количество фермента, которое может быть иммобилизовано на определенном количестве носителя.
Каждый метод иммобилизации имеет свои преимущества и недостатки. Адсорбция — относительно «мягкий» метод связывания с нерастворимым носителем (без резкого снижения активности фермента). Однако фермент может связываться с носителем недостаточно прочно и легко десорбироваться при незначительных изменениях условий протекания каталитического процесса.
Связывание биообъекта с носителем за счет ковалентных связей, естественно, более прочно. Использование в производстве иммобилизованных биообъектов разных «типов» зависит от конкретных целей, стоящих перед биотехнологом. Например, если необходим катализ какой-нибудь одной ферментативной реакции, то, как правило, используется фермент либо изолированный, либо находящийся в интактной клетке, либо в клетке с повышенной проницаемостью оболочки; если же необходим полный биосинтез целевого продукта, то используется комплекс ферментов в интактной клетке включенных в многоэтапный биохимический процесс; и, наконец, если необходим биосинтез целевого продукта с его последующей трансформацией, то используются «системы, открытые для усложнения» (клетка + фермент И Т.П.).
В качестве биообъектов для иммобилизации могут быть использованы ферменты без кофермента (например, гидролазы и изомеразы) с прочно связанной с апоферментом простетической группой. Однако ферменты с диссоциирующими, расходуемыми в эквимолярном отношении к субстрату коферментами малопригодны для иммобилизации (требуется регенерация последних при непрерывно протекающей реакции). Трудности, связанные с применением таких ферментов в промышленности, снимаются, если используется фермент не изолированный, а содержащийся в жизнеспособной клетке (в этом случае обеспечены одновременно и доставка, и регенерация кофермента).
Если же целевой продукт является внутриклеточным, то для его извлечения из клеток приходится разрушать всю систему, поэтому возникает вопрос о целесообразности использования иммобилизации биообъекта. Однако в этом случае методами генетической инженерии может быть сконструирована и введена в продуцент система транспорта целевого продукта из клетки в среду.
Активность изолированного (и иммобилизованного) фермента, несмотря на все усилия по подбору оптимальных условий для его функционирования, остается ниже его активности в целой клетке. Поэтому для катализа конкретной реакции целесообразно применять фермент, сохраняющийся в клетке. Но это возможно лишь при условии, что и субстрат, и целевой продукт не будут подвергаться воздействию других ферментов клетки. Иногда этого воздействия можно избежать, регулируя температуру, величину pH и некоторые другие условия, в которых протекает нужная биотехнологу ферментативная реакция.
Вместе с тем эффективность работы фермента внутри клетки может быть лимитирована ее оболочкой, ограничивающей доступ субстрата к ферменту. Проницаемость оболочки клетки можно увеличить за счет кратковременной обработки ее органическими растворителями, например, 5% раствором диметилсульфоксида. При этом важно избежать неблагоприятного воздействия на внутриклеточный фермент, катализирующий нужную реакцию. В результате клетка должна быть «пермеабилитированной» (от англ. permeability — проницаемость), т. е. иметь повышенную проницаемость оболочки, но сохранять при этом жизнеспособность.
Включение в гель живых клеток, осуществляющих многостадийные ферментативные процессы, требует «мягких» условий иммобилизации и применения относительно малотоксичных носителей. Во-первых, должна быть обеспечена диффузия как молекул субстратов и частиц носителя в клетку, так и целевого продукта из клетки. Во-вторых, иммобилизованные клетки дышат, следовательно, для них должна быть сохранена возможность газообмена. В то же время носитель должен быть достаточно прочным. Существуют разные методы включения клеток биообъекта в гель; например, суспензия клеток смешивается с раствором альгината натрия, после чего в полученную смесь вносится раствор хлорида кальция (в избытке). В результате образуется гель альгината кальция с включенными в ячейки геля клетками. Процесс затвердевания заканчивается в течение примерно 20 мин.
В настоящее время активно разрабатываются подходы к созданию «систем, открытых для усложнения». В этом случае в одном биореакторе иммобилизуются синтезирующий определенное вещество продуцент и фермент, трансформирующий это вещество. В качестве примера можно привести одновременную иммобилизацию микроорганизма Penicillium chrysogenum продуцента бензилпенициллина и выделенного из Escherichia coli фермента пенициллинацилазы. В результате из синтезированного пенициллина образуется продукт его ферментативного гидролиза 6-аминопенициллановая кислота (ключевое соединение для синтеза новых пенициллинов). Система может быть вновь «усложнена» включением в нее еще одного иммобилизованного фермента, катализирующего присоединение к 6-аминопенициллановой кислоте нового радикала взамен отщепленного. В итоге при использовании такой совокупности промышленных биокатализаторов можно получать практически совершенно новые полусинтетические пенициллины (рис. 4).
Для работы с промышленными биокатализаторами используют биореакторы разных конструкций. Простейший биореактор колоночного типа (рис. 5, а) пригоден для использования, когда иммобилизованным биообъектом является только фермент, т. е. в реакторе происходит одностадийное превращение субстрата. Колонка заполняется сферическими частицами нерастворимого носителя со связанным ферментом. При малом диаметре частиц увеличивается площадь поверхности, улучшается диффузия субстрата и продукта реакции. Однако при этом возрастает перепад давления по высоте колонки. Поэтому в каждом конкретном случае подбираются оптимальные размеры частиц носителя с учетом таких параметров, как площадь поверхности, перепад давления и равномерность заполнения колонки. Если биообъектом являются иммобилизованные живые клетки с активным дыханием, то особое внимание обращается на диффузию газов. Применение простейшего реактора колоночного типа здесь нецелесообразно, поэтому используется его модификация. В верхней части такого реактора расположен патрубок для выхода газа (преимущественно СО2), а ниже — прочно закрепленная сетка с таким размером ячеек, при котором перемешивание и вспучивание частиц носителя сводится к минимуму (рис. 5, б). Третий тип — биореактор с мешалкой (рис. 5, в). Однако в этом случае необходимо помнить о возможности разрушения частиц носителя лопастями мешалки.
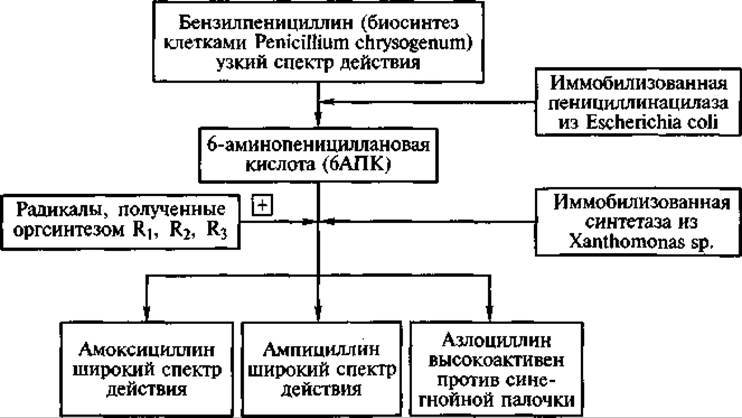
Рис. 4. Использование «системы, открытой для усложнения» в получении полусинтетических пенициллинов
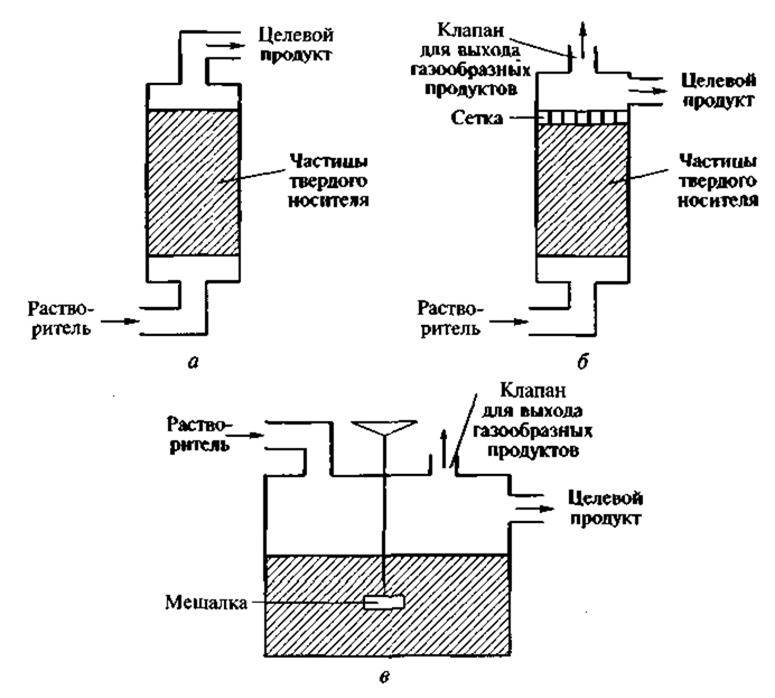
Рис. 5. Реакторы, используемые при иммобилизации биообъектов: а — колоночного типа; б — то же, модифицированный, в — с мешалкой
При иммобилизации целых клеток, осуществляющих многостадийный синтез целевого продукта, на этот процесс влияют:
✵ биосинтез целевого вещества, происходящий на фоне роста и размножения клеток продуцента;
✵ питательная среда, на разных стадиях биосинтеза меняющаяся по физико-химическим показателям и составу;
✵ отдельные «ферментации» или ферментационные циклы, варьирующие по количеству целевого продукта, а также примесей в культуральной жидкости, которые необходимо удалять.
В заключение можно привести примеры успешного применения методов инженерной энзимологии при производстве одной из важнейших групп лекарств микробного происхождения — беталактамных антибиотиков, а также — на производстве, выпускающем аминокислоты.
Процесс получения полусинтетических цефалоспоринов включает как «классические» биосинтез и оргсинтез, так и две ключевые стадии, в которых участвуют иммобилизованные ферменты — гидролаза из Pseudomonas sp. и синтетазы из Xanthomonas sp. и Е. coli. На рис. 6 показано последовательное применение ряда иммобилизованных ферментов при получении из цефалоспорина С (малоценного в практическом отношении природного цефалоспорина) полусинтетических оральных и инъекционных цефалоспоринов с разными спектрами действия, обладающих высокой эффективностью в клинике. В нижней части рис. 6 показаны различия в субстратной специфичности синтетаз из Е. coli и Xanthomonas sp. Первую целесообразно использовать для синтеза цефалотина, цефалоридина и цефазолина, а вторую — для получения цефалоглицина и цефоперазона. Иными словами, при замещении разными радикалами аминогруппы в 7-аминоцефало-спорановой кислоте (7АЦК) каталитическая активность сравниваемых синтетаз варьирует неодинаково в зависимости от структуры радикала.
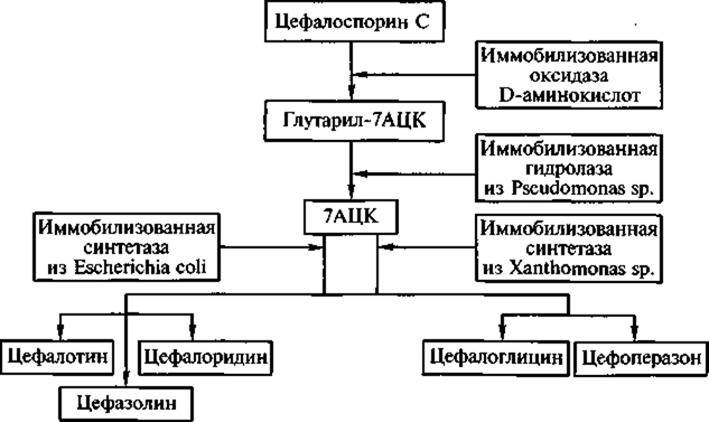
Рис. 6. Получение полусинтетических цефалоспоринов с помощью иммобилизованных ферментов
Несмотря на принципиальное сходство ключевых стадий при получении разными фирмами полусинтетических пенициллинов, носители для промышленных биокатализаторов могут быть разными. Обычно для иммобилизации как ферментов, так и клеток используют уже готовые коммерческие препараты активированных носителей («матриц»). В России разработан препарат пенициллинацилазы, состоящий из клеток Е.соlі, включенных в полиакриламидный гель; в США (фирма «Squibe») используется его аналог — пенициллинацилаза из почвенной споровой бактерии Bac.megaterium, сорбированная на бентоните; в Швеции (фирма «Astra») используется пенициллинацилаза из Е. coli, ковалентно связанная с активированным носителем полисахаридной природы.
В производстве аминокислот широко применяют иммобилизованные аминоацилазы в качестве реагентов для трансформации биологически активных веществ (например, N-ациламинокислот). Известно, что аминокислоты, получаемые химическим синтезом, представляют смесь L- и D-изомеров (рацемат), а организм человека способен утилизировать только L-изомеры; D-изомеры накапливаются в организме и могут оказывать вредное воздействие. Для разделения L- и D-изомеров в аминокислотном рацемате существуют разные химические способы, но наиболее простым и точным является ферментативное деление с помощью аминоацилазы. Этот фермент, обладая уникальной способностью гидролизовать ацильные производные всех природных аминокислот (за исключением пролина), проявляет свойство L-стереоспецифичности, т.е. гидролизует связь СО — NH только в ацильных производных L-изомеров, на примере N-ацетильного производного аминокислоты рассмотрим реакцию:
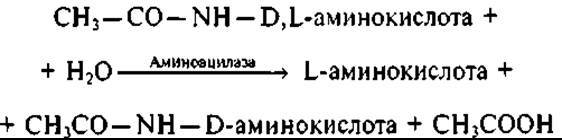
Используя разные растворимости, разделяют L-аминокислоту и N-ацетил-D-аминокислоту: при этом оказываются в растворе одна, а в осадке другая составляющая смеси. С помощью микробной аминоацилазы получают, например, L-фенилаланин (аминокислота, которая входит в состав препарата L-дофа, используемого для лечения болезни Паркинсона). L-изомеры аминокислот применяют при производстве панангина и квадевита, а D-изомеры — при получении некоторых полусинтетических химиотерапевтических средств. В частности, D-фенилглицин используют при изготовлении полусинтетического антибиотика ампициллина.
Экономические преимущества использования иммобилизованных биообъектов в условиях производства несомненны. Применение иммобилизованных систем позволяют сделать условия биосинтеза более стандартными, а все производство более компактным. Полученный биообъект работает длительно. При этом на единицу продукции расходуется меньше сырья. В случае производства фармацевтических препаратов целевое вещество не будет содержать компонентов культуральной жидкости (мицелия, продуктов частичного лизиса клеток, компонентов комплексной питательной среды и т.д.), что значительно облегчает задачу выделения и очистки целевого продукта, гарантирует отсутствие в получаемом препарате отсутствие белковых и других вредных примесей.
Значительны также и экологические преимущества: сокращаются количество отходов, а также число «нестандартных» операций, например, когда из-за нестерильности среды большие объемы культуральной жидкости сливаются в канализацию.
Контрольные вопросы
1. Какова роль биообъекта в биотехнологическом производстве? Что может быть использовано в качестве биообъектов в биотехнологии?
2. Какие свойства биообъекта можно использовать для его совершенствования в целях создания эффективного и безопасного производства лекарственных средств?
3. Что означает репарация биообъекта для биотехнологического производства лекарственных препаратов?
4. Как реализуются мутагенез и селекция в получении более продуктивных биообъектов?
5. Какие виды мутаций существуют?
6. В чем заключается принципиальное отличие методов клеточной инженерии от генной?
7. Что является ключевым моментом в создании новых рекомбинантных структур?
8. Какие факторы обусловливают выбор микроорганизма-продуцента при промышленном получении рекомбинантных белков?
9. Какие виды иммобилизации биообъектов наиболее перспективны?
10. Биореакторы каких типов используются для работы с промышленными биокатализаторами?