Биохимия и молекулярная биология - Белясова Н.А. 2002
Метаболизм. Процессы, приводящие к запасанию энергии
Дыхание
Характеристика компонентов дыхательной цепи
Компоненты дыхательной цепи представляют собой переносчики восстановительных эквивалентов, среди них присутствуют переносчики водорода и переносчики электронов. Причем их расположение в мембране строго определено: переносчики водорода чередуются с переносчиками электронов, и лучшие доноры электронов всегда предшествуют лучшим акцепторам.
Поскольку транспорт электронов и транспорт водорода являются сопряженными и эквивалентными процессами, дыхательную цепь можно рассматривать как цепь переноса электронов (электронтранспортную цепь). Ее основными компонентами служат флавопротеины, железосерные белки, хиноны и цитохромы.
Флавопротеины. Представляют собой ферменты, содержащие в качестве простетических групп FMN или FAD. Эти переносчики восстановительных эквивалентов охарактеризованы в главе 7. Следует подчеркнуть, что флавиновые кофакторы переносят водород и являются более сильными окислителями, чем NAD+.
Железосерные белки. Эти окислительно-восстановительные системы содержат атомы железа, связанные, с одной стороны, с серой аминокислотных остатков цистеина, а с другой — с неорганической сульфидной серой. Железосерные центры (рис. 12.1) можно рассматривать как простетические группы ферментов, имеющие, однако, структуру, отличную от гема. Поэтому железосерные белки называют еще белками с негемовым железом.
Число атомов железа и сульфидной серы в этих белках может различаться, но наиболее часто встречаются белки, содержащие 2Fe, 2S2- и 4Fe, 4S2-. Железосерные белки переносят только электроны. В частности, 2Fe, 2S2- центры транспортируют по одному электрону. При этом электроны не локализуются на атомах какого-то одного типа, а взаимодействуют и с ядрами железа, и с ядрами серы, т. е. находятся в делокализованном состоянии.
Железосерные белки принимают участие в фиксации молекулярного азота нитрогеназными системами, в восстановлении сульфитов и нитритов, в фотосинтезе, окислении алканов.
Хиноны. Это низкомолекулярные переносчики водорода, которые присутствуют во внутренней части липидного бислоя митохондриальных мембран в 10—15-кратном избытке по сравнению с другими компонентами электронтранспортной системы. Благодаря наличию неполярной гидрофобной цепи молекулы хинонов свободно перемещаются в липидном бислое. Различают несколько семейств хинонов, среди которых наиболее распространены убихиноны (в переводе с латинского —вездесущие хиноны), которые также называют коферментами Q (СоQ). Количество изопреноидных звеньев в молекуле хинона обозначают в виде подстрочного символа (Qn). Убихиноны митохондрий млекопитающих содержат 10 изопреноидных звеньев (Q10), а убихиноны бактерий — 6 (Q6). На рис. 12.1 представлена структура и стадии окисления—восстановления убихинонов.
Среди других групп хинонов известны пластохиноны (содержатся в мембранах хлоропластов, осуществляют транспорт водорода в фотосистемах), токоферолы (различные формы витамина Е с антиоксидантными функциями), филлохиноны и менахиноны (семейство витаминов группы К, участвуют в транспорте водорода у микобактерий, в свертываемости крови у млекопитающих). Дополнительные сведения об этих соединениях содержатся в главе 17.
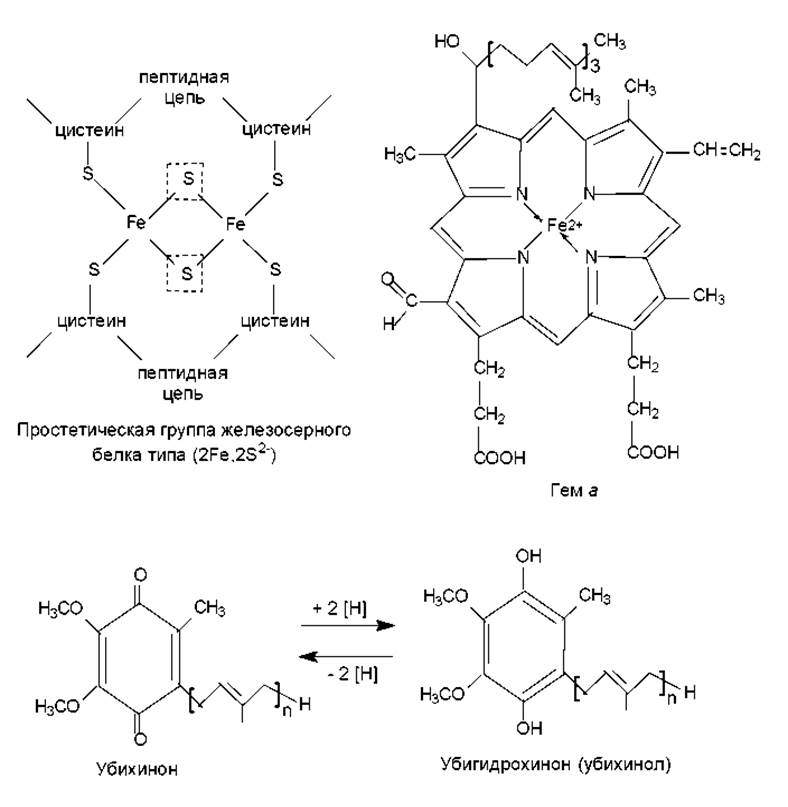
Рис. 12.1. Структура и особенности функционирования компонентов дыхательной цепи. В пунктирных рамках — сульфидная сера, способная отщепляться при подкислении в виде сероводорода
Цитохромы. Данные окислительно-восстановительные ферментные системы содержат в качестве простетической группы гем (рис. 12.1). Центральный атом железа в геме участвует в переносе электронов, изменяя свою валентность:
Гeм-Fe2+ ↔ Гeм-Fe3+ + e
Цитохромы являются переносчиками электронов, и некоторые из них (цитохромоксидаза) способны передавать электроны непосредственно на молекулярный кислород.
Различают множество цитохромов, выделенных из разных источников. Их принято обозначать сочетанием буквенных и цифровых символов: буквы обычно указывают на тип гема (например, a, b, c, o), а цифры — на значение длины волны a-полосы в спектре поглощения (например, 552; 557,5; 450). Для электронтранспортной системы особенно важно, что разные цитохромы характеризуются различными окислительно-восстановительными потенциалами и расположены в мембране в определенной очередности по отношению друг к другу. Только цитохром с, как полагают, находится в растворенном состоянии на внешней поверхности внутренней митохондриальной мембраны.