Биохимия и молекулярная биология - Белясова Н.А. 2002
Метаболизм. Процессы, требующие притока энергии
Метаболизм азотсодержащих соединений
Фиксация азота и включение его в состав органических молекул
Молекулярный азот представляет собой чрезвычайно инертное соединение, расщепление молекулы N2 требует больших затрат энергии. Из всех населяющих Землю организмов ферментативную фиксацию азота осуществляют лишь некоторые прокариоты. Данный процесс в их клетках катализируется нитрогеназной системой и осуществляется в процессе, который можно описать общим уравнением:
N2 + 6H+ + 6з + 12 ATP → 2NH3 + 12ADP + 12P; (16.1)
Нитрогеназная система бактерий локализуется во впячиваниях плазматической мембраны и состоит из двух компонентов: железосерного белка (4Fe 4S2-) и молибдоферредоксина (белок, содержащий молибден и железо). На одну молекулу молибдоферредоксина (MoFe) в активной нитрогеназной системе приходится 2 молекулы железосерного белка. Вспомогательными компонентами, участвующими в переносе электронов на нитрогеназную систему, служат флавиновые кофакторы и ферредоксин. Роль первичного донора электронов в этом процессе обычно выполняет NADPH.
Процесс переноса электронов на молекулярный азот (рис. 16.2) осуществляется следующим образом: донор электронов восстанавливает ферредоксин, который самостоятельно либо через флавин переносит электроны на железосерные центры нитрогеназной системы. Затем АТР связывается с железосерными белками и сдвигает их окислительно-восстановительный потенциал с - 0,29 В до -0,4 В путем изменения конформации белка. Подобное увеличение восстановительной способности железосерных белков позволяет им переносить электроны на молибдоферредоксин. На следующей стадии гидролизуется АТР, восстанавливается MoFe и нитрогеназная система диссоциирует на компоненты. Считается, что перенос пары электронов от восстановленной формы железосерных белков к молибдоферредоксину сопряжен с гидролизом четырех молекул АТР.
Восстановление молибдоферредоксина связано с переходом атома молибдена из окисленного состояния Мо(VI) в восстановленное Мо(IV), от которого электроны переносятся непосредственно на N2. Для полного восстановления молекулы азота до двух молекул NH3 требуется три последовательных 2-электронных перехода, которые будут сопряжены с гидролизом 12 (4 х 3) молекул АТР.
На симбиотическую азотфиксацию, в которой кроме нитрогеназной системы бактерий принимают участие и некоторые структуры растений, расходуется энергия, запасенная обоими организмами. Есть сведения, что в этом процессе потребляется до пятой части всей энергии, запасенной растением.
Нитрогеназная система восстанавливает не только молекулярный азот, но и ацетилен, азид, закись азота, цианид, нитриты и протоны. Перенос части восстановительных эквивалентов на Н+ осуществляется нитрогеназной системой в побочной реакции, поэтому наряду с аммиаком при фиксации азота всегда образуется молекулярный водород.
Сильным ингибитором нитрогеназной системы является молекулярный кислород: в его присутствии основные компоненты системы быстро инактивируются. Поэтому фиксация азота осуществляется в анаэробных участках клеток. Например, у клубеньковых бактерий специальная форма гемоглобина (леггемоглобин) защищает нитрогеназную систему от молекулярного кислорода, а у цианобактерий эту роль выполняют стенки гетероцист.
Следующей стадией включения азота в состав органических молекул является аминирование кетокислот, в результате которого возникают аминокислоты. Наиболее распространено восстановительное аминирование кетокислот. При этом основным продуктом, образующимся в данном процессе, является глутамат. Глутамат используется в качестве субстрата для включения еще одной молекулы аммиака, в результате чего синтезируется глутамин (рис. 16.3).
Перечисленные выше реакции имеют особое значение в биосинтезе аминокислот, поскольку катализирующие их ферменты наиболее активны, в результате чего данные процессы превращаются в основные пути включения аммиачного азота в состав аминокислот. В ходе последующих превращений аминогруппы глутамата и глутамина включаются в состав большинства других аминокислот. Подобные реакции носят название реакций трансаминирования.
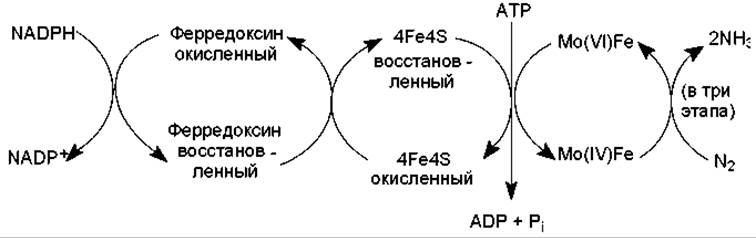
Рис. 16.2. Работа нитрогеназной системы прокариот при фиксации молекулярного азота (объяснения в тексте)
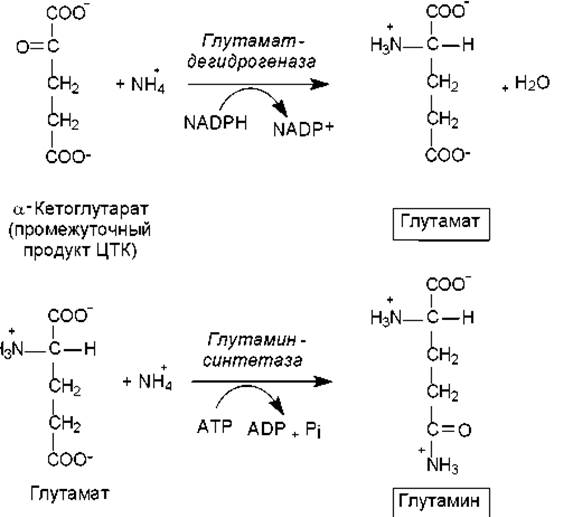
Рис. 16.3. Включение аммиака в состав аминокислот