БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ГЛАВА 18. МЕТАБОЛИЗМ НУКЛЕОТИДОВ
В ряде предыдущих, глав основное внимание уделялось образованию энергии из питательных веществ. При этом центральное место занимает АТР, хотя GTP, СТР и UTPтакже участвуют в различных реакциях метаболизма. Однако до сих пор мы в основном рассматривали фосфатные группы этих молекул. Природа оснований, будь то A, G, С или U, была важна только для их узнавания соответствующими ферментами и не имела прямого отношения к метаболическим процессам. По этой причине мы и не обсуждали раньше строение самих оснований.
В этой главе мы переходим к новой важной области биохимии - изучению механизма передачи информации; мы обратимся к нуклеиновым кислотам и процессу синтеза белка, а для этого необходимо знать структуру основных нуклеотидов. Эта глава посвящена структуре, синтезу и метаболизму нуклеотидов и является необходимой для понимания последующих глав.
Структура и номенклатура нуклеотидов
Термин нуклеотид происходит от названия нуклеиновых кислот, впервые обнаруженных в ядре (лат. nucleus), и представляющих собой полимеры нуклеотидов. Нуклеотидыимеют общую структуру: фосфат-сахар- основание,
Структуру нуклеозидов можно записать как сахар - основание.
Так, АМР и соответствующий нуклеозид, аденозин, имеют следующее строение:
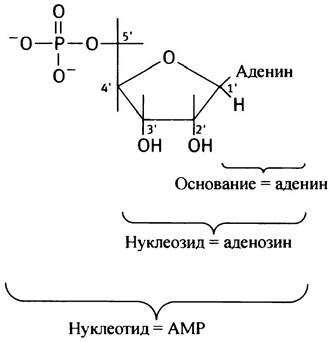
Строго говоря, АМР записана здесь как 5'-АМР. Штрих (') означает, что речь идет о нумерации атомов в цикле сахара рибозы, а не в адениновом цикле. Однако 5'-положение фосфата, как наиболее распространенное, обычно не отмечается. Поэтому 5'-АМР часто называют просто АМР, в то же время положение фосфата у третьего углеродного атома рибозы обязательно обозначается 3'-АМР.
Углеводный компонент нуклеотидов
Углеводный компонент нуклеотидов всегда представлен пентозой - чаще рибозой или 2'-дезоксирибозой, которые всегда имеют D-конфигурацию и никогда не встречаются в L-форме.
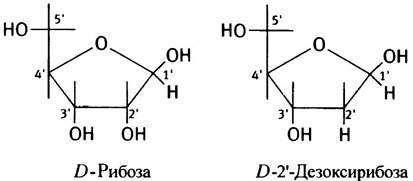
В РНК углевод всегда представлен рибозой (отсюда и название - рибонуклеиновая кислота), а в ДНК - дезоксирибозой (отсюда - дезоксирибонуклеиновая кислота). Нуклеотид, содержащий рибозу, является рибонуклеотидом, но это обычно не отмечается при написании; если не имеется специальных указаний, то нуклеотид, обозначенный как АМР, относится к рибонуклеотидам. При обозначении дезоксирибонуклеотидов либо используют приставку дезокси- (например, дезоксиаденозинмонофосфат), либо добавляют «d» к символу нуклеотида - dАМР (за единственным исключением, о котором ниже).
Основания нуклеотидов
Номенклатура
Прежде всего нас интересуют пять главных оснований - аденин, гуанин, цитозин, урацил и тимин, кратко обозначаемые первыми буквами своих английских названий. А, G, С и U обнаружены в РНК; А, G, С и Т - в ДНК.
Рибонуклеотиды обозначаются как AMP, GMP, СМР и UMP. Их старые, но еще употребляемые названия - соответственно адениловая, гуаниловая, цитидиловая и уридиловая кислоты (или аденилат, гуанилат, цити- дилат и уридилат - для их ионизированных при физиологических значениях pH форм). К дезоксирибо- нуклеотидам относятся dAMP, dGMP, dCMP и dTMP. Последний чаще обозначается ТМР (или тимидилат), без приставки d, поскольку Т обнаружен только в дезоксирибонуклеотидах (редких исключений мы касаться не будем).
Если необходимо обозначить нуклеотид без указания конкретного основания, то часто используют аббревиатура NMP или 5'-NMP для рибонуклеотидов и dNMP или 5'-dNMPдля дезоксирибонуклеотидов.
Дезокси- UMP встречается только в виде промежуточного соединения при синтезе dTMP; он не присутствует в ДНК (за исключением случаев ее химического повреждения).
Соответствующими рибонуклеозидами (основание-сахар) для дезоксирибонуклеозидов являются аденозин, гуанозин, цитидин, уридин и d-аденозин и т. д.
Названия цитидин и уридин созвучны с названиями свободных пуриновых оснований (сравните аденин и гуанин), в то же время название свободного основания цитозина похоже на название нуклеозида (сравните с аденозином), так что здесь необходимо быть внимательным. В транспортной РНК присутствуют и «минорные» основания (см. с. 287). Одним из них является гипоксантин. На пути биосинтеза пуриновых оснований еще образуются гипоксантинриботид и инозинмонофосфат; гипоксантинриботид называется инозинам.
Структура оснований
Прежде всего необходимо указать, что А и G - относятся к пуринам; а С, U и Т - к пиримидинам.
Эти термины произошли от соответствующих химических структур пурина и пиримидина, которые в свободном виде в природе не встречаются.
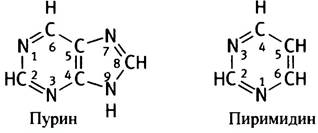
В дальнейшем эти циклы будут изображаться в упрощенном виде.

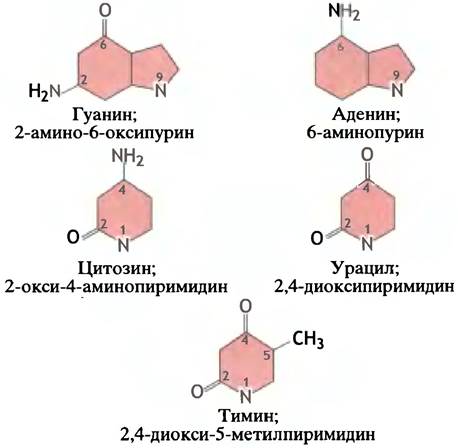
Структура оснований, входящих в состав нуклеотидов, представлена на рис. 18.1.
Рис. 18.1. Схематичное изображение структуры пуриновых и пиримидиновых оснований, обнаруженных в нуклеиновых кислотах
Присоединение оснований в нуклеотидах
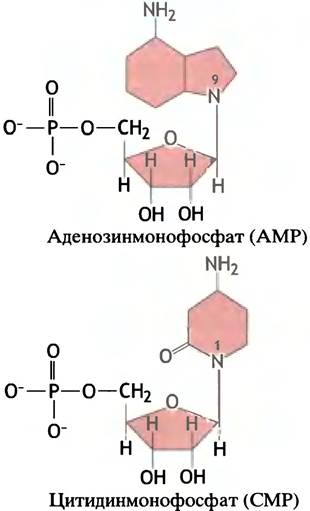
Основания присоединяются к углеводному компоненту нуклеотида через атом азота в 9 положении пурина и в 1 положении пиримидина. Гликозидная связь имеет β-конфигурацию; она расположена над плоскостью сахарного кольца. Структуры АМР и СМР приведены на рис. 18.2.
Рис. 18.2. Структура пуринового и пиримидинового нуклеотидов
Синтез пуриновых и пиримидиновых нуклеотидов
Пуриновые нуклеотиды
Большинство клеток может синтезировать пуриновые основания de novo из предшественников меньшего молекулярного веса. При этом основания не синтезируются в свободном виде, а пуриновый цикл собирается постепенно путем присоединения необходимых фрагментов к рибозо-5-фосфату, так что к моменту завершения построения цикла образуется готовый нуклеотид. Это касается только синтеза пуринов de novo, поскольку свободные пуриновые основания, образовавшиеся в результате деградации нуклеотидов, используются для их же синтеза (см. с. 222). Механизм присоединения к рибозо-5-фосфату (риботилирование) в обоих случаях одинаков. Он же используется и в ходе синтеза пиримидиновых нуклеотидов (но соединения, которые подвергаются риботилированию, различны). Это подводит нас к ФРПФ, метаболиту, участвующему в риботилировании.
5-Фосфорибозил-1 -пирофосфат (ФРПФ)
ФРПФ образуется из рибозо-5-фосфата, который в свою очередь, образуется в пентозофосфатном пути (см. главу 13) в результате переноса ферментом ФРПФ-синтетазойпирофосфатной группы с АТР.
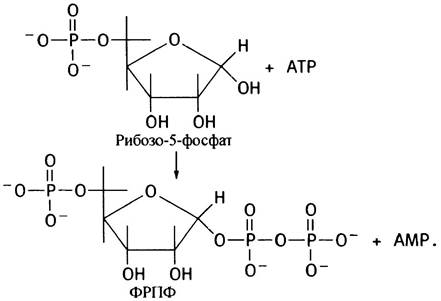
ФРПФ является «активированной» формой рибозо- 5-фосфата; соответствующие ферменты могут, достраивая его, образовать основания нуклеотидов и отщепить
пирофосфат. Реакция термодинамически направляется гидролизом последнего до 2Рi.
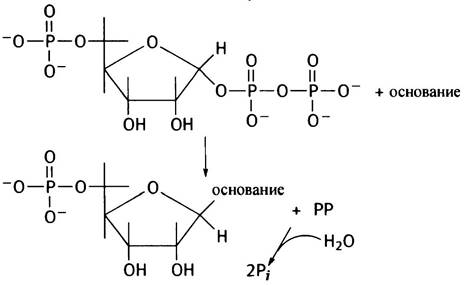
В этой реакции конфигурация С-1 -углеродного атома меняется так, что основание занимает нужное β-положение.
Обратите внимание, что при синтезе de novo (см. реакцию 1 на рис. 18.4) в качестве основания выступает просто NH2-группа, полученная из глутамина; продуктом реакции является 5-фосфорибозиламин. При реутилизации пурина в качестве основания используется уже готовый пурин. Обычно термин нуклеотид ассоциируется с пуриновыми или пиримидиновыми основаниями, но он может быть применен и к другим основаниям, связанным с сахарофосфатом подобным образом.
Вернемся от общей схемы к синтезу пуринов de novo. После образования 5-фосфорибозиламина осуществляется 9 последовательных реакций, завершающихся сборкой первого пуринового нуклеотида с гипоксантином в качестве основания (рис. 18.3). Этим нуклеотидом является IMP, или инозиновая кислота.
Рис. 18.3. Схематичное изображение синтеза пуринов GMP, АМР и ХМР de novo. Основание в IMP, или инозинмонофосфате, - гипоксантин. Основанием в ХМР, или ксантозинмонофосфате, является ксантин
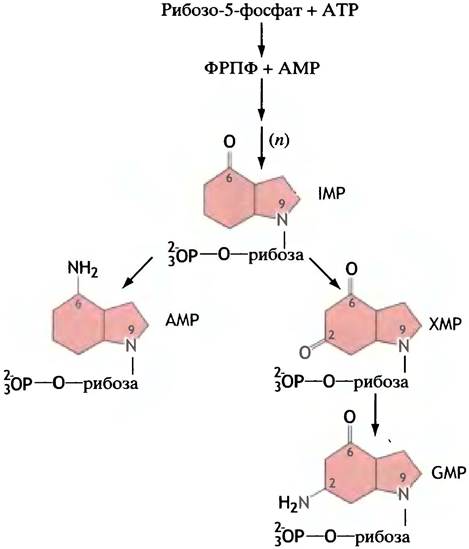
IMP служит своеобразным метаболическим перекрестком, так как его основание гипоксантин превращается или в аденин, или в гуанин, образуя соответственно АМР или GMP. Этот путь кратко представлен на рис. 18.3; и все реакции этого процесса приведены на рис. 18.4 и 18.5. Обсудим наиболее интересные реакции. Для синтеза 1 молекулы пуринового нуклеотида используется 6 молекул АТР. При этом от АТР отщепляются только фосфатные группы, а адениновый нуклеотид не претерпевает никаких изменений, так что все сводится к синтезу АМР. Разберем реакции (3) и (9) на рис. 18.4, которые имеют особое значение, поскольку они относятся к реакциям переноса одноуглеродных фрагментов.
Рис. 18.4. Последовательность реакций синтеза de novo пуринового цикла из ФРПФ до инозиновой кислоты. Реакции, отмеченные цифрами в кружках, обсуждаются в тексте. Выделены структурные изменения, произошедшие в результате очередной реакции цикла
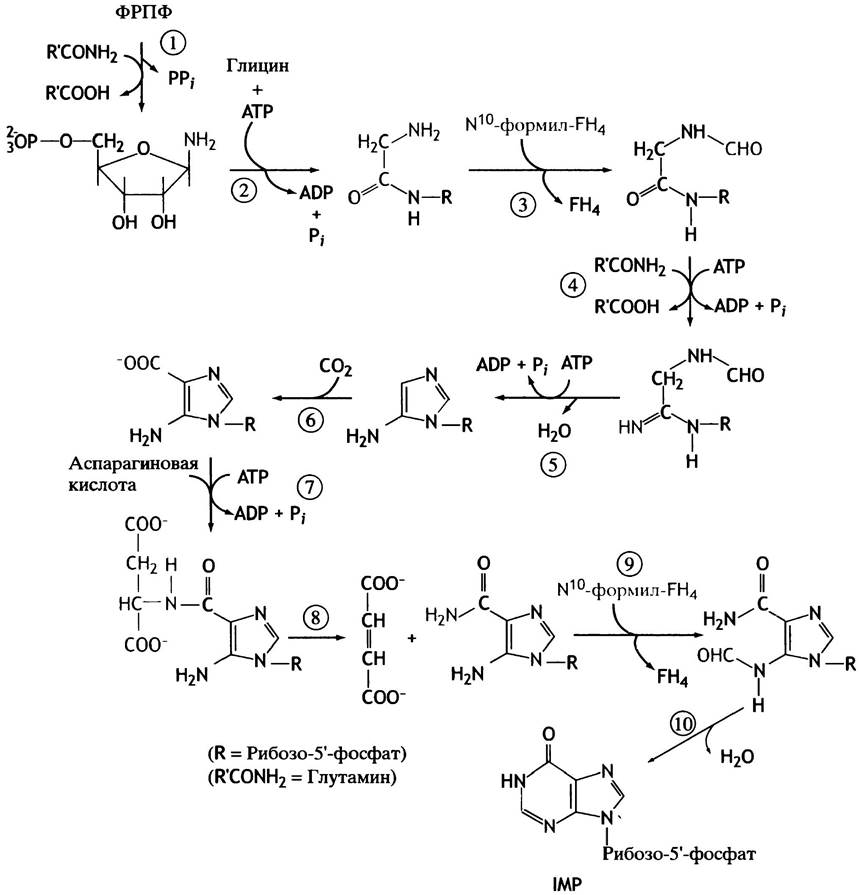
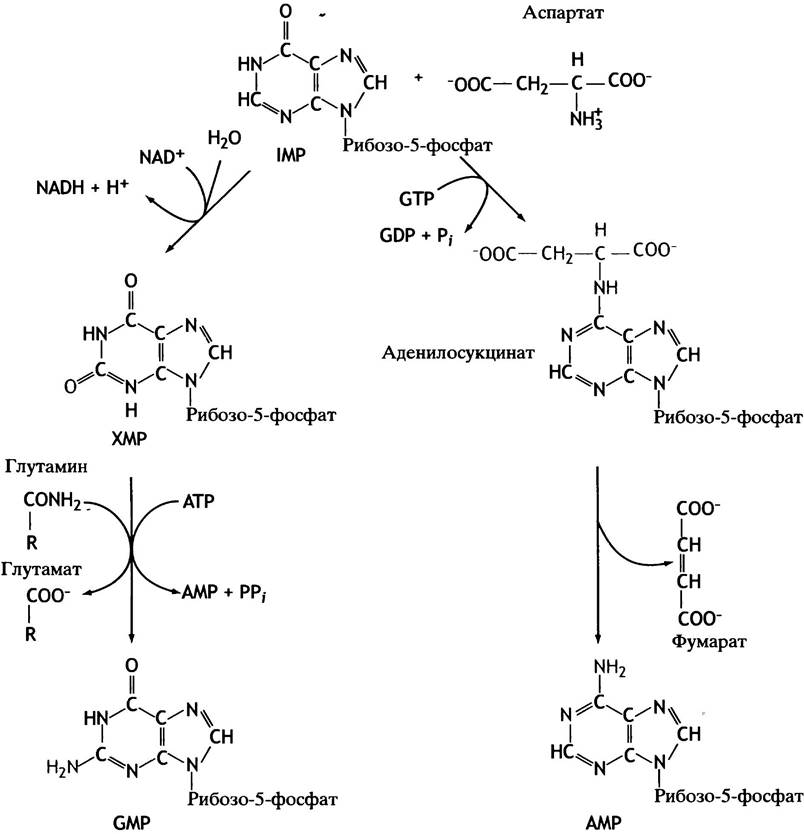
Рис. 18.5. Синтез GMP и АМР из инозиновой кислоты (IMP). Выделены структурные изменения, произошедшие в результате очередной реакции
Реакции одноуглеродного переноса в синтезе пуриновых нуклеотидов
Реакции синтеза (3) и (9) включают введение формильной (НСО-) группы в промежуточные продукты синтеза. Донором этих групп в обоих случаях служит
N10-формилтетрагидрофолат. В клетке тетрагидрофолат (FН4) является переносчиком формильных групп. Это кофермент, образующийся из витамина - фолиевой кислоты(F), или птероилглутаминовой кислоты.
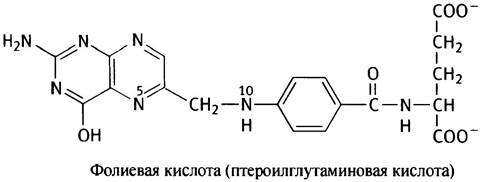
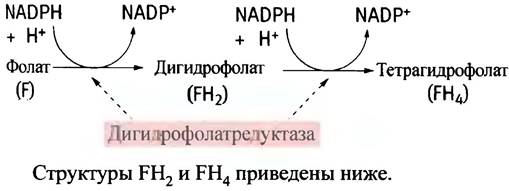
Витамин F восстанавливается до FH4 с участием NADPH в две стадии.
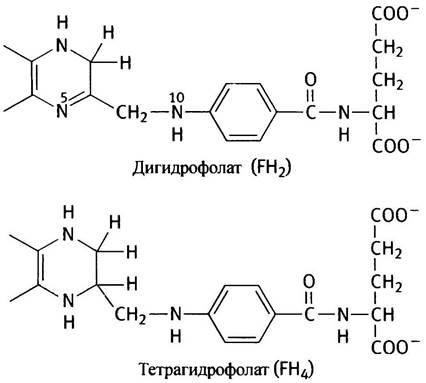
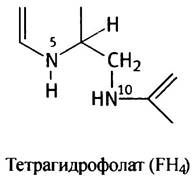
Заметим, в структуре FН4 атомы N-5 и N-10 расположены таким образом, что только один углеродный атом может заполнить промежуток между ними. Для наших целей можно представить FН4 в таком виде:
А N10-формилтетрагидрофосфат в таком виде:
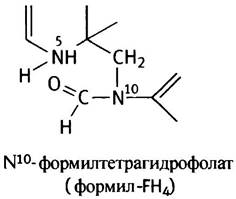
Это донор формильной группы в реакциях (3) и (9) биосинтеза пуринов; катализирует эти реакции формилтрансфераза.
Откуда поступает формильная группа в формил-FН4?
Формильная группа поступает из аминокислоты серина (который легко синтезируется из промежуточного продукта гликолиза 3-фосфоглицерата).
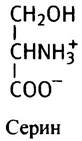
Фермент серингидроксиметилаза переносит гидроксиметильную группу (-СН2ОН) на FН4, в результате образуются глицин и N5, N10-метилен-FН4.
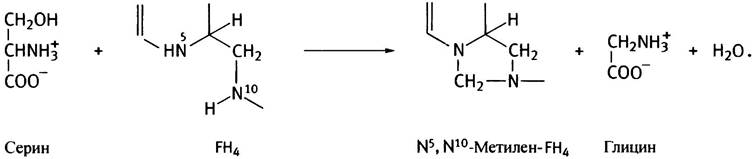
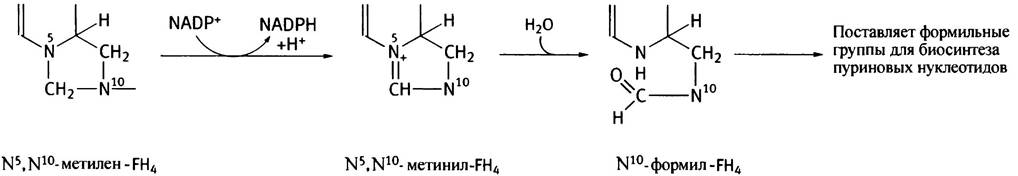
Образовавшийся метилен-FН4 еще не готов для участия в реакции формилирования, поскольку СН2-группа более восстановлена, чем формильная группа.
Метиленовая группа окисляется NАDР+-зависимым ферментом до метинильного производного, которое после гидролиза превращается в N10-формил-FН4 - донор формильной группы.
Как образуются ATP и GTP из АМР и GMP?
Для протекания большинства синтетических реакций в клетке необходимы нуклеозидтрифосфаты. Прежде всего, они нужны для синтеза нуклеиновых кислот. Существует простое, но очень интересное решение этого вопроса: в клетке есть ферменты киназы, которые на высокоэнергетическом уровне осуществляют перенос фосфатных групп между нуклеотидами. Поскольку изменение свободной энергии в этой реакции незначительно, то перенос фосфатной группы от нуклеотида к нуклеотиду происходит легко. Основным источником фосфатных групп служит АТР. Необходимо помнить, что энергия, образующаяся в результате метаболических процессов, постоянно используется для регенерации АТР из ADP и Рi. Синтезированные de novo АМР и GMP фосфорилируются киназами, как показано ниже.

Реутилизация пуриновых оснований при синтезе нуклеотидов
Мы уже подчеркивали, что синтез пуринов de novo не дает свободных пуриновых оснований - сразу образуются пуриновые нуклеотиды. Однако существует путь синтеза пуриновых нуклеотидов, в котором свободные основания превращаются в нуклеотиды после взаимодействия с ФРПФ. Свободные основания образуются в процессе деградации нуклеотидов; они не подвергаются дальнейшему расщеплению, а сберегаются. В этом процессе участвуют два фермента - две фосфорибозилтрансферазы. Один из них образует нуклеотиды из аденина, а другой из гипоксантина и гуанина. Второй фермент, известный как ГГФРТ (гипоксантин-гуанин- фосфорибозилтрансфераза), катализирует следующую реакцию.
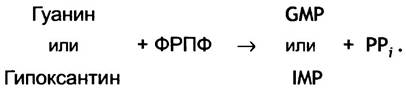
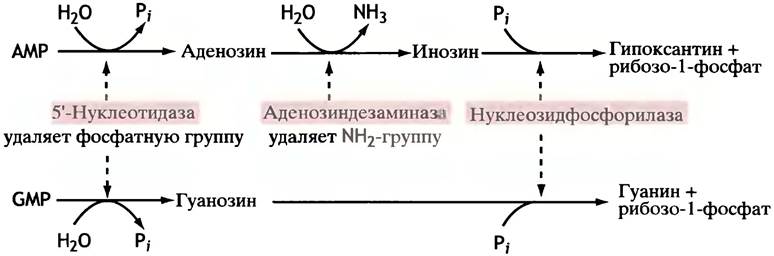
По всей видимости, у человека сбережение аденина имеет меньшее значение по сравнению с гуанином и гипоксантином, поскольку основные пути распада этих нуклеотидов приводят к образованию свободного гипоксантина (из АМР) и гуанина (из GMP) (рис. 18.6).
Рис. 18.6. Схема синтеза свободных пуриновых оснований из гипоксантина и гуанина, образующихся при деградации нуклеотидов. Больные, у которых в лимфоцитах отсутствует аденозиндезаминаза, страдают иммуннодефицитом. Лечение этого заболевания стало первым успешным применением метода генной терапии - введение in vitroнормального гена аденозиндезаминазы в стволовые клетки костного мозга с последующей пересадкой их пациенту
Какова физиологическая роль реутилизации пуриновых оснований?
Так как синтез пуринов требует весьма большого количества энергии механизм реутилизации свободных пуриновых оснований выгоден, так как позволяет клетке ограничить синтез de novo. Кроме того, эритроциты, например, не способны синтезировать пурины de novo и используют только имеющиеся готовые основания.
Физиологическое значение реутилизации пуринов особенно наглядно демонстрирует генетическое заболевание у детей — синдром Леша-Нихана, связанный
с отсутствием фермента ГГФРТ. Он приводит к неврологическим патологиям и проявляется в умственной отсталости, нарушении координации движений и агрессивности, часто направленной против самого себя и приводящей к различным травмам. В мозге синтез de novo выражен слабо, и потому этот орган так чувствителен к нарушениям в процессе реутилизации оснований. Отсутствие реакций реутилизации пуриновых оснований у таких больных сопровождается избыточным синтезом пуриновых нуклеотидов de novo в печени и возрастанием уровня ФРПФ. Этим объясняется тот факт, что у больных резко увеличивается образование мочевой кислоты, как и при подагре, что может привести к повреждению почек кристаллами уратов. Связь между биохимическим дефектом и неврологическими симптомами при заболевании Леша-Нихана не совсем ясна. Хотя гиперпродукцию мочевой кислоты можно снизить аллопуринолом, это не облегчает неврологическую симптоматику. Следует отметить, что у больных подагрой неврологическая симптоматика не выражена.
Источников свободных пуриновых оснований, используемых для ресинтеза пуринов, скорее всего, несколько. Хотя пищевые продукты содержат пурины в виде нуклеиновых кислот, есть данные, свидетельствующие о том, что большая их часть разрушается эпителиальными клетками кишечника и не поступает в кровь. Напротив, пурины, введенные в кровоток, утилизируются клетками. Место синтеза большинства пуринов - печень. Доказано, что она высвобождает их в кровь для использования другими клетками, например, ретикулоцитами, которые не обеспечены полной системой синтеза de novo. Возможно также, что клетки используют пуриновые основания, образовавшиеся при распаде нуклеиновых кислот. При лизосомальном разрушении компонентов клеток, содержащих нуклеиновые кислоты, по- видимому, освобождаются преимущественно свободные основания. И хотя значение синтеза пуриновых оснований из фрагментов не вызывает сомнений, мы не располагаем полной информацией о перемещении свободных оснований в организме.
Повторное использование образованных ранее пуриновых оснований, конечно, имеет явное преимущество по энергетическим затратам, что ведет к соответствующему снижению уровня их синтеза de novo. Это достигается двумя путями: во-первых, реутилизация снижает уровень ФРПФ и, следовательно, вклад всего пути в образование пуринов; во-вторых, образовавшиеся в процессе реутилизации пуриновых оснований АМР и GMP осуществляют ингибирование по типу обратной связи.
Образование мочевой кислоты из пуринов
Распад нуклеотидов приводит к образованию свободных гипоксантина и гуанина. Часть из них снова преобразуется в нуклеотиды, а часть окисляется с образованием мочевой кислоты (рис. 18.7).
Рис.18.7. Превращение гипоксантина и гуанина в мочевую кислоту. Лекарственный препарат аллопуринол близок по структуре к гипоксантину. Под действием ксантиноксидазы аллопуринол превращается в аллоксантин, который, в свою очередь, ингибирует ксантиноксидазу
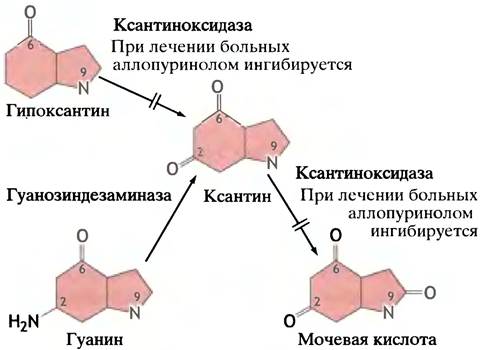
Фермент ксантиноксидаза, образующий мочевую кислоту, присутствует в основном в печени и клетках слизистой кишечника. Подагра обусловлена повышением содержания уратов в крови, что сопровождается отложением их кристаллов в тканях. По-видимому, основным источником мочевой кислоты скорее всего является избыточное образование de novo пуриновых нуклеотидов, вызванное у некоторых пациентов повышенной активностью ФРПФ-синтетазы. К избыточному синтезу пуриновых нуклеотидов приводит также дефицит фермента ГГФРТ. Лекарственный препарат аллопуринол, применяемый для лечения подагры, по структуре сходен с гипоксантином.
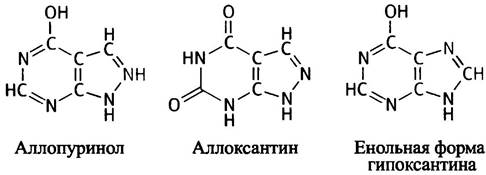
В организме под действием самой ксантиноксидазы аллопуринол превращается в аллоксантин - ингибитор ксантиноксидазы. Этот процесс известен как суицидное ингибирование, или самоинактивация. Он приводит к преимущественному накоплению ксантина и гипоксантина, а не мочевой кислоты (см. рис. 18.7). Эти продукты более водорастворимы, чем мочевая кислота, и быстрее выводятся из организма, предотвращая таким образом отложение нерастворимых кристаллов мочевой кислоты в тканях и снимая клинические симптомы подагры.
Регуляция синтеза пуриновых нуклеотидов
Как и во всех метаболических путях, во избежание химического хаоса необходима четкая регуляция синтеза пуриновых нуклеотидов. Путь синтеза de novo является классическим примером аллостерического ингибирования по принципу обратной связи (англ. feedback). «Местом контроля» является первая (обратимая) реакция синтеза пуринов. De novo ее катализирует ФРПФ-синтетаза, ингибируемая AMP, ADP, GMP и GDP. Следующий фермент, катализирующий первую необратимую реакцию синтеза пуриновых нуклеотидов (см. рис. 18.4, реакция 2), ингибируется так же, как и предыдущий (рис. 18.8).
Рис. 18.8. Упрощенное изображение регуляции пути биосинтеза пуриновых нуклеотидов. Положительная обратная регуляция АТР и GTP осуществляется на уровне энергетического обеспечения реакций
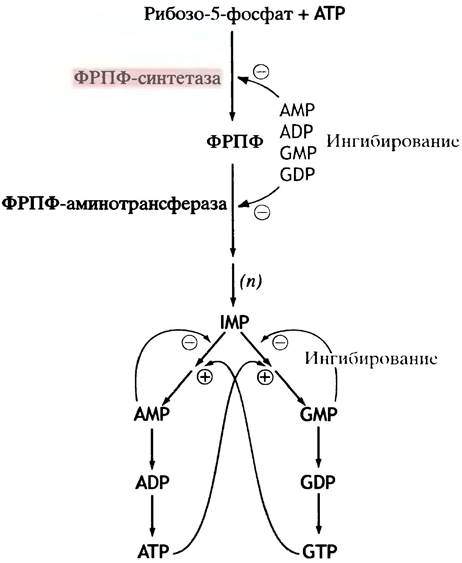
Однако этим дело не заканчивается, поскольку в процессе синтеза de novo образуется IMP, который затем расходуется на образование АМР и GMP. Эта реакция регулируется продуктами по принципу обратной связи (см. рис. 18.8). Как положительные, так и отрицательные регуляторные механизмы служат для сбалансированного образования АТР и GTP, поскольку оба нуклеотида требуются для биосинтеза нуклеиновых кислот (см. главу 19).
Синтез пиримидиновых нуклеотидов
Большинство клеток организма синтезирует пиримидиновые нуклеотиды de novo. В отличие от бактерий, у млекопитающих путь реутилизации свободных пиримидиновых оснований не выражен так ярко, как для пуринов. Однако нуклеозид тимидин легко фосфорилируется до ТМР под действием тимидинкиназы; таким образом, ресинтез этого нуклеотида имеет место.
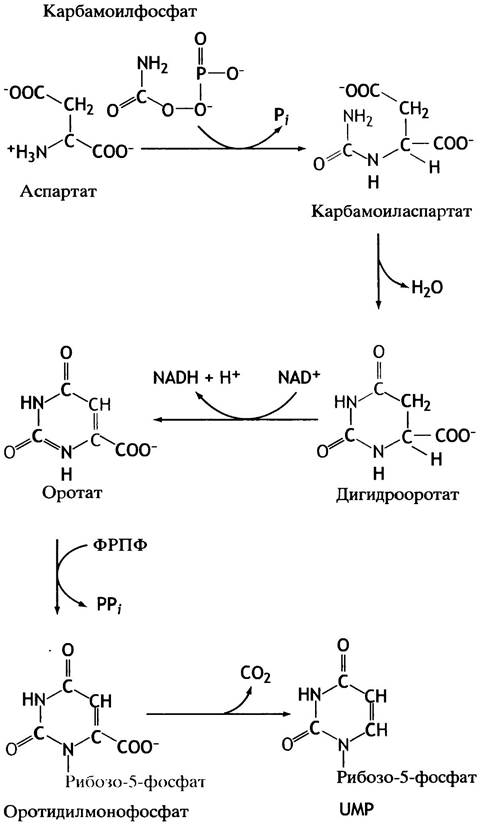
Путь синтеза пиримидинов схематично представлен на рис. 18.9 и полностью приведен на рис. 18.10. Он начинается с аспарагиновой кислоты и приводит к образованию вещества с циклической структурой — оротовой кислоты. Оротовая кислота в ходе реакции ФРПФ превращается в соответствующий нуклеотид, а тот в свою очередь превращается в UМР. Подобно пуринам, UТР образуется под действием ферментов киназ, а СТР - при аминировании UТР.
Рис. 18.9. Синтез пиримидиновых нуклеотидов включает превращение СТР в СDР. Полностью путь синтеза пиримидинов представлен на рис. 18.10
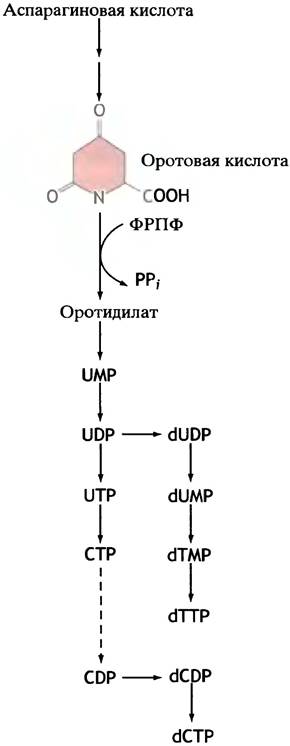
Рис. 18.10. Путь синтеза пиримидиновых нуклеотидов de novo. Цветом выделены структурные изменения, которые произошли в предшествующей реакции
Как образуются дезоксирибонукпеотиды?
Для синтеза ДНК необходимы dАТР, dGТР, dСТР и dТТР (см. главу 19). Восстановление рибонуклеотидов до дезокси-производных происходит на уровне дифосфатов при использовании NАDРН в качестве восстановителя (процесс переноса электронов на редуктазу не приведен).
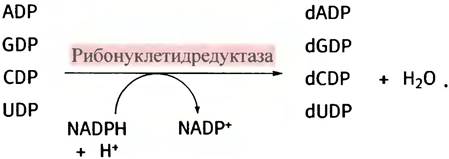
Образовавшиеся dADP, dGDP, dCDP и dUDP превращаются в трифосфаты в результате их фосфорилирования соответствующими киназами с использованием АТР. Однако dUTP не участвует в синтезе ДНК, поскольку ДНК в качестве одного из своих оснований содержит тимин (метилированный урацил), но никак не урацил. dUTP превращается в dTTP. Это происходит в три этапа. На первом dUTP гидролизуется до dUMP:
dUTP + Н2O —> dUMP + PPi.
Затем dUMP превращается в dTMP, который после фосфорилирования преобразуется в dTTP. Для поддержания баланса образования четырех дезоксинуклеотид- трифосфатов существует система аллостерической регуляции по принципу обратной связи.
Превращение сUМР в dТМР
Метилирование dUМР представляет особый интерес. Участвующий в этом процессе фермент тимидилатсинтетаза использует в качестве кофермента метилентет- рагидрофолат (N5, N10-метилен FН4).
На приведенной ниже схеме представлена только наиболее важная (для рассматриваемых проблем) часть N5, N10-метилен-FН4.
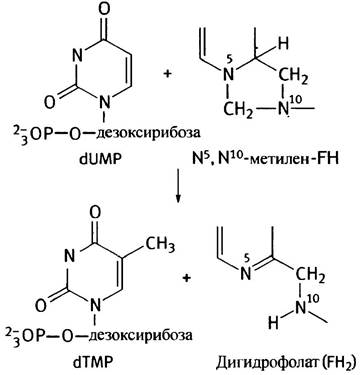
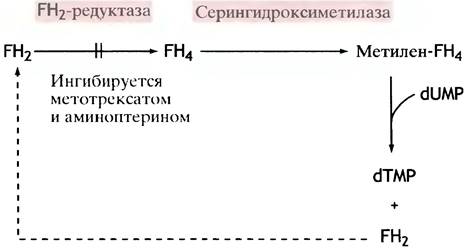
Напомним, что в синтезе пуринов метиленовая группа FН4 окислялась с образованием формильной группы. При синтезе тимидилата метиленовая группа переносится и одновременно восстанавливается до метальной группы тимина; реакцию катализирует тимидилатсинтетаза. Восстановителем служит FН4, который в ходе реакции превращается в FН2.
Образованный в этой реакции FН2 восстанавливается до FН4 под действием дигидрофолатредуктазы. В свою очередь, FН4 может быть превращен в метилен-FН4 в реакции с серином:
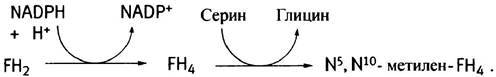
Для продолжения синтеза тимидилата под действием дигидрофолатредуктазы FН2 должен быть восстановлен до FН4. Антилейкемические препараты метотрексат (аметоптерин) и аминоптерин (их называют антифолатами), являясь структурными аналогами фолата, ингибируют FН2-редуктазу.
Приведенную ниже структуру метотрексата (аметоптерина) запоминать не нужно; аминоптерин имеет похожую структуру, но без N10-метильной группы.
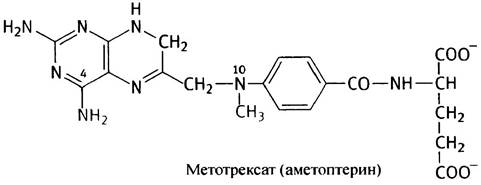
Раковые клетки, например, лейкозные, для синтеза ДНК требуют быстрого образования dТМР, а с помощью этих лекарственных препаратов оно может быть избирательно заторможено. Схема представлена на рис. 18.11.
Рис. 18.11. Действия противоопухолевого препарата метотрексата (схематично). Сравните его структуру со структурой фолиевой кислоты, изображенной на с. 219
Тетрагидрофолат, витамин В12 и пернициозная анемия
Помимо участия в приведенной выше реакции, N5, N10-метилен-FН4 может восстанавливаться до N5-метил-FН4, поставляющего метальные группы для превращения гомоцистеина в метионин (см. с. 199) в реакции, катализируемой метионинсинтазой. Последней в качестве кофактора необходим витамин В12 (см. с. 136). При его отсутствии, например, при заболевании пернициозной анемией, имеющиеся запасы FН4 превращаются в метил-FН4 и становятся недоступными для участия в биосинтезе пуриновых нуклеотидов и других реакциях. Гипотеза «метальной ловушки» объясняет тот факт, что недостаток витамина В12 вызывает мегалобластическую анемию, идентичную наблюдаемой при дефиците фолата. Неврологические симптомы пернициозной анемии могут быть обусловлены метилмалоновым ацидозом (см. с. 136).
Хотя у бактерий существует несколько реакций, зависимых от витамина В, у человека их известно только две. Эти реакции катализируются метилмалонил-СоА-мутазой (см. с. 136) и метионинсинтазой. Недостаток витамина В12 при пернициозной анемии связан в большей степени с отсутствием внутреннего фактора — желудочного гликопротеина, необходимого для всасывания витамина в кишечнике, чем с недостаточным его поступлением с пищей.
Вопросы к главе 18
1. Опишите механизм риботилирования.
2. Какой кофактор участвует в двух реакциях синтеза пуриновых нуклеотидов? Приведите структурные формулы его формильного производного.
3. Каково происхождение формильной группы? Используя структурные формулы кофактора, объясните, как она образуется.
4. Что является функцией гипоксантин-гуанин-фосфорибозилтрансферазы (ГГФРТ)?
5. Синдром Леша-Нихана включает несколько генетических заболеваний. Объясните их биохимическую природу.
6. Как лекарственный препарат аллопуринол снижает образование мочевой кислоты?
7. Нарисуйте схему, иллюстрирующую основные пути аллостерической регуляции синтеза пуриновых нуклеотидов.
8. Некоторые соединения в организме метилируются с использованием в качестве источника метильных групп метионина. Справедливо ли это в случае синтеза тимидинмонофосфата? Обоснуйте ответ.
9. Как антилейкемическое лекарство метотрексат ингибирует репродукцию раковых клеток?
10. Симптомы пернициозной анемии в некоторой степени напоминают симптомы, связанные с недостатком фолата. В чем заключается возможная причина этого?