БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ГЛАВА 25. ИММУННАЯ СИСТЕМА
Организм постоянно находится под угрозой заражения различными патогенными агентами, например, бактериями и вирусами. Им противостоит иммунная система. Смерть больных с генетическими (дефицит аденозиндез- аминазы, см. рис. 18.6) или приобретенными (СПИД) нарушениями иммунной системы красноречиво свидетельствует о жизненно важном значении иммунитета.
Иммунная система защищает организм от макромолекул нескольких типов, наиболее важными среди которых являются белки. Особенна важна защита от посторонних белков. Вместе с тем иммунная система не реагирует на небольшие чужеродные молекулы, например, на лекарства, которые, попадая в организм, становятся «добычей» других систем химической защиты (см. главу 17). Поступление чужеродной макромолекулы в организм служит для него предупреждением о необходимости защиты против «оккупанта».
Впрочем, у больных возможны аллергические реакции и на небольшие молекулы, например, на пенициллин. Однако в этом случае организм реагирует не на сам пенициллин, а на комбинацию его с другой макромолекулой, например, с белком. В результате этой комбинации белок организма начинает «выглядеть» чужеродным для иммунной системы.
Из главы 4 вы, наверное, помните, что одной из главных задач пищеварительной системы является предотвращение самопереваривания, т. е. разрушения организмом самого себя. Аналогичная проблема стоит и перед иммунной защитой.
В отличие от распознавания липополисахаридных компонентов бактериальной клетки, которые отличаются от соответствующих компонентов любых бактерий, присутствующих в нашем организме, и могут быть, следовательно, легко отнесены к чужеродным, проблема распознавания посторонних белков гораздо сложнее. В самом организме есть тысячи белков, отличающихся от чужеродных только отдельными аминокислотными последовательностями, так что сортировка «своих» и «чужих» белков должна проводиться с большой осторожностью.
Когда иммунная система совершает ошибку и атакует один из собственных белков, может возникнуть аутоиммунное заболевание. Например, миастения - аутоиммунная реакция, в результате которой разрушаются ацетилхолиновые рецепторы мышцы (см. с. 384) и нервная стимуляция сокращения становится невозможной. При ревматической лихорадке иммунный ответ против белка, продуцируемого некоторыми штаммами Streptococcus, сопровождается образованием антител, перекрестно реагирующих с сердечными белками и вызывающих повреждение сердечных клапанов. Инсулинзависимый диабет возникает при аутоиммунной атаке панкреатических клеток.
У иммунной системы существуют два защитных механизма
Первый - образование антител. Антитела - растворимые белки, секретируемые клетками иммунной системы, которые специфически связываются с чужеродными веществами - антигенами (от англ. antibody generation). Антигеном называют любую молекулу, способную вызвать специфический иммунный ответ, в данном случае - с образованием антител. Образование комплекса антиген-антитело приводит к развитию защитных реакций, о которых будет рассказано позже. Такой тип иммунитета называется гуморальным иммунитетом (от лат. humor жидкость); этот механизм защиты обусловлен присутствием растворимых антител в жидких средах организма.
Второй тип иммунитета, в ходе реализации которого особые цитотоксические, или киллерные клетки узнают аномальные клетки в организме, известен как клеточный иммунитет. Он работает в клетке, например, при вирусной инфекции. Киллерная клетка прикрепляется к инфицированной вирусом клетке и разрушает ее. Это эффективный путь защиты от дальнейшего распространения вирусной инфекции, поскольку разрушение клеток прерывает репликацию вируса. Основным моментом данного механизма является прямой контакт между киллерной клеткой и клеткой-мишенью - отсюда и термин клеточный иммунитет. Гуморальный и клеточный иммунитеты дополняют друг друга. В рассмотренном нами примере вирусной инфекции гуморальная система обеспечивает защиту до инфицирования клетки вирусом, а клеточная система разрушает клетку-хозяина после ее инфицирования, что позволяет прервать репликацию вируса в этой клетке.
Антитела вырабатываются особой группой лимфоцитов, называемых плазматическими клетками (разновидность лейкоцитов), которые образуются при
соответствующей стимуляции В-клеток (В-лимфоцитов). Цитотоксическими (киллерными клетками) являются Т-лимфоциты (буква «Т» указывает на место их образования-тимус, т. е. вилочковую железу, которая у человека располагается за грудиной). Все лимфоциты постоянно образуются в костном мозге (у плода - в печени). В-клетки созревают в костном мозге.
Есть очень важное условие в «разделении труда» между В- и Т-лимфоцитами. Для того чтобы В-клетка стала вырабатывать антитела, она должна, во-первых, встретить антиген, а во-вторых, вступить в контакт с особым типом Т-клетки, которая уже «познакомилась» с тем же антигеном. Так как эта Т-клетка «помогает» В-клетке выполнять свои функции, ее называют хелперной Т-клеткой (от англ. help - помогать). Хелперные Т-клетки - самостоятельная группа клеток, отличающаяся от цитотоксических Т-клеток.
Итак, в организме есть зрелые В-клетки, которые вырабатывают антитела, хелперные Т-клетки, помогающие В-клеткам образовывать антитела, и цитотоксические (киллерные) Т-клетки, ответственные за клеточный иммунитет.
Где в организме локализована иммунная система?
Клетки иммунной системы не сгруппированы в один орган, а распределены по организму: 30% находятся в селезенке, 20% - в лимфатических узлах, 40% - в кишечной и слизистой лимфоидной ткани и 10% - в кровеносных и лимфатических сосудах. Для гуморального и клеточного иммунитета главными клетками являются лимфоциты, но в иммунном ответе участвуют и другие лейкоциты, например, макрофаги. Как уже отмечалось выше, и В-, и Т-клетки являются лимфоцитами. Они циркулируют в лимфе (в организме есть две циркулирующих жидкости - кровь и лимфа). В тканях плазма крови из капилляров поступает в тканевую (межклеточную) жидкость, которая омывает все клетки. Она отдает им принесенные с кровью питательные вещества и забирает продукты жизнедеятельности. Затем эта жидкость поступает в венозные и лимфатические капилляры, а из них в более крупные лимфатические сосуды (они в конечном итоге открываются в две центральные вены шеи). Лимфатические сосуды в определенных местах расширяются, образуя лимфатические узлы, в которых содержание В- и Т-клеток особенно высоко. Узлы расположены в подмышечной ямке, паховой области, миндалинах, аденоидах и кишечнике: находящиеся в них лимфоциты могут встретить любой чужеродный антиген, попавший в ткани, из которых вытекает лимфа. Поэтому можно сказать, что узлы постоянно «отслеживают» тканевую инфекцию, действуя в качестве фильтра, а также создают определенную среду для размножения и дифференцировки лимфоцитов при их контакте с антигенами. Лимфоциты образуются в костном мозге. Начало всем клеткам крови дают стволовые клетки; по мере дифференцировки некоторые из них становятся В-клетками, другие - Т-клетками, третьи - красными кровяными клетками и т. д. (рис. 25.1). Как уже отмечалось, В-клетки развиваются в костном мозге, а Т-клетки мигрируют в вилочковую железу (тимус), где происходит их размножение и первичное созревание. Миграция Т-клеток из костного мозга и высвобождение зрелых Т-клеток из тимуса происходит, главным образом, на ранних стадиях развития организма, так что удаление тимуса у взрослых почти не влияет на иммунные реакции. Образование В-клеток и их высвобождение из костного мозга у взрослых людей не прекращается.
Рис. 25.1. Этапы гемопоэза (упрощенно). Каждая стрелка указывает на возможное размножение клетки, которое специфически регулируется различными белками - цитокинами. К ним относятся колоний-стимулирующие факторы, интерлейкины и эритропоэтины. Последние стимулируют образование эритроцитов
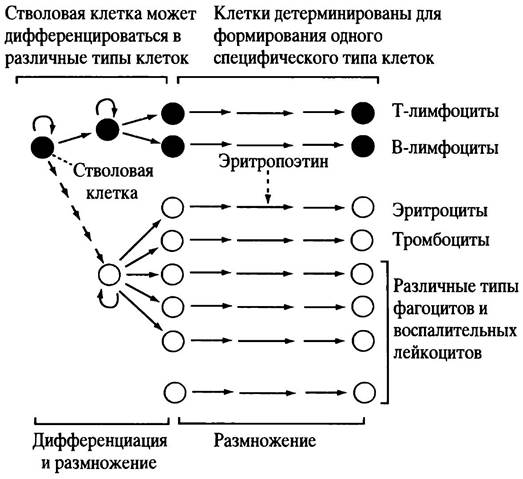
Костный мозг и тимус называют первичными лимфоидными органами, а лимфатические узлы - вторичными лимфоидными органами. Созревание лимфоцитов в первичных лимфоидных органах не зависит от антигена, а все последующие дифференцировки высвобожденных зрелых лимфоцитов во вторичной лимфоидной ткани - зависят.
В этой главе мы знакомимся с иммунным процессом; сначала вкратце рассмотрим стратегию иммунной защиты, используемую организмом.
Основная стратегия иммунной защиты
Иммунная система должна решить две задачи: 1) организацию продукции антител В-клетками в ответ на чужеродные антигены, но не на собственные компоненты организма; 2) обеспечение избирательной атаки цитотоксическими Т-клетками только аномальных клеток организма. Основной принцип иммунной защиты состоит в том, что данная В-клетка может образовывать только одно специфическое антитело (для связывания со своим антигеном) и данная Т-клетка отвечает только на один антиген. В организме образуется громадное количество различных антител. Им должно соответствовать эквивалентное число В-клеток, каждая из которых содержит ген, кодирующий антитело, образуемое этой клеткой. Возникает естественный вопрос: как может существовать такое большое число генов? Мы обсудим это позднее.
В организме также есть множество Т-клеток с различными рецепторами, каждый из которых специфичен в отношении своего антигена.
Незрелые В-клетки способны образовывать антитела, атакующие практически любые макромолекулы в организме. Для предупреждения аутоиммунных реакций любая клетка, продуцирующая антитело против компонентов собственного организма, должна удаляться в первую очередь. Сначала это происходит в процессе первичного созревания В-клеток в костном мозге; по мере созревания В-лимфоциты, по-видимому, адаптируются к большинству аутоантигенов, с которыми они когда- либо могут повстречаться. Предполагается существование и других механизмов подавления аутоиммунных реакций, но они пока неизвестны.
В организме незрелая В-клетка образует около 105 молекул своего антитела и выставляет их на поверхность (фиксированными в мембране); при этом В-лимфоцит не секретирует антитело, которое играет роль рецептора. В ходе первичного созревания В-клетки в костном мозге с антителом, фиксированным на ее поверхности, может взаимодействовать только антиген, являющийся составной частью организма. Иммунная система не должна реагировать на него, в противном случае на этой стадии развития В-клетки гибнут (или функционально элиминируются другим способом). После такого избирательного «умерщвления» выжившие клетки должны отвечать только на чужеродные антигены. Теперь они высвобождаются в кровоток.
Высвобожденная популяция виргильных В-клеток так их теперь называют - при встрече с соответствующими антигенами активируется, и теперь это вполне оправдано, поскольку встретившийся антиген - чужероден.
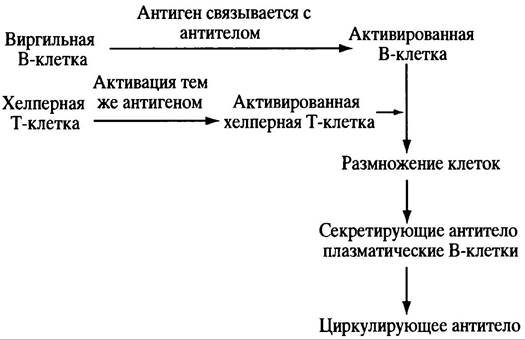
Активированная В-клетка не созревает в секретирующую антитело плазматическую клетку до тех пор, пока ей не встретится уже активированная при встрече с тем же антигеном зрелая Т-клетка. Т-клетки реагируют на специфический антиген при помощи своего рецептора; при созревании в тимусе они продуцируют антиген-специфический рецептор, реакция которого на компоненты собственного организма ведет к элиминации незрелых клеток. Отбор Т-клеток проиходит на ранних стадиях развития в ходе их созревания в тимусе, где они, подобно В-клеткам, встречают большую часть аутоантигенов. Выжившие в результате селекции Т-клетки высвобождаются в виде неактивных хелперных Т-клеток (или предшественников цитотоксичных Т-клеток, см. ниже), которые при встрече со специфическими антигенами активируются. Роль активированных хелперных Т-клеток заключается в доставке сигнала к специфически активированным В-клеткам - для размножения и созревания последних в секретирующую антитело плазматическую клетку (рис. 25.2). Все сказанное отражает основные принципы теории клональной селекции. Антиген осуществляет отбор соответствующих клеток для размножения. Из описанного выше механизма есть исключение: некоторые компоненты клеточной стенки грамотрицательных бактерий - липополисахариды - могут стимулировать образование антител соответствующими виргильными В-клетками и без сигнала хелперных Т-клеток. Контакта антигена этого типа с В-клеткой вполне достаточно для созревания последней в секретирующую антитело плазматическую клетку.
Рис. 25.2. Активация В-клеток для секреции антитела (основные этапы). Механизм активации антигеном хелперных Т-клеток несколько отличается от активации В-клеток тем же антигеном
Плазматическая клетка представляет конечный продукт дифференциации В-клетки. Она специализируется на синтезе и секреции антитела. Если вспомнить роль эндоплазматического ретикулума в секреции белка, то неудивительно, что у плазматических клеток эти органеллы очень хорошо развиты. (Регуляция деления В-клеток и хелперных Т-клеток будет описана позже.)
В тимусе некоторые из незрелых клеток развиваются в предшественника цитотоксических, или киллерных Т-клеток, которые играют важную роль в уничтожении зараженных вирусом клеток. При этом происходит аналогичный отбор: любая потенциально цитотоксическая клетка, рецептор которой реагирует на компонент собственного организма, инактивируется или элиминируется. Прошедшие селекцию клетки высвобождаются из тимуса в кровоток. При узнавании чужеродного антигена на поверхности зараженной клетки-хозяина они становятся функционально активными цитотоксическими клетками. Когда активированной цитотоксической Т-клетке встречается клетка, несущая чужеродный антиген, с ним взаимодействует ее рецептор. В результате Т-клетка выделяет перфорин - белок, убивающий клетку-мишень путем увеличения проницаемости ее мембраны или вызывающий апоптоз - программируемое саморазрушение клетки.
Механизмы иммунитета: В-клетки, хелперные Т-клетки и образование антител
Структура антител
Антитела являются иммуноглобулинами. Термин глобулин относится к ранней системе классификации: так обозначали белок, растворимый в солевом растворе. Иммуноглобулин обычно пишется сокращенно как Ig. Существует несколько классов иммуноглобулинов, одним из них является IgG, вырабатываемый клетками в больших количествах при длительном контакте с антигеном. Поэтому рассмотрим сначала именно его структуру. Молекула IgG имеет Y-образную форму. Она состоит из 4 полипептидных цепей: 2 одинаковых легких L (от англ. light) и 2 одинаковых тяжелых Н-цепей (от англ. heavy), соединенных дисульфидными связями (рис. 25.3). Концы лучей «Y» имеют вариабельные области как на тяжелых, так и на легких цепях. Именно эти фрагменты формируют антигенсвязывающий участок на каждом луче. Связывание с антигеном происходит за счет нековалентных связей. Таким образом, антитело имеет два идентичных антигенсвязывающих центра, следовательно, оно может образовать с молекулами антигена поперечную связь. У развилки «Y» находятся гибкие «шарнирные» области, способствующие формированию поперечных молекулярных связей. Аналогичная (но не идентичная) структура свойственна и другим иммуноглобулинам. Некоторые из них (например, IgM), представляют собой полимеры, состоящие из 5 субъединиц, каждая из которых очень похожа на молекулы IgG.
Рис. 25.3. Структура молекулы IgG. а - Молекула IgG. Молекулы IgM и IgA отличаются Fc-фраг- ментами, но схожи в вариабельной части. Н - тяжелая цепь; L - легкая цепь. N и С соответственно обозначают амино- и карбокси-концы полипептида. Фрагмент Fc - С-концевая часть Н-цепей, ковалентно соединенных в один домен S-S-связями, б - поперечная связь антигена с отдельными специфическими эпитопами; в - антигены с множественными антигенными детерминантами образуют с антителом поперечносшитый нерастворимый кластер
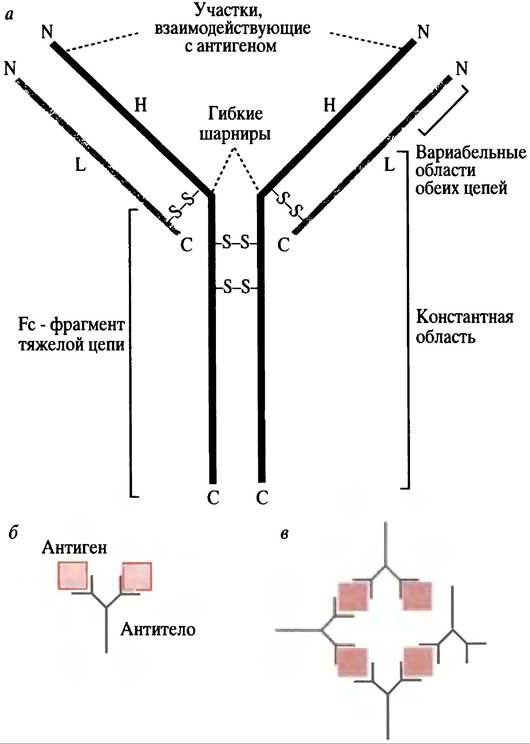
Несмотря на большие размеры антигена, вызывающего иммунный ответ, данное антитело связывается только с небольшой его частью (в случае белкового антигена - всего с несколькими аминокислотами). Специфическая часть антигена, узнаваемая антителом, называется эпитопом. Большой белковый антиген будет провоцировать образование ряда различных антител, каждое из которых связывается со специфическим эпитопом и вырабатывается отдельным клоном В-клеток.
Организм может контактировать с громадным числом различных антигенов и потенциально способен вырабатывать различные антитела, взаимодействующие с ними. Специфические антитела различаются по аминокислотной последовательности антигенсвязывающих участков. У антител, вырабатываемых различными клетками, и L-, и Н-цепи содержат вариабельные аминокислотные последовательности (V-домены), определяющие особенности структуры антигенсвязывающих участков и обусловливающие тем самым большое разнообразие антител. Как уже отмечалось, принцип организации иммунной системы заключается в произвольном образовании В-клеток, отличающихся генами, кодирующими антитела. При этом каждая вновь развившаяся В-клетка может вырабатывать антитела только одинаковой антигенной специфичности, молекулы которых на этой стадии зафиксированы в плазматической мембране, а взаимодействующие с антигеном участки располагаются снаружи. Образно говоря, клетка выставляет антитела на поверхность, словно товар на витрину магазина. Когда подойдет антиген, одно или несколько зафиксированных на мембране антител свяжутся с ним, инициируя активацию В-клетки.
Каковы функции антител?
Молекула антитела IgG бивалентна: она содержит 2 идентичных участка связывания, каждый из которых может связываться с одним и тем же эпитопом молекулы антигена. Если антиген имеет более двух идентичных эпитопов, одно антитело будет образовывать целую сеть в комплексе антиген-антитело. Большинство вырабатываемых у животных антител содержит множественные участки узнавания различных эпитопов данного антигена, так что взаимодействие антител с антигенами приведет к образованию целой сети молекул, которая активирует систему комплемента. Название последней указывает на то, что она «дополняет» (англ. complement) действие антител при лизисе бактериальной или других инвазивных клеток. Комплемент - название комплекса примерно из 20 белков крови. После взаимодействия антигена с антителом на бактериальной клетке происходит фиксация некоторых из этих компонентов. Белки комплемента окружают комплекс антиген-антитело, приводя к гибели бактериальной или другой клетки вследствие перфорации клеточной мембраны. Кроме того, комплекс покрытой антителом бактерии может поглощаться фагоцитирующими лейкоцитами (например, макрофагами и нейтрофилами), которые убивают и переваривают микроорганизмы. Фагоцитирующие клетки имеют на своей поверхности рецепторы (Fc-рецепторы). Некоторые из них связываются с константной Fc-областью антител (ствол «Y», см. рис. 25.3, а), которая выступает из комплекса антиген-антитело, в то время как другие (рецепторы комплемента) связывают прикрепившиеся компоненты комплемента. Эти события вызывают адгезию фагоцита и его мишени и запускают механизм поглощения частицы. Процесс активации комплемента сопровождается выделением биологически активных веществ, расширяющих кровеносные сосуды, что способствует поступлению фагоцитов к инфицированному участку.
Классы антител
Существует 5 основных классов иммуноглобулинов, отличающихся один от другого константными областями Н-цепей. Эти различия не имеют ничего общего с антигенсвязывающими участками, но ответственны за физиологическую функцию антитела.
Когда организм отвечает на антиген, первым из антител образуется IgM. Это мультисубъединичная форма антитела с 10 антигенсвязывающими участками, которая из-за наличия множественных участков связывания особенно эффективна при обезвреживании вирусов и бактерий. Этот иммуноглобулин участвует в активации комплемента и обеспечении фагоцитоза.
Повторные введения того же антигена приводят к массированному образованию IgG. Он также активирует комплемент и эффективно переносится к плоду через плаценту.
Иммуноглобулин A (IgA) практически незаменим на первой линии защиты. Он транспортируется через мембрану эпителиальных клеток (в сочетании с особым секреторным пептидом), в слизистый слой кишечника, дыхательной системы и т. д. и секретируется в молоко. IgA играет важную роль, например, в выработке иммунитета к холерному вибриону, который в ходе инфекционного процесса должен прикрепиться к эпителиальной выстилке кишечника в участках Пейеровских бляшек и других местах. Бактерии, покрытые специфическим IgA, не могут взаимодействовать с эпителиальными клетками кишечника и поэтому не участвуют в заражении.
IgA обладает свойствами, определяющими его роль в мембранах слизистых оболочек. Он не сразу разрушается протеолитическими ферментами кишечника и не может эффективно активировать комплемент.
Иммуноглобулин Е (IgE) участвует в выделении гистамина и способствует развитию симптомов аллергии в присутствии специфического антигена или аллергена. У людей с повышенной чувствительностью он может приводить к синтезу фактора активации тромбоцитов (англ. platelet activating factor, PAF). PAF имеет сходство с лецитином, только его центральная жирно-ацильная группа замещена ацетильной. Он способствует воспалению дыхательных путей и вызывает агрегацию тромбоцитов, снижение артериального давления и др. Функции IgD неизвестны.
Хотя каждая В-клетка может продуцировать только антитела одинаковой антигенной специфичности, она способна, сохраняя свою антигенную специфичность, переключаться с выработки одного класса антител на другой. Это переключение позволяет клону В-клетки увеличивать диапазон физиологических функций, осуществляемых ее антителами. Переключение выработки одного класса антител на другой происходит за счет рекомбинации ДНК.
Как достигается разнообразие антител?
Клетка человека содержит примерно 50 000-100 000 генов, кодирующих все белки организма. Для кодирования, скажем, миллиона антител требуется миллион различных генов. Ясно, что для синтеза такого громадного разнообразия антител необходимо предпринять нечто особенное.
Чтобы понять, как достигается такое разнообразие, подробно рассмотрим L-цепь. У нее есть два участка: концевая вариабельная область для связывания антигена и константная область, идентичная для всех молекул Ig. Процесс организации функционально активного гена, кодирующего L-цепь иммуноглобулина, включает соединение сегментов, кодирующих константную область, и одного из многочисленных сегментов, кодирующих вариабельные области (рис. 25.4).
Рис. 25.4. Процесс рекомбинации ДНК, ведущий к образованию функционального гена, кодирующего L-цепь иммуноглобулина. а - Расположение сегментов гена в стволовой клетке, где гены иммуноглобулина не экспрессируются; б - случайно выбранный V-ген (в этом примере V24) двигается к одному из J-генов (здесь J3), а находящийся между ними сегмент ДНК вырезается; в - транскрипция начинается в сегменте гена V24, транскрибируются также J-гены (J3 и J4); г - после сплайсинга РНК, удаляющего транскрипты J4 и нитронов, транскрипты, соответствующие V24,J3 и С, образуют мРНК. Благодаря аллельной эксклюзии только один из пары аллельных генов становится функциональным геном иммуноглобулина (см. текст), так что данная клетка продуцирует только один иммуноглобулин, а не два
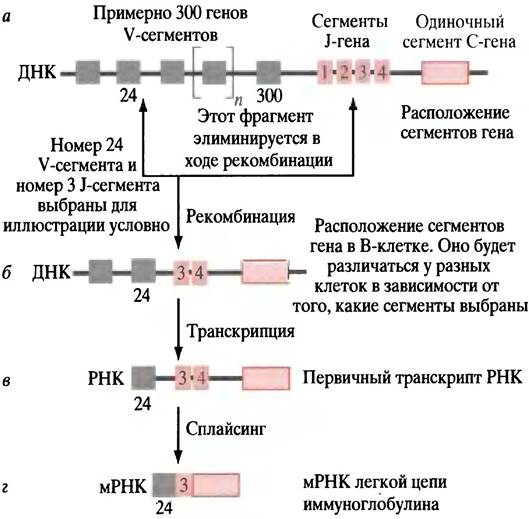
Рассмотрим стволовую клетку в костном мозге до того, как она дифференцировалась в В-клетку. ДНК, кодирующая L-цепь, состоит из нескольких участков. Есть сегмент, кодирующий константную (С) область; есть 4 отдельных сегмента, каждый из которых кодирует различные короткие пептидные последовательности. Они могут быть использованы для объединения константной и вариабельной областей. Эти последовательности называются J-участками (от англ. joining — соединение).
И наконец, есть около 300 сегментов (V), любой из которых кодирует альтернативные вариабельные концы L-цeпи. Все 300 V-сегментов отличаются друг от друга, так же как и 4J-сегмента. В каждом конкретном случае V-сегменты будут кодировать различные пептидные последовательности. Когда стволовая клетка костного мозга дифференцируется в В-лимфоцит, происходит реорганизация, вызванная рекомбинацией и эксцизией ДНК и приводящая к соединению одного из 300 V-сегментов к одному из сегментов J-участков. Это приводит к образованию нового сложного гена у каждого из В- лимфоцитов. Ген иммуноглобулина может содержать более одного сегмента J-участка, но в ходе сплайсинга первичного транскрипта РНК в мРНК остается только один J-сегмент (см. рис. 25.4). Рекомбинация ДНК - совершенно беспорядочный процесс. Таким образом, в конечной мРНК, кодирующей L-цепь молекулы IgG, любой из 300 V-сегментов соединяется с любым из 4 J-сегментов, что дает 1200 различных комбинаций. Рекомбинация неточна, потому что места разреза и повторного соединения немного различаются: это увеличивает число вариантов L-цепи примерно до 3000.
Ген Н-цепи организован аналогично, но в его образовании участвует гораздо большее число вариабельных сегментов, дающих еще больше вариантов гена Н-цепи. Формирование антигенсвязывающего участка при комбинации вариабельных частей Н- и L-цепей, существование большого числа генов, кодирующих эти цепи, а также многообразие различных участков связывания объясняют способность иммунной системы вырабатывать громадное число различных антител. Таким образом, каждая развивающаяся В-клетка собирает наугад гены, кодирующие одно антитело со своим специфическим антиген-связывающим участком.
Формирование генов, кодирующих иммуноглобулин в диплоидных клетках, приведет к тому, что каждая В-клетка будет продуцировать не один, а два специфичных антигенсвязывающих участка. Однако процесс аллельной эксклюзии сопровождается экспрессией генов легкой и тяжелой цепей иммуноглобулинов только на одной из гомологичных хромосом.
«Изобретательность» иммунной системы заключается и в том, что после активации В-клетки происходит быстрая мутация в области V, приводящая к увеличению многообразия антител. Многие из этих мутаций могут уменьшить сродство антитела к антигену, но некоторые будут его увеличивать. Антиген преимущественно связывается с клетками, вырабатывающими мембраносвязанные антитела с более высоким сродством к нему. Поскольку связывание антигена ведет к размножению клеток, организм может отобрать клетки, наиболее эффективно вырабатывающие антитела против определенного антигена. После контакта с антигеном начинается быстрый процесс «эволюции» - аффинное созревание, которое совершенствует эффективность антител, увеличивая их сродство к антигену.
Какова роль хелперных Т-клеток в активации В-клеток для секреции антител?
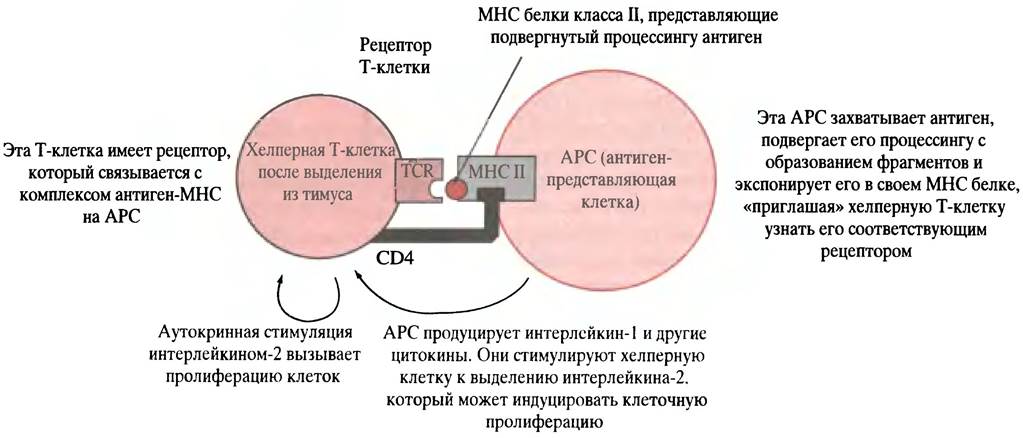
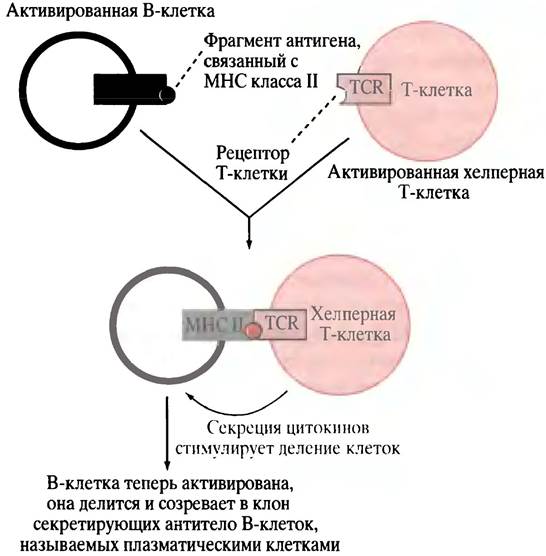
В-клетка, активированная в ходе связывания антигена с фиксированным на ее поверхности антителом, захватывает антиген и осуществляет его расщепление на мелкие фрагменты, которые взаимодействуют с пептидными рецепторами, называемыми МНС-белками. Затем фрагменты антигена транспортируются к клеточной поверхности и помещаются в участках связывания МНС-белков (рис. 25.5). Молекулы МНС являются гликопротеинами главного комплекса гистосовместимости (МНС - от англ. majorhistocompatibility complex). В данном случае молекулы МНС принадлежат к классу II (см. ниже) и экспрессируются теми клетками в иммунной системе, которые функционируют в качестве специализированных антиген-представляющих, включая В-клетки. Подвергнутые процессингу антигены, расположенные в комплексе с молекулами МНС на поверхности В-клеток, могут быть «узнаны» хелперными Т-клетками, имеющими рецепторы, специфические для комплекса МНС-антиген. Хелперные Т-клетки антител не образуют, однако они продуцируют антиген-специфические поверхностные рецепторы TCR (от англ. Т Cell Receptors), которые располагаются на Т-клетках. TCR узнает не фрагмент самого антигена на поверхности АРС, не молекулу МНС, а только комплекс молекулы МНС класса II с фрагментом антигена. Взаимодействию АРС и хелперной Т-клетки способствует ее белок CD4. Он связывается с константным белком клетки АРС, который является белком МНС класса II (рис. 25.6). Термин CD4 означает кластер дифференциации; он связан с методом, использованным для определения специфических маркеров дифференциации в клетке. Цифра «4» обозначает специфический участок, найденный экспериментальным путем. Белок CD4 - это рецептор, к которому прикрепляется вирус СПИДа. Когда хелперная Т-клетка, поступившая после созревания в кровоток, соединяется с соответствующим комплексом МНС-антиген, выставленным на циркулирующей АРС, происходит ее активация (см. рис. 25.6). Если активированной хелперной Т-клетке встретится В-клетка, экспонирующая тот же комплекс МНС-антиген (что был исходно представлен Т-клетке клеткой АРС), Т-клетка связывается с этой В-клеткой, выделяя цитокины. Последние стимулируют размножение В-клеток (рис. 25.7), и образовавшиеся плазматические клетки (секретирующие В-лимфоциты) «выплескивают» защитное антитело. В плазматических клетках хорошо развит эндоплазматический ретикулум, необходимый для секреции белка (см. с. 300).
Рис. 25.5. Процесс активации виргильной В-клетки до ее превращения в плазматическую клетку, продуцирующую антитела
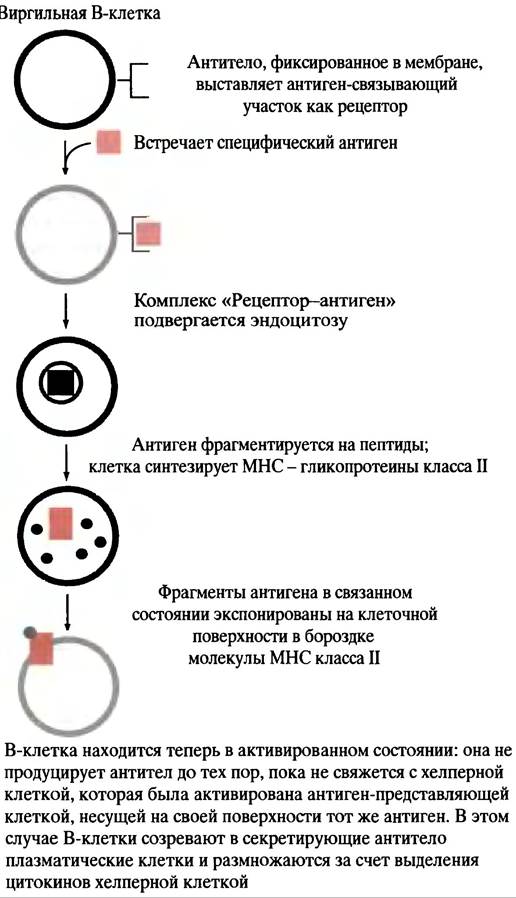
Рис. 25.6. Активация хелперной Т-клетки клеткой АРС (antigen-presenting cell). Аутокринная стимуляция хелперной Т-клетки позволяет клеткам размножаться после того, как произошло их разделение. CD4 - гликопротеин, расположенный на Т-клетке, он взаимодействует с белком МНС типа II клетки АРС. Это взаимодействие необходимо для связывания рецептора Т-клетки (TCR) с комплексом «АРС-МНС-антиген». Белок CD4 является рецептором, при помощи которого вирус СПИДа инфицирует хелперную Т-клетку
Почему в рассматриваемом случае антитело секретируется, а не остается зафиксированным в мембране? Ответ заключается в различном сплайсинге интронов мРНК генов иммуноглобулинов (см. с. 271). На 3'-конце гена иммуноглобулина есть сегмент, кодирующий полипептидную последовательность, которая закрепляет антитело в мембране. Начало секреции вызывается переключением в механизме сплайсинга, в ходе которого этот сегмент удаляется из мРНК.
Рис.25.7. Активация хелперной Т-клеткой превращения В-клетки в клон плазматических клеток, секретирующих антитело. Цитокины - факторы роста, стимулирующие клетки к делению. В ответ на активацию В-клетки, которая в результате становится плазматической клеткой, различный процессинг транскриптов РНК приводит к элиминации участка антитела, ответственного за заякоривание в мембране. Считается, что цитокины, в том числе секретируемые хелперной Т-клеткой, активируют цитотоксические клетки
Клетки памяти
При активации и пролиферации В-клеток не все клетки клона превращаются в секретирующие антитела плазматические клетки. Часть их становится длительно живущими клетками памяти, которые могут циркулировать в организме годами: они составляют основу долговременного иммунитета от повторной инфекции. Если потом произойдет контакт с соответствующим антигеном, иммунная система отреагирует очень быстро. Т-клетки также участвуют в формировании иммунологической памяти.
Т-клетки и клеточный иммунитет
Как уже было сказано, TCR-рецепторы на хелперных Т-клетках узнают антигены, ассоциированные с молекулами МНС класса II, которые присутствуют на АРС и В-клетках. Другая группа Т-клеток - цитотоксические, или киллерные клетки - имеет рецепторы, узнающие антигены на молекулах МНС класса I. Последние присутствуют на поверхности большинства клеток организма. Киллерные Т-клетки взаимодействуют только с клетками-хозяевами, выставляющими чужеродный антиген на своих молекулах МНС класса I. Хотя это утверждение в общем верно, результаты недавних исследований указывают на то, что в определенных случаях цитотоксические клетки могут узнавать белки МНС класса II. Мы не хотим запутывать читателей, однако важно представлять невероятную сложность иммунной системы, работа которой во многом остается непонятной.
На поверхности киллерной Т-клетки расположен гликопротеин CD8, который взаимодействует с константным белком МНС класса I. Поскольку связывание клеток происходит путем взаимодействия CD8-MHC, цитотоксические клетки атакуют только клетки, содержащие МНС класса I. Цитотоксические клетки узнают и убивают клетки организма, ставшие аномальными, например, при вирусной инфекции. В инфицированной вирусом клетке вирусный белок (синтезированный в клетке) подвергается расщеплению на пептиды, которые экспонируются на поверхности клетки в комплексе с молекулами МНС класса I (рис. 25.8). Антиген-специфичная киллерная Т-клетка связывается с комплексом антиген-МНС инфицированной клетки и разрушает ее, вызывая перфорацию мембраны (см. рис. 25.8) или инициируя апоптоз.
Рис. 25.8. Последовательность развития событий в клетке в ответ на появление чужеродного антигена. На рисунке не показано, что деление цитотоксической клетки стимулируется цитокинами, выделяемыми при взаимодействии хелперной Т-клетки и В-клетки. Это приводит к образованию клона цитотоксических клеток, специфичных в отношении определенного антигена; часть клеток клона цитотоксических клеток развивается в клетки памяти. Инфицированная клетка может быть убита посредством перфорации мембраны при освобождении белка перфорина или в результате апоптоза

Роль цитокинов в иммунной системе
В главе 26 мы обсудим, каким образом при помощи гормоноподобных сигнальных молекул осуществляется связь между клетками. Важным классом таких молекул являются факторы роста, к которым относятся белки, подающие клеткам сигнал к размножению. Когда хелперная Т-клетка активируется антиген-представляющей клеткой, она секретирует цитокины, в их числе и интерлейкины, стимулирующие размножение и созревание обоих типов клеток. Цитокины секретируются хелперными Т-клетками при контакте с В-клетками, и некоторые из них участвуют в активации киллерных Т-клеток. Одни цитокины стимулируют фагоциты, другие вызывают переключение класса антител у В-клеток, стимулируют деление клеток и созревание В-клеток в плазматические клетки. Иммуносупрессор циклоспорин, используемый при трансплантации органов, ингибирует образование интерлейкинов хелперными Т-клетками.
Почему иммунная система человека столь неистово отторгает чужеродные человеческие клетки?
На первый взгляд, есть что-то озадачивающее в самом факте существования механизма иммунной атаки на клетки, перенесенные от одного индивида к другому. Почему происходит отторжение трансплантанта ткани? Ведь эволюции не был известен такой перенос. Главной причиной отторжения чужеродного тканевого трансплантанта служат молекулы МНС на клетке. Эти молекулы составляют семейство гликопротеинов, где класс I и класс II - подсемейства, структурно различающиеся между собой. Кодирующие их гены кластеризованы в высоко полиморфный главный комплекс гистосовместимости. Для каждого гена, кодирующего МНС белок, в популяции существует много аллелей (вариантов). Поэтому маловероятно, что молекулы МНС разных индивидов будут одинаковыми. МНС-антигены - это те же молекулы, что и антиген-пептидные рецепторы класса I и II. Чужеродная молекула МНС распознается киллерной Т-клеткой как молекула МНС собственного организма, образовавшая комплекс с чужеродным антигеном; поэтому несущая его клетка будет атакована цитотоксическими Т-клетками. Напоминаем, что рецептор киллерной Т-клетки узнает комплекс молекулы МНС и антигена, а не каждый компонент в отдельности. Эволюция такой вариабельности молекул МНС в популяции могла бы выступать в качестве защиты видов в целом от гибели вследствие инфекции. Предположим, что случайно вирус развивается таким образом, что его подвергнутый процессингу антиген выставляется на молекуле МНС клетки-хозяина: в этом случае он распознается клеточной иммунной системой как нормальный - или не распознается совсем. Тогда вирус может размножаться и убить своего хозяина. Впрочем, вряд ли у следующего инфицированного индивида окажутся те же аллели МНС, поэтому вероятность повторения событий, описанных выше, уменьшается. Следовательно, несмотря на гибель отдельных индивидов, болезнь вряд ли распространится по всей популяции.
Вопросы к главе 25
1. Опишите структуру молекулы IgG.
2. Объясните, каким образом гены кодируют множество различных антител.
3. Какие вы знаете типы лимфоцитов и каковы их функции?
4. Что такое антиген-представляющая клетка?
5. Когда клетка-хозяин выставляет, например, вирусный антиген на своей поверхности, на каком классе МНС молекул он выставлен? Какой класс МНС молекул узнает цитотоксическая Т-клетка?
6. Что такое «теория клональной селекции»?
7. В чем заключается принцип уклонения от аутоиммунитета, или каким образом иммунная система становится устойчивой к аутоантигенам?
8. Образование антител после стимуляции В-клетки (для перехода в плазматическую клетку) хелперной Т-клеткой не изменяет антигенсвязывающего участка антитела. Но антитело должно секретироваться, а не оставаться в мембране. Каким образом это достигается?
9. Когда В-лимфоцит (плазматическая клетка) начинает секретировать антитело, последнее может обладать относительно низким сродством к своему антигену, но этот недостаток быстро устраняется. Каким образом?
10. Какие иммунные системы включают гликопротеин CD4, а какие - CD8? Какова их роль в иммунной реакции? Какое отношение имеет CD4 к вирусу СПИДа?