БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ГЛАВА 3. МОЛЕКУЛЯРНАЯ ОРГАНИЗАЦИЯ КЛЕТОЧНЫХ МЕМБРАН
В главе 1 мы вкратце рассмотрели роль трех типов слабых нековалентных связей, а также гидрофобных взаимодействий, возникающих при выталкивании молекулами воды неполярных молекул, мешающих водородному связыванию. Образование слабых связей уменьшает свободную энергию структуры, поэтому чем их больше, тем структура устойчивей. Это рассуждение можно рассматривать как введение к данной главе, посвященной структуре и функциям клеточной мембраны.
Нам еще предстоит познакомиться с клеточным метаболизмом. Вспомним, что прежде чем вещества пищи начнут усваиваться, они должны попасть в кровь, разнестись по организму и добраться до всех его тканей. И уже в начале своего пути им нужно пройти через мембраны клеток пищеварительного тракта. Одного этого достаточно, чтобы с биохимией мембран познакомиться раньше, чем с процессом усвоения пищи. Кроме того, компоненты клеточных мембран участвуют в транспорте жиров в организме, так что заодно мы получим некоторое представление и об этом.
Зачем клетке нужна мембрана?
Ответ очевиден: содержимое клетки должно быть отделено от окружающей среды. Мы пока не знаем, как возникла жизнь, хотя предложено несколько гипотез, пытающихся объяснить возможные механизмы этого процесса. Одно из необходимых условий возникновения жизни - наличие примитивной системы молекулярной ауторепликации. Такая система должна функционировать в небольшом замкнутом пространстве, иначе ее компоненты рассеются благодаря диффузии.
Это требование на первый взгляд кажется невыполнимым, потому что клеточная мембрана слишком сложна по своей структуре, чтобы примитивная система ауторепликации могла ее воспроизводить. Конечно, условия, при которых возникла жизнь на Земле, существенно отличаются от современных, однако есть вещества, которые спонтанно образуют замкнутые мембраноподобные структуры при простом встряхивании их с водой. Если бы при этом в воде присутствовали аутореплицирующиеся системы, то часть их оказалась бы включенной в крохотные пузырьки, или везикулы, ограниченные мембранами, которые очень похожи по своей
структуре на мембраны современных живых клеток. Иными словами, сборка первых мембран могла происходить спонтанно, без участия специализированных механизмов ауторепликации.
Что же это за вещества, обладающие столь необычными свойствами? Одно из них можно извлечь с помощью органических растворителей из яичного желтка. Такой экстракт содержит смесь полярных липидов. Полярные липиды (рис. 3.1) называются амфипатическими (т. е. обладающими двумя противоположными свойствами), поскольку их молекулы включают как полярные (полярная головка), так и неполярные гидрофобные (гидрофобный хвост) группы.
Рис. 3.1. Структурная организация амфипатических молекул, входящих в состав биологических мембран

Молекулы, которые могли бы сформировать примитивную мембрану в далеком прошлом, не обязательно были похожи на современные полярные липиды. Важно, что они обладали амфипатическими свойствами.
В присутствии воды такие молекулы образуют структуры, в которых полярные головки обращены к воде, а контакт гидрофобных хвостов с водой сводится к минимуму. Взаимодействие между гидрофобными хвостами до предела усиливается ван-дер-ваальсовыми взаимодействиями, что существенно уменьшает свободную энергию структуры и, следовательно, резко повышает ее стабильность.
После встряхивания полярных липидов в водной среде образуются липосомы - пузырьки, окруженные липидным бислоем. Последний образован двумя рядами полярных липидов, гидрофобные концы которых спрятаны внутрь, а гидрофильные головки обращены наружу, контактируя с водой и друг с другом, как показано на рис. 3.2, а.
Рис. 3.2. Строение липосомы и мицеллы: а - Поперечный разрез синтетической липосомы, образованной липидным бислоем; б - поперечный разрез плотной цилиндрической формы мицеллы. Для образования бислоя предпочтительнее участие липидов с двумя гидрофобными цепями, а для образования мицеллы - с одной
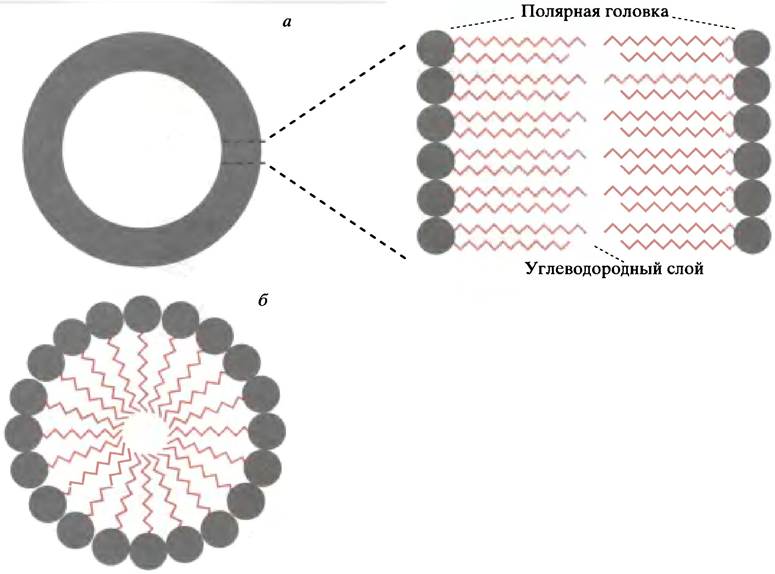
Если сделать срез липосомы и обработать его тяжелым металлом, который взаимодействует с полярными головками, в электронном микроскопе липидный бислой будет выглядеть как темные рельсы железнодорожных путей. Мембрана живой клетки после аналогичной процедуры имеет сходный вид, так как липидный бислой выступает в качестве ее основной структуры.
Другим возможным типом структур, образуемых амфипатическими молекулами в воде, является плотная цилиндрической формы мицелла (см. рис. 3.2, б). Однако двойные гидрофобные хвосты полярных липидов способствуют образованию бислойной, а не мицеллярной структуры.
Липидный бислой
Каковы липидные компоненты клеточных мембран?
Существует много полярных липидов, структуры которых, если их записать в виде формулы, будут сильно различаться. Однако схематически все они могут быть представлены так, как это показано на рис. 3.1: с полярной головкой и двумя гидрофобными хвостами. Рассмотрим сначала для сравнения структуру неполярных липидов.
Жиры - это неполярные липиды, которые можно рассматривать как производные жирных кислот. Свободные жирные кислоты никогда не встречаются в мембранах. Жирная кислота имеет структуру RСООН, где R - длинная углеводородная цепь. Среди жирных кислот наиболее часто встречаются гексадеканоевая (С16) и октадеканоевая (С18) кислоты, которые обычно называют соответственно пальмитиновой и стеариновой кислотой. Их также обозначают как 16:0 или 18:0, что указывает на число углеродных атомов и количество ненасыщенных двойных связей. Стеариновая кислота (С18) имеет структуру СН3(СН2)16СООН, или
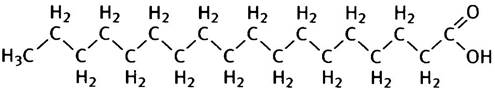
Для простоты углеводородную цепь жирных кислот изображают зигзагообразной линией, не всегда заботясь о том, чтобы число зигзагов отвечало числу углеродных атомов.
![]()
Соли жирных кислот называют мылами. Твердое мыло, которым мы моемся, представляет собой смесь натриевых солей длинноцепочечных жирных кислот.
![]()
В состав пищи человека жирные кислоты входят в виде жиров, которые составляют заметную долю нашей диеты. В основном это нейтральные жиры - производные трехатомного спирта глицерина, который этерифицирован жирными кислотами по всем трем своим гидроксильным группам. Такие сложные эфиры глицерина называют триацилглицеринами, или триглицеридами.
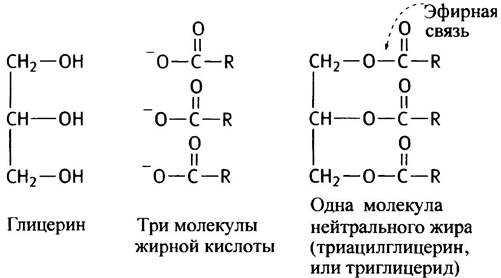
Если нейтральные жиры кипятить в водном растворе щелочи (NaОН или КОН), сложноэфирные связи гидролизуются и образуются глицерин и мыла. Люди научились варить мыло гораздо раньше, чем узнали, что такое сложные эфиры. Неудивительно, что термин омыление часто используют, имея в виду гидролиз любых сложных эфиров, а не только нейтральных жиров. Нейтральные жиры съедобны и не являются детергентами. Они не встречаются в биологических мембранах и не способны образовывать бислойные структуры в воде. Здесь мы рассматриваем их лишь для того, чтобы сравнить с полярными липидами.
Наиболее распространенными мембранными липидами являются производные глицерин-3-фосфата, называемые глицерофосфолипидами (или фосфоглицеридами).
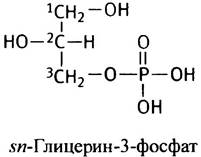
Центральный углеродный атом (С-2) в глицерин-3-фосфате асимметричен, поэтому он может находиться в двух изомерных формах. В природных фосфоглицеридах встречается только изомер, относящийся к L-ряду; для указания на это используется приставка sn. Две остальные гидроксильные группы замещены обычно остатками жирных кислот. Простейшим представителем фосфоглицеридов является фосфатидная кислота:
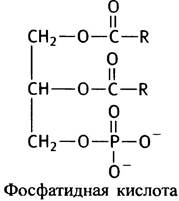
Стоит запомнить это название, чтобы потом легче было усвоить названия более сложных соединений. Дело в том, что в мембранах часто встречаются производные фосфатидной кислоты, в которых к фосфорильному остатку присоединены различные полярные радикалы. Если, например, речь идет о радикале X, то соответствующее соединение называется фосфатидил-Х:
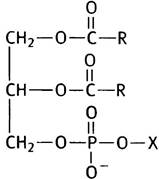
Чем более полярен радикал X, тем полярнее будет «головка» фосфолипидной молекулы. Распределение полярности в ней станет более наглядным, если изобразить молекулу иначе:
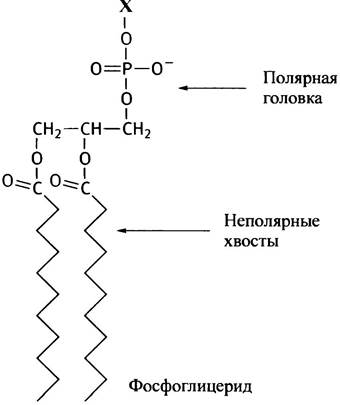
В таком виде в фосфоглицеридах можно узнать амфипатический мембранный липид, способный образовать бислои: он содержит полярную головку и два гидрофобных хвоста.
Какие полярные группы связаны в фосфолипидах с остатком фосфатидной кислоты?
Бислои могут быть образованы одним типом полярных липидов. Однако для строительства своих мембран живые клетки обычно используют разные липиды, подчас весьма сложные по структуре, но сходные по форме и амфипатичности молекулы. У фосфоглицеридов это проявляется в разнообразии полярных групп, связанных с фосфатидной кислотой.
В качестве такой группы может выступать остаток этаноламина НОСН2СН2NН3+, фосфатидильное производное которого называют фосфатидилэтаноламином или кефалином:
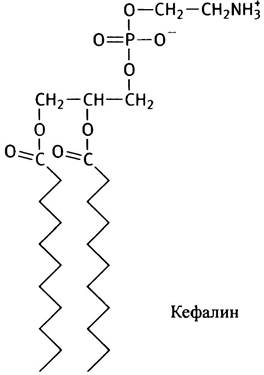
Трижды метилированный по азоту этаноламин НОСН2СН2N+(СН3)3 называют холином, а холинсодержащий фосфолипид - фосфатидилхолином, или лецитином.
Карбоксилированный этаноламин есть не что иное, как аминокислота серин НОСН2СНNН3+СОО-. Соответствующий фосфолипид, фрагмент структуры которого показан ниже, называют фосфатидил серином.
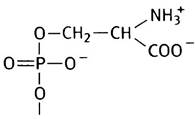
К другому типу полярных групп относится остаток шестиатомного спирта инозита, который присутствует в фосфатидилинозите (РI).
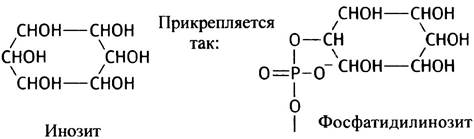
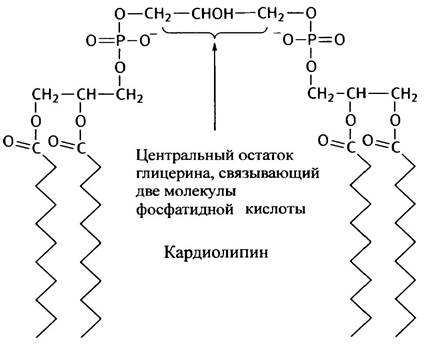
Особняком в этом ряду стоит дифосфатидилглицерин, или кардиолипин, который представляет собой глицерин, связанный с двумя остатками фосфатидной кислоты. Кардиолипин также обладает амфипатическими свойствами и присутствует во внутренней мембране митохондрий и в мембранах бактериальных клеток.
Все перечисленные полярные липиды являются производными глицерина. Однако эволюция с непостижимым мастерством создавала полярные липиды с иной структурой. Тем не менее их молекулы обладают сходной формой и свойствами. Речь идет о производных многоатомного аминоспирта сфингозина, который по своему строению довольно сильно отличается от глицерина:
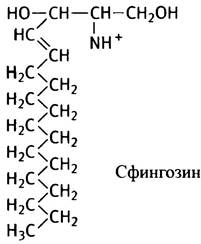
В отличие от глицерина, сфингозин содержит одну из двух требующихся углеводородных цепей (как правило, в ней 15 углеродных атомов). Вторая углеводородная
цепь в полярных липидах этого типа связана со сфингозином амидной связью, как это показано на примере церамида, молекула которого по форме близка к диацилглицерину.
Фосфорилхолиновым производным церамида является сфингомиелин - природный фосфолипид, главный компонент миелиновой оболочки нервных клеток.
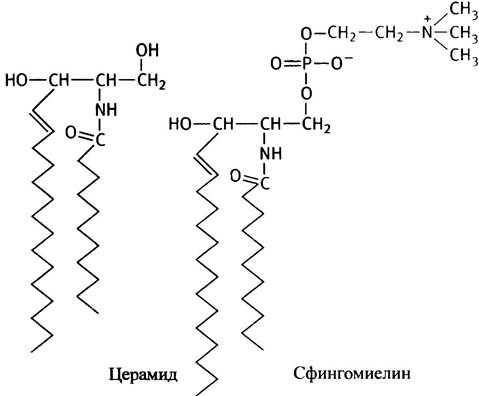
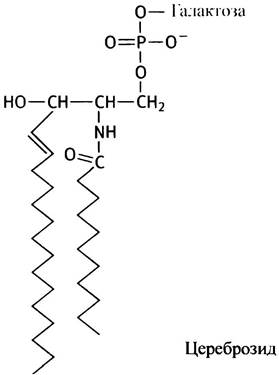
Эволюции свойственно, обнаружив удачное решение, применять его снова и снова. Например, церамид используется в различных полярных липидах в сочетании с различными полярными заместителями по свободной гидроксильной группе. В качестве таких заместителей обычно выступают сахара.
Моносахариды глюкоза и галактоза типичны для цереброзидов, которые присутствуют в мембранах мозговых клеток. Напомним, что галактоза является стереоизомером глюкозы по С-4-атому.
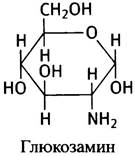
Известно много моносахаридов и их производных, в том числе аминосахаров. Структура одного из них - глюкозамина - изображена ниже:
Соединяя в разных комбинациях даже небольшой набор моносахаридов, природа получает много разных олигосахаридов (в них от 3 до 20 моносахаридных остатков, тогда как в полисахаридах - сотни или даже тысячи), в том числе с разветвленной структурой. Олигосахаридные производные церамида называются ганглиозидами. В этих липидах полярные головки особенно велики и разнообразны по строению.
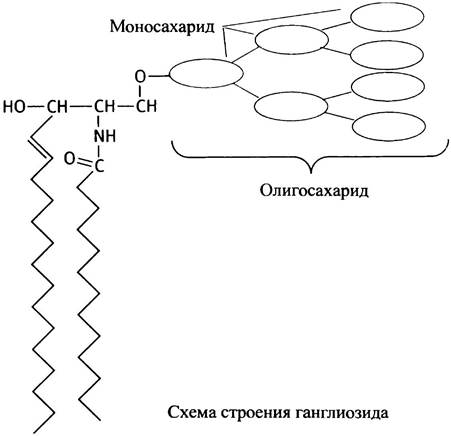
Трудно запомнить структуру сахаров, однако строение N-ацетил глюкозамина и сиаловой кислоты необходимо знать.
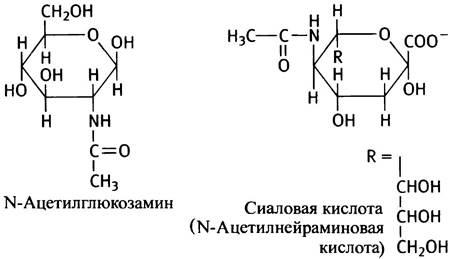
Оба эти соединения входят в состав углеводных компонентов ганглиозидов и мембранных гликопротеинов. Сиаловая кислота представляет особый интерес в связи с тем, что участвует в инфицировании клеток вирусом гриппа (см. с. 312). Ганглиозиды являются производными сфингозина, они определяют группу крови у людей (О, А, В). Углеводные части ганглиозидов обладают антигенными свойствами и различаются концевыми остатками в олигосахаридных цепях.
О номенклатуре мембранных липидов
Наряду с индивидуальными названиями полярных липидов, часто используют их собирательные (групповые) названия. Так, термины мембранные или полярные относятся к липидам, встречающимся во всех биологических мембранах. К фосфолипидам относят все фосфорсодержащие липиды. Среди них выделяют фосфоглицериды, в основе структуры которых лежит глицерин, и сфингомиелины - производные сфингозина. Производные церамида, лишенные фосфорильных групп и содержащие углеводные компоненты, называются гликолипидами, или гликосфинглипидами. Плазмалоген - глицерофосфолипид, в котором один из углеводородных радикалов связан с остатком глицерина не сложноэфирной, а простой эфирной связью. Еще один важный компонент мембран - холестерин, по своей структуре он не имеет ничего общего с полярными липидами.
Почему существует так много типов мембранных липидов?
Ответа на этот вопрос пока нет. Разные мембранные липиды определяют различные свойства поверхности мембран. Так, молекулы лецитина несут положительно заряженные полярные группы, молекулы фосфатидил- серина - отрицательно заряженные, а цереброзиды - нейтральные. У разных клеток состав мембранных липидов может существенно различаться. Мембраны клеток мозга, например, богаты цереброзидами и ганглиозидами, а мембраны миелиновых оболочек нервных клеток - гликосфинголипидами. Но липиды различаются по составу не только в мембранах разных типов клеток. Во всех изученных плазматических мембранах внешняя и внутренняя поверхности бислоя сильно различаются по липидному составу. Например, гликолипиды всегда расположены во внешнем слое, и их углеводная часть экспонирована в окружающую среду. Липидные молекулы практически не могут самопроизвольно перемещаться из одного слоя в другой (такой переход называют флип-флоп), так как при этом полярные головки должны пройти через гидрофобную центральную часть мембраны, а это термодинамически невыгодно. Известны ферменты, катализирующие этот процесс; вероятно, они участвуют в создании и поддержании асимметрии в биологических мембранах.
Напротив, липиды легко, свободно и быстро могут перемещаться в пределах монослоя {латеральная подвижность), так как практически не взаимодействуют друг с другом.
Один из мембранных липидов - фосфатидилинозит, служит переносчиком двух различных химических сигналов, регулирующих функции клетки (см. главу 26). Это, однако, особый случай. Пока нет разумных объяснений, почему мембраны содержат так много разных полярных липидов, чем обусловлено своеобразие липидного состава у разных клеток и для чего нужна асимметрия липидного состава внешнего и внутреннего монослоев. Некоторые мембранные липиды, особенно ганглиозиды, представляют интерес с медицинской точки зрения. Так, при детских заболеваниях, относящихся к группе гликосфинголипидозов (болезни Тея-Сакса и Гоше), нарушается обмен гликосфинголипидов, и накопление продуктов их частичного расщепления вызывает тяжелое поражение нервной системы.
Подводя итог, можно сказать, что клетки используют много разных полярных липидов, создавая свои мембраны, однако причины такой вариабельности пока не ясны.
Каков жирно-кислотный состав мембранных липидов?
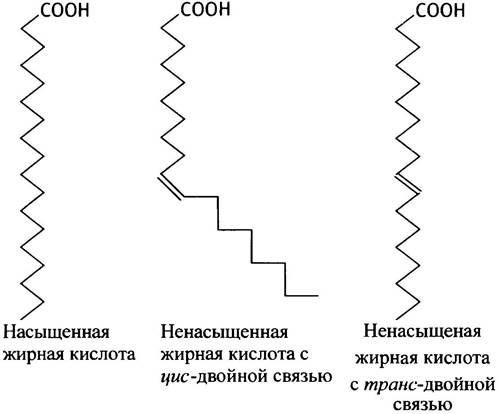
Остатки жирных кислот, образующих гидрофобный хвост мембранных липидов, разнообразны по структуре. Как правило, они имеют неразветвленную цепь и содержат четное число атомов углерода - от С14 до С24 (в основном - от С14 до С18). (Причины четности числа углеродных атомов обсуждаются в главе 9.) Два жирнокислотных остатка в одной молекуле фосфолипида могут быть одинаковыми или разными, причем в фосфоглицеридах гидроксил в первом положении обычно этерифицирован кислотой с насыщенной цепью, а во втором - с ненасыщенной. Степень ненасыщенности жирнокислотных хвостов играет важную роль, поскольку центральная гидрофобная область мембраны должна быть по своим свойствам близка к жидкости, а не к твердому телу. Чем выше ненасыщенность, тем ниже температура соответствующего фазового перехода у мембранных липидов.
Как правило, двойные связи в жирнокислотных хвостах имеют цис-конфигурацию, благодаря чему содержащие их хвосты (в отличие от насыщенных) имеют
не прямую, а изломанную форму. Такого рода изломы препятствуют плотной упаковке молекул.
Влияние степени ненасыщенности на фазовое состояние липида наглядно видно при сравнении бараньего жира с оливковым маслом. В обоих случаях мы имеем дело с триглицеридами, но в липидах оливкового масла много ненасыщенных жирно-кислотных хвостов. Однако в мембранах триглицериды отсутствуют, и правильнее сравнивать жирно-кислотный состав мембранных липидов теплолюбивых и холодоустойчивых организмов близких видов: у первых преобладают полностью насыщенные кислоты.
Важность поддержания «текучести» мембран иллюстрируется тем, что бактерии регулируют жирно-кислотный состав своих мембран таким образом, чтобы температура фазового перехода мембранных липидов была близка к температуре среды культивации. У теплокровных животных, впадающих в зимнюю спячку, степень насыщенности жирных кислот мембранных липидов также варьирует в зависимости от сезонных изменений температуры тела.
Наиболее распространены мононенасыщенные олеиновая (18:1) и пальмитолеиновая (16:1) кислоты, достаточно часто встречаются линолевая (18:2) и арахидоновая (20:4) кислоты с двумя и четырьмя двойными связями соответственно. О номенклатуре таких кислот подробнее будет сказано в главе 10.
Какую роль играет холестерин в мембранах?
При взгляде на структурную формулу холестерина (рис. 3.3, а), возникает вопрос: почему это вещество является компонентом биологических мембран? Однако все становится на свои места, если ознакомиться с конформацией его молекулы (рис. 3.3, б). Холестерин представляет собой вытянутую молекулу с жестким стероидным ядром и гибкой углеводородной цепью. Молекула холестерина амфипатична, поскольку на одном из ее концов находится полярная гидроксильная группа.
Рис. 3.3. Молекула холестерина: а - Плоскостное изображение; б - пространственное изображение
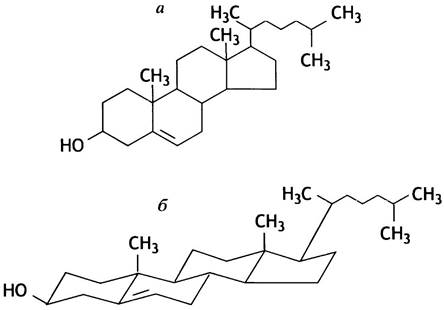
Встраиваясь между молекулами липидов (гидроксил располагается в зоне полярных головок), холестерин участвует в регуляции текучести мембраны, препятствуя плотной упаковке углеводородных цепей и тем самым снижая температуру плавления липидов. Внешне это проявляется в «расплывании» области фазового перехода в липидном бислое. Иными словами, в отсутствие холестерина этот переход происходит в более узком интервале температуры. Подобным образом на температуру плавления кристаллических веществ влияет присутствие в них примесей. Мембрана эритроцитов может содержать до 25% холестерина, в бактериальных мембранах его нет вообще, а в митохондриальных мембранах животных холестерина очень мало. В растительных клетках роль холестерина выполняют родственные ему соединения - фитостерины.
Слияние липидных бислоев
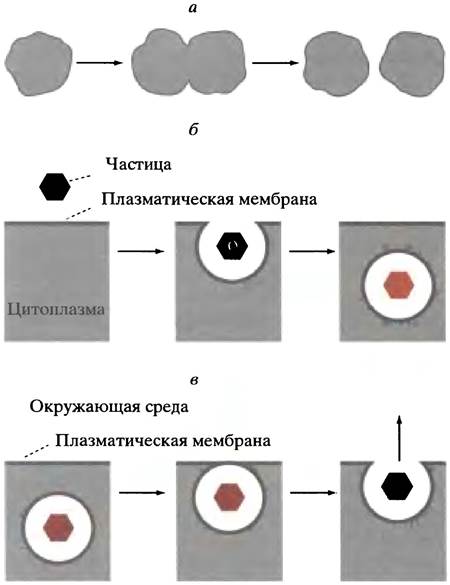
Липидный бислой в некотором роде подобен двумерной жидкости, в которой отдельные молекулы липидов свободно перемещаются в пределах своего монослоя. Липидные бислои обычно замыкаются сами на себя, устраняя свободные края. По этой причине они способны самопроизвольно восстанавливаться при повреждениях, смыкая края разорванных участков; при тесном контакте бислои сливаются. Такие свойства бислоев придают клеткам гибкость и способствуют ликвидации перетяжек, что особенно важно при клеточном делении (рис. 3.4, а).
Подобные процессы происходят при эндоцитозе - процессе поглощения клеткой частиц (или крупных молекул), которые не могут пройти через мембранный бислой. Поглощаемая частица постепенно окружается небольшим участком плазматической мембраны, который сначала впячивается, а затем отщепляется, образуя внутриклеточный пузырек, или вакуоль (рис. 3.4, б).
Возможно и обратное явление. Так, перенос секретируемых клеткой молекул белков осуществляется путем упаковки их в окруженные мембраной пузырьки, которые затем сливаются с плазматической мембраной, высвобождая содержимое в окружающую клетку среду (рис. 3.4, в).
Такой процесс называется экзоцитозом. Он имеет место, например, при секреции пищеварительных ферментов клетками поджелудочной железы.
Рис. 3.4. Деление клетки (а), эндоцитоз (б) и экзоцитоз (в). Экзоцитоз используется для секреции пищеварительных ферментов
Проницаемость липидных бислоев
Способность веществ диффундировать через липидный бислой в основном определяется его растворимостью в жирах. Жирорастворимые молекулы легко преодолевают бислой, а для большинства полярных молекул и ионов он почти непроницаем. Крупные незаряженные полярные молекулы типа глюкозы проникают через бислои хуже, чем более мелкие, такие как этанол и глицерин. Заряженные группы полярных молекул и неорганические ионы в водном растворе окружены сольватными оболочками из определенным образом ориентированных молекул воды. Для того чтобы пересечь гидрофобный слой мембраны, им нужно избавиться от этих оболочек, что энергетически крайне невыгодно. Поэтому проницаемость липидных бислоев для таких молекул и ионов ничтожно мала.
Большинство молекул, участвующих в биохимических процессах, достаточно полярны и потому не могут диффундировать через липидный бислой со скоростью, соизмеримой с потребностями клетки. Отсюда следует, что: во-первых, бислойная структура биологических мембран идеально удовлетворяет требованию оградить цитоплазму от окружающей среды; во-вторых, мембрана должна обладать механизмами, позволяющими клетке быстро и избирательно пропускать потоки молекул и ионов в соответствии с метаболическими потребностями.
Удивительно, что молекулы воды, хотя они и полярны, легко пересекают липидный бислой. Безусловно, сказываются малые размеры молекулы воды и отсутствие у нее заряда, но этого недостаточно; вероятно, здесь действуют какие-то дополнительные факторы. В мембранах клеток почечных канальцев и секреторных эпителиальных клеток, где транспорт воды особенно интенсивен, присутствует особый белок - аквапорин, который обеспечивает свободное движение воды через мембрану. Липидный бислой проницаем также для растворенных газов, в частности для кислорода.
Суммируя сказанное, отметим, что клетки должны быть окружены барьером, который препятствует утечке их компонентов, представленных главным образом полярными соединениями. Эта цель достигается благодаря использованию липидного бислоя - структуры, образование и стабильность которой определяются слабыми взаимодействиями между различными амфипатическими полярными липидами.
Монослои, составляющие бислойную мембрану, отличаются липидным составом. Это различие появляется в ходе сборки мембраны и сохраняется вследствие энергетической нецелесообразности обмена липидами между монослоями. Латеральное движение липидов (в пределах каждого из монослоев) происходит вполне свободно. Разные типы клеток различаются липидным составом своих мембран. Непонятно, зачем природе понадобился такой обширный набор липидов для биомембран, тем более что только один из них - фосфатидилинозит имеет специфическое предназначение, выступая в качестве химического сигнала. Углеводородный слой мембран находится в «жидком» состоянии. В животных клетках это достигается поддержанием баланса между насыщенными и ненасыщенными остатками жирных кислот. Последние снижают температуру фазового перехода в бислоях: их изломанные цис-двойной связью цепи препятствуют плотной упаковке липидных молекул. Для регуляции температуры фазового перехода используется холестерин. В бактериальных мембранах тот же эффект достигается с помощью жирных кислот с разветвленными цепями. Липидный бислой практически непроницаем для сильно полярных молекул, однако через него относительно легко диффундируют небольшие слабополярные молекулы. Эти свойства позволяют бислою осуществлять свою главную функцию - служить барьером, препятствующим утечке компонентов цитоплазмы. Способность бислоев к слиянию обеспечивает возможность протекания таких процессов, как клеточное деление, эндоцитоз и экзоцитоз.
Липидный бислой является конструкционной основой биологических мембран, однако сам по себе не способен осуществить все выполняемые ими функции, в том числе избирательный трансмембранный перенос молекул. За это ответственны мембранные белки.
Мембранные белки и структура биологических мембран
Благодаря своей удивительной структуре биологическая мембрана обладает разнообразными свойствами. Разные клетки выполняют различные функции, и каждая из этих функций может быть реализована с помощью специализированного мембранного белка, который синтезируется для выполнения определенной задачи, а затем попадает в мембрану (о том, как это происходит, см. главу 22). При этом необходимо, чтобы белок мог встроиться в эту мембрану. Экспериментально доказано, что функциональные белки, выделенные из биомембран, способны встраиваться в искусственные липидные мембраны (липосомы) и осуществлять там те же функции, что и в исходной мембране.
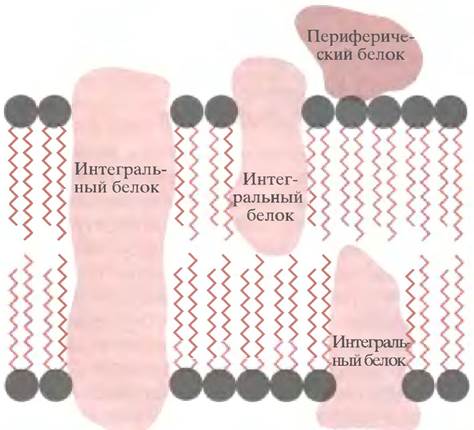
Структуру биомембран часто называют жидкомозаичной (рис. 3.5). Ее уподобляют двумерному морю липидов, в котором плавают «айсберги» - интегральные
белки, частично погруженные в мембрану или пронизывающие ее насквозь. Кроме того, выделяют так называемые периферические белки, молекулы которых не встроены в мембрану, а удерживаются на ее поверхности за счет слабых взаимодействий.
Рис. 3.5. Жидкомозаичная модель строения биологических мембран
Что удерживает интегральные белки в липидном бислое?
Интегральные мембранные белки удерживаются в липидном бислое благодаря особенностям своей структуры, которые обеспечивают возможность слабых взаимодействий между ними и липидным окружением.
Как известно, белки представляют собой полипептиды, состоящие из ковалентно связанных аминокислот. Если все аминокислотные остатки в полипептиде содержат гидрофобные боковые цепи, то полипептид в целом будет гидрофобен и т. д. У интегральных мембранных белков концевые участки полипептидной цепи состоят из остатков гидрофильных аминокислот, а центральная часть цепи - из гидрофобных (рис. 3.6, а).
На рис. 3.6, б схематически показано строение гликофорина - главного белкового компонента мембраны эритроцитов. На внешней стороне мембраны расположен N-концевой участок этого белка, богатый гидрофильными аминокислотами. Гидрофильность этого фрагмента усиливается благодаря наличию большого числа остатков серина, треонина и аспарагина, ковалентно связанных с углеводными радикалами. С-кон- цевой участок полипептидной цепи, расположенный с внутренней стороны мембраны, также богат гидрофильными аминокислотами, но не содержит углеводных компонентов (углеводные остатки всегда расположены на поверхности клетки). Оба гидрофильных фрагмента молекулы гликофорина разделены участком полипептидной цепи, расположенным внутри мембраны и обладающим гидрофобными свойствами (участок не содержит ни одной сильно гидрофильной аминокислоты). Он состоит из 19 аминокислотных остатков, свернутых в α-спираль.
Размеры центрального гидрофобного участка молекулы гликофорина соответствуют толщине гидрофобной зоны липидного бислоя, а внешние гидрофильные участки локализованы на противоположных сторонах мембраны и способны взаимодействовать как с водой, так и с полярными головками мембранных липидов (см. рис. 3.6, б). Белки, в молекулах которых четко выделяются гидрофильные и гидрофобные участки, называют амфипатическими.
Рис. 3.6. Структурная организация интегральных белков (а), и строение молекулы гликофорина (б). Спиральный участок гликофорина, включающий 19 аминокислотных остатков, имеет длину около 3 нм, что соответствует толщине гидрофобной части липидного бислоя

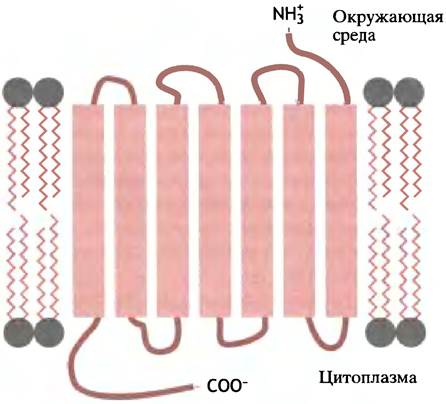
В некоторых мембранных белках полипептидная цепь многократно изгибается таким образом, что пересекает мембрану не один, а несколько раз (рис. 3.7). Соответственно, гидрофильные участки в них перемежаются с гидрофобными; последние спирализованы и состоят из 15 -20 аминокислотных остатков. Среди таких белков наиболее изучен бактериородопсин - пигмент пурпурных бактерий Halobacterium halobium. Он улавливает световую энергию и использует ее для перекачивания протонов из бактериальной клетки в окружающую среду, создавая протонный градиент, энергия которого затем используется клеткой для синтеза АТР (этот механизм описан в главе 7).
Рис. 3.7. Топография полипептидной цепи бактериородопсина в мембране. Семь плотно упакованых α-спиральных участков пронизывают липидный бислой
Расположение мембранных белков отвечает максимально эффективному их взаимодействию с липидным бислоем. При любой попытке белка покинуть мембрану его гидрофобные участки войдут в соприкосновение с водой, а гидрофильные - с углеводородным слоем мембраны. И то, и другое энергетически невыгодно, так что трансмембранные перемещения интегральных белков исключены. Иное дело их латеральная диффузия в пределах монослоя. Механизмы попадания белков в биомембраны и их начальная ориентация будут обсуждаться в главе 22.
Заякоривание периферических белков в мембране
Периферические водорастворимые мембранные белки могут удерживаться на поверхности мембраны за счет водородных связей и ионных взаимодействий.
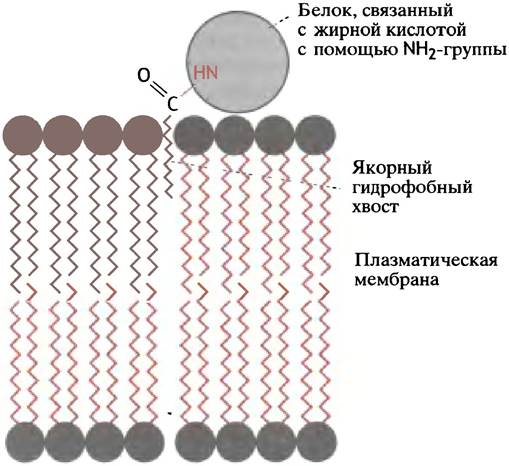
Однако существуют и другие способы. Так, белок может содержать ковалентно связанный остаток длинноцепочечной жирной кислоты, который внедряется в липидный бислой и служит своего рода якорем (рис. 3.8). В одних белках N-концевые остатки глицина связаны с жирной миристиновой кислотой:
Р-СO-NН-СН2-СO- полипептид,
в других - жирные кислоты С14, С16 и С18 этерифицируют гидроксильные группы остатков серина и треонина или тиольную группу цистеина. Используются кислоты и более сложного строения, остатки которых прикреплены к белку простыми эфирными связями. Примером более усовершенствованного способа заякоривания периферических белков в мембране является ковалентное связывание фосфатидилинозита с олигосахаридной частью мембранного гликопротеина. Такой остаток фосфатидилинозита включается в мембрану и ведет себя там как свободная липидная молекула.
Рис. 3.8. Якорный остаток жирной кислоты, прикрепленный амидной связью к молекуле белка. Иногда остатки жирных кислот прикреплены к белкам сложноэфирной или тиоэфирной связями
Мембранные гликопротеины
Многие мембранные гликопротеины так же, как и гликолипиды - цереброзиды и ганглиозиды, содержат разветвленные олигосахариды с внешней стороны мембраны. Эти олигосахариды, ковалентно связанные с боковыми цепями остатков серина или аспарагина, состоят из фукозы, маннозы, галактозы, N-ацетилгалактозамина,
N-ацетилглюкозамина и сиаловой кислоты. В гликопротеине эритроцитарной мембраны - гликофорине углеводная часть составляет по массе половину молекулы. Точно неизвестно, зачем нужны эти олигосахариды, хотя в некоторых случаях они, по-видимому, играют роль маркеров при распознавании клеточной поверхности.
Итак, разнообразие мембранных белков определяется множественностью функций биологических мембран. Интегральные белки погружены в мембраны, тогда как периферические удерживаются на поверхности благодаря нековалентным взаимодействиям с полярными группами липидов. Интегральные белки амфипатичны: в их структуре четко различаются центральная гидрофобная область, соприкасающаяся с углеводородным слоем липидной мембраны, и гидрофильные фрагменты на С- и N-концевых участках цепи, экспонированные в водное окружение по разные стороны мембраны. Мембранные белки часто гликозилированы, т. е. содержат ковалентно связанные остатки сахаров, причем эти сахара всегда находятся на внешней стороне клеточной мембраны. В принципе в липидную мембрану может быть встроено большое число типов белков. Это придает ей функциональную гибкость.
Функции мембран
Мембраны выполняют множество разнообразных функций. Мы ограничимся рассмотрением функций плазматической мембраны, окружающей клетку, а о внутриклеточных мембранах поговорим в следующих главах. Кроме основной задачи - сохранить содержимое клетки, плазматические мембраны выполняют и множество других. В этом разделе будет рассмотрено их участие в транспорте веществ в клетку и из клетки, передаче сигналов, поддержании формы клеток, а также в межклеточных взаимодействиях.
Транспорт веществ в клетку и из клетки
Уже говорилось о том, что если не большинство, то многие из веществ, которые клетка должна получать из окружающей среды, не способны проникать через плазматическую мембрану со скоростью, соизмеримой с ее метаболическими потребностями. (Заметим, что есть внутриклеточные мембраны, например, внешние мембраны митохондрий и хлоропластов, у которых поры так велики, что через них свободно проходят любые молекулы с массой менее 600 Да.) Поэтому для переноса через мембрану полярных структур - сахаров, аминокислот, неорганических ионов и т. п. - требуются специально предназначенные для этой цели белки. Только они могут обеспечить должную избирательность и управление клеточными процессами извне. Требование избирательности объясняет необходимость существования множества специализированных транспортных систем и, следовательно, транспортных белков.
Пассивный транспорт, или облегченная диффузия
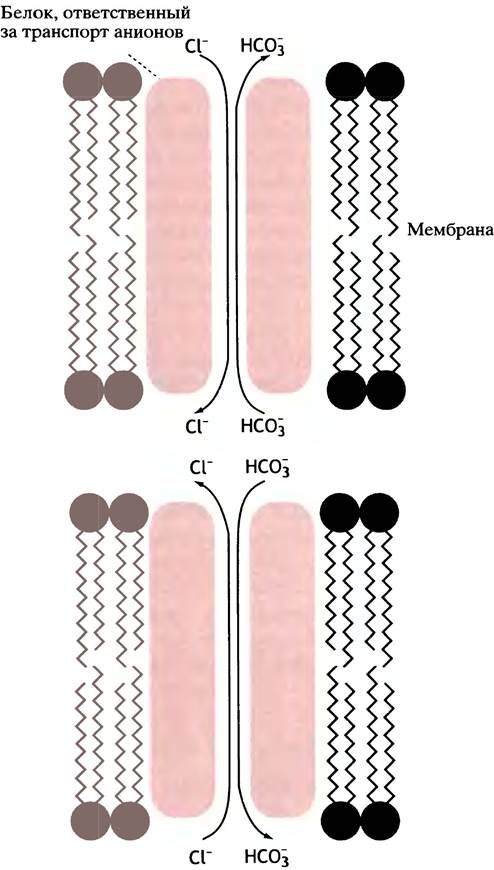
Транспортные системы подразделяют на пассивные и активные. Первые осуществляют перенос веществ через мембрану, не требуя притока энергии извне, поскольку он совершается за счет концентрационного градиента. Именно поэтому пассивный транспорт называют также облегченной диффузией. Хорошим примером здесь может служить белок, обеспечивающий двунаправленное движение анионов (Сl- и НСО-3) через эритроцитарную мембрану (рис. 3.9). Физиологическое значение этого процесса обсуждается в главе 27. Другим примером облегченной диффузии может служить перенос глюкозы через мембраны животных клеток - необходимый и важный этап усвоения этого вещества, разносимого кровью.
Рис. 3.9. Анионный канал в мембране эритроцита. Ионы Сl- и НСО3- могут двигаться через канал в обоих, но противоположных направлениях в соответствии с концентрационными градиентами. Противоток этих анионов обеспечивает сохранение электронейтральности
Важными элементами в системе пассивного транспорта являются регулируемые поры, обычно именуемые каналами. К их числу относятся структуры, обеспечивающие трансмембранные ионные потоки, пропускная способность которых зависит от внешнего сигнала. Одни каналы открываются в ответ на деполяризацию (см. главу 26), другие - под действием определенных химических веществ, в частности ацетилхолина. Структурные элементы каналов, непосредственно отвечающие за их пропускную способность, называют воротами, а структурные элементы, распознающие сигнальную молекулу (химический сигнал), - рецепторами. Каналы имеют важное физиологическое значение для ионов Са2+, Na+ и К+.
Активный транспорт
Этот вид трансмембранного переноса веществ совершается за счет внешнего источника энергии. Во всех клетках (кроме бактериальных) таким источником служит гидролиз АТР. При активном транспорте перемещение вещества происходит против его концентрационного градиента. Чтобы определить количество энергии, необходимой для перемещения вещества в клетку против концентрационного градиента, можно использовать уравнение, приведенное в главе 1 для описания химических реакций:
![]()
Для веществ, чья структура при переносе не изменяется (∆G°′ = 0), это уравнение упрощается:
![]()
где С1 - концентрация вещества вне клетки; С2 - концентрация вещества внутри клетки. Если С2/С1 = 10, а Т= 298 К, то:
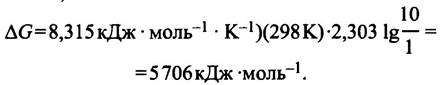
Итак, в принятых условиях перенос одного моля вещества требует 5706 Дж (при 25° С). Неудивительно, что нервные клетки, мембранный потенциал которых в значительной мере определяется градиентом концентрации ионов калия и натрия, расходуют на его поддержание большую часть производимого в них АТР.
Примером системы активного транспорта может служить так называемый Na+/K+-Hacoc в клеточных мембранах животных клеток. В этих клетках поддерживается высокая концентрация ионов калия (140 мМ) и низкая - ионов натрия (12 мМ), тогда как в крови и межклеточной жидкости соотношение этих концентраций обратное: соответственно 4 и 145 мМ. Ионная проницаемость плазматических мембран клеток такова, что концентрационным градиентам калия и натрия соответствует разность электрических потенциалов 50-70 мВ (положительный - снаружи мембраны, отрицательный - внутри). За это приходится платить: на поддержание ионных градиентов животные тратят около трети, расходуемой ими энергии. Но тратится она не впустую. Эти градиенты необходимы для генерации и проведения электрических сигналов в возбудимых мембранах, а кроме того, запасенная в виде градиентов энергия расходуется на транспорт веществ через мембрану.
Устройство Na+/K+-Hacoca
Этот насос иначе называют Na+/K+-АТРазой, поскольку выкачивание из клетки натрия и закачивание в нее калия сопряжено с гидролизом АТР до ADP + Рi.
Na+/K+-ATPaзa представляет собой белок, состоящий из двух пар субъединиц (αα и ββ). Некоторые белки способны изменять свою форму при связывании специфических лигандов (лигандами называют соединения, которые связываются с другими соединениями в строго определенных местах). Эти изменения происходят в результате конформационных превращений в отдельной белковой молекуле или вследствие упаковки субъединиц в белковые комплексы (например, в гемоглобине). В Nа+/К+-АТРазе такие изменения могут быть вызваны фосфорилированием белка, в ходе которого может измениться его сродство к ионам натрия и калия.
Согласно модели, представленной на рис. 3.10, Na+/K+ -АТРаза может существовать в двух конформациях. Связывание Na+ и последующее фосфорилирование АТРазы со стороны цитоплазмы (см. рис. 3.10, а) приводят к конформационным изменениям в белке, в результате которых Na+проходит через мембрану и высвобождается в межклеточное пространство. Одновременно с этим происходит связывание К+ на внешней поверхности мембраны (см. рис. 3.10,6), а последующее дефосфорилирование возвращает белок в первоначальное состояние; при этом К+, пройдя через мембрану, поступает в цитоплазму (см. рис. 3.10, в). Таким образом, фосфорилирование фермента приводит к выбросу иона натрия из клетки и к связыванию им иона калия из окружающей среды. Если при дефосфорилировании фермент возвращается в первоначальную форму, то процесс становится циклическим и выражается в гидролизе АТР, сопряженном с трансмембранным противотоком ионов натрия и калия. Действительно, один цикл Nа+/К+-АТРазы сопровождается встречным переносом трех ионов натрия и двух ионов калия. Все происходящее при этом можно описать уравнением:
3Na+(внутри) + 2К+(снаружи) + АТР + Н2O —> 3Na+(снаружи) + 2К+(внутри) + ADP + Рi + Н+.
Здесь интересен медицинский аспект. Существует группа соединений, называемых сердечными гликозидами, которые представляют собой углеводные производные стероидов (по структуре сходные с холестерином). Они содержатся в наперстянке и близких к ней видах растений.
Эти соединения ингибируют Na+/K+-ATPaзy, препятствуя удалению фосфорильного остатка, и тем самым останавливают транспорт ионов на стадии б (см. рис. 3.10). В малых дозах они уже давно используются в медицине при лечении сердечной недостаточности, а в больших дозах - смертельно опасны. Терапевтический эффект сердечных гликозидов обусловлен тем, что они, ингибируя Na+/K+-ATPaзy, увеличивают концентрацию ионов натрия в клетках сердечной мышцы, вследствие чего уменьшается натриевый градиент. Это приводит к увеличению содержания в цитоплазме ионов Са2+, поскольку существует другая система, которая обеспечивает транспорт Na+ внутрь клетки, а Са2+наружу, т. е. выход Са2+ из мышечных клеток происходит путем его обмена на натрий и зависит от натриевого градиента. Вызванное сердечными гликозидами снижение градиента Na+ способствует снижению выхода Са2+ наружу и увеличению его внутриклеточного уровня. Это в итоге стимулирует сокращение сердечной мышцы. Сходным эффектом обладает уабаин - вещество растительного происхождения, которым африканцы отравляли наконечники своих стрел.
Рис. 3.10. Гипотетический механизм работы Na+/K+-нacoca: а-в - Последовательные состояния Nа+/К+-АТРазы
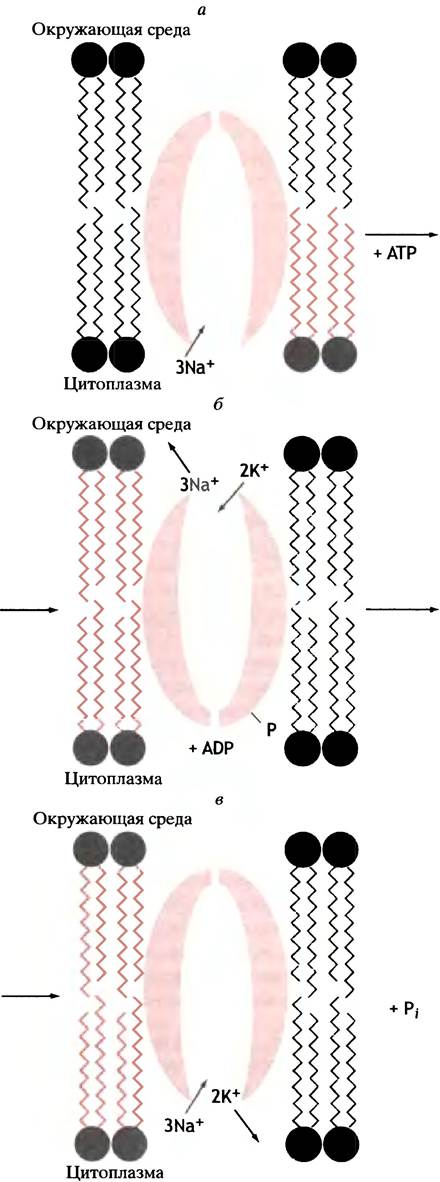
Совместный перенос молекул через мембраны (симпорт)
Трансмембранный Na+-градиент, создаваемый Nа+/К+-АТРазой, есть не что иное, как форма запасания энергии. Эта потенциальная энергия рассеется в виде тепла, если ионам натрия дать возможность просто так вернуться в клетку. Представим, однако, что они это сделают вместе с другими молекулами. Такой совместный перенос называется симпортом. Существует, например, белок, ответственный за симпорт ионов натрия и глюкозы, при котором переносятся их строго эквимолярные количества. В результате глюкоза может двигаться внутрь клетки против собственного концентрационного градиента за счет градиента ионов натрия. А поскольку последний возникает за счет гидролиза АТР, то АТР косвенно является движущей силой транспорта глюкозы. Подобный механизм функционирует при всасывании аминокислот и глюкозы в кишечнике (рис. 3.11), причем в переносе разных веществ участвуют разные транспортные белки.
Рис. 3.11. Симпорт - система совместного транспорта глюкозы и ионов натрия
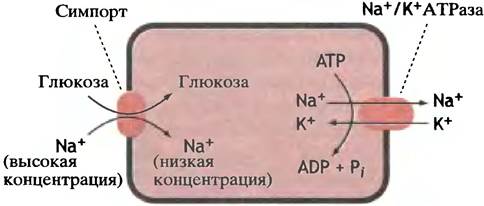
Антипорт
В связи с действием сердечных гликозидов мы уже упоминали о том, что вход ионов натрия в клетки сердечной мышцы сопряжен с выкачиванием наружу ионов кальция. Такой жестко связанный противоток называют антипортом (рис. 3.12). И в этом случае кальций может транспортироваться против собственного концентрационного градиента за счет энергии натриевого градиента, который, в свою очередь, возникает благодаря гидролизу АТР. Когда мы подойдем к рассмотрению мышечного сокращения, вы увидите, что встречаются и Са2+-насосы (Са2+-АТРазы), которые непосредственно используют гидролиз АТР как источник энергии для трансмембранного переноса ионов кальция.
Рис. 3.12. Антипорт - система жестко связанного противотока ионов натрия и кальция
Унипорт
Термином унипорт обозначают перенос любых растворенных веществ или ионов с одной стороны мембраны на другую с участием специализированных транспортных белков, например, Са2+-АТРазы из саркоплазматического ретикулума.
Итак, большинство веществ переносится через плазматическую мембрану с помощью специфического для каждого вещества транспортного белка, что позволяет понять, почему таких белков очень много. Транспорт называют пассивным, когда его движущей силой является только градиент концентрации (перенос анионов в эритроцитах или глюкозы в животных клетках). Однако так бывает не всегда, и вещества могут двигаться через мембрану против собственного градиента. Животные клетки обладают Na+/К+-АТРазой, которая создает на плазматической мембране встречные градиенты концентраций ионов калия и натрия. Ингибирование этого фермента сердечными гликозидами используется в медицине при лечении сердечной недостаточности. Натриевый градиент, возникающий на плазматической мембране, может использоваться как источник энергии для переноса других молекул (симпорт натрия и аминокислот или глюкозы в кишечнике) или выведения их в окружающую среду (антипорт ионов натрия и кальция). И при симпорте, и при антипорте с участием ионов натрия источником энергии для создания всех градиентов является гидролиз АТР. Наряду с Na+/К+-АТРазой существуют и другие транспортные АТРазы.
Преобразование сигналов
Все клетки животного должны работать согласованно, в соответствии с нуждами целого организма, о которых они узнают из посылаемых им сигналов. Жизнь - это химический процесс, и потому неудивительно, что сигналы посылаются в виде химических соединений, будь то гормоны, продуцируемые железами, или нейромедиаторы, выделяемые нервными окончаниями.
Среди сигнальных соединений есть неполярные вещества, такие как стероидные гормоны, которые проникают в клетки, диффундируя через липидный бислой, и полярные, которые в клетку проникнуть не могут, а связываются на ее поверхности со специализированными белками-рецепторами, каковые и отвечают за передачу сигнала. Связывание сигнальной молекулы с мембранным белком-рецептором инициирует цепь последовательно протекающих событий внутри клетки. Именно это имеют в виду, когда говорят о плазматической мембране как о преобразователе сигнала. Биохимические аспекты преобразования сигналов будут рассмотрены в главах 12 и 26.
Роль плазматической мембраны в поддержании формы клеток и их подвижности
Эукариотические клетки обладают своего рода каркасом, который, с одной стороны, придает им определенную форму, а с другой - допускает возможность ее изменения, позволяя клеткам двигаться и перемещать свои органеллы с одного места на другое. Этот каркас, называемый цитоскелетом (см. главу 29), в отличие от костного скелета животных, не жесткий и не имеет фиксированной структуры. Он образован белковыми волокнами, которые пронизывают цитоплазму и во множестве точек связаны с белками плазматической мембраны. Естественно, эти белки не способны к латеральной диффузии, свойственной обычным мембранным белкам.
Наиболее наглядным примером, демонстрирующим связь цитоскелета с мембранными белками, служит эритроцит. Он имеет форму двояковогнутого диска, что позволяет увеличить поверхность газообмена между цитоплазмой и внешней средой. При движении сквозь тончайшие капилляры эритроцит испытывает значительные механические нагрузки и благодаря гибкости и упругости претерпевает значительные, но обратимые изменения формы. Эритроцит обладает этими свойствами из-за наличия в нем плотного примембранного каркаса из волокон, образованных белком спектрином. Название этого белка происходит от английского слова spectre (тень, призрак), которое является синонимом другого английского слова ghost. Так называют эритроциты, сохранившие форму, но утратившие содержимое. Спектрин связан с белком анкирином (англ. anchor - якорь), который, в свою очередь, удерживается на внутренней поверхности мембраны благодаря связыванию с белком, ответственным за транспорт анионов. Другие якорные белки прикрепляют спектрин к гликофорину (рис. 3.13).
Рис. 3.13. Взаимодействие с цитоскелетом белка, транспортирующего анионы, и гликофорина
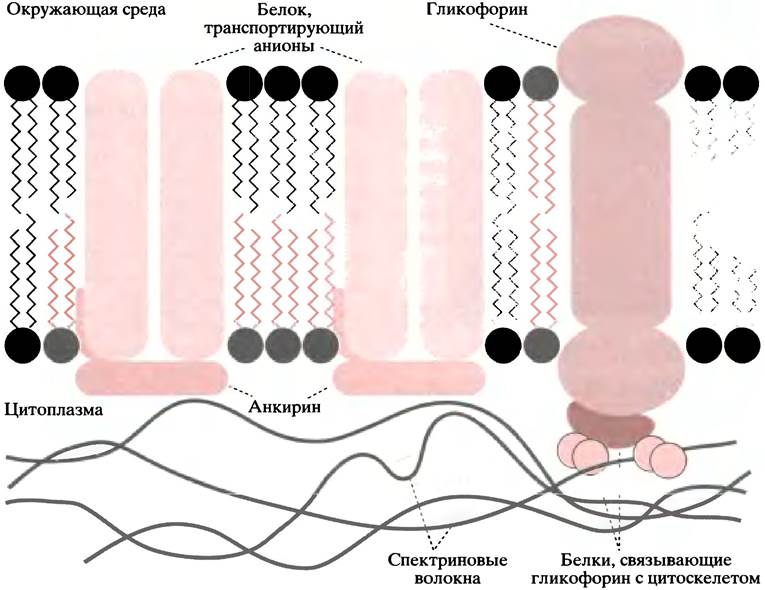
Известны больные, у которых цитоскелет эритроцитов нарушен из-за дефектов структуры спектрина или анкирина. При этом эритроциты имеют необычную форму и разрушаются в селезенке. Болезни, вызванные такими нарушениями, называют наследственным сфероцитозом или наследственным эллиптоцитозом.
Межклеточные взаимодействия: плотные соединения, контактные поры, ответственные за клеточную адгезию белки
Клетки эпителия, выстилающего пищеварительный тракт, служат посредниками при переносе продуктов расщепления пищи в кровь. Последние проникают в эпителиальную клетку через обращенную в кишечный тракт плазматическую мембрану, переносятся к противоположной стороне клетки и затем выходят через мембрану наружу, попадая в кровеносный капилляр. Именно так происходит всасывание, а не через промежутки между клетками, что в принципе невозможно, ибо клетки тесно прилегают друг к другу. Плотные соединения - общее название непроницаемых белковых конструкций, которые опоясывают прилегающие друг к другу клетки и связывают их между собой. В области плотного соединения не происходит даже латерального движения мембранных белков. Это имеет важное функциональное значение. Участки плазматической мембраны эпителиальной клетки, обращенные в просвет кишки и в кровеносный капилляр, содержат разные транспортные белки, которые в отсутствие латеральной диффузии могут переходить из одного участка в другой. В то же время было бы разумно обеспечить перемещение молекул между клетками для того, чтобы сделать их деятельность синхронной в пределах всей ткани. Это и в самом деле имеет место благодаря особым белкам, образующим межклеточные туннели, или контактные поры, способные пропустить такие молекулы, как АТР, но задерживающие крупные молекулы, например, белки. Важность такого межклеточного контакта не вызывает сомнений. Он необходим, например, для согласованного сокращения клеток сердечной мышцы.
Специальные тканеспецифичные адгезионные белки обеспечивают объединение однотипных клеток в ткань. Если смешать эмбриональные клетки различных типов, они образуют агрегаты из одинаковых клеток: печеночные объединяются с печеночными, почечные с почечными и т. д. Общее название белков, ответственных за адгезию, - кадхерины. Среди них выделяют отдельные группы, например, NCAMS (от англ. Nerve Cell Adhesive MoleculeS - адгезивные молекулы нервных клеток), играющие важную роль в формировании нервной ткани.
Внутриклеточные мембраны
До сих пор в этой главе речь шла только о наружной, или плазматической, клеточной мембране. Однако внутри эукариотических клеток находится много разных мембранных структур. Все они в основе имеют липидный бислой, но различаются липидным составом и набором входящих в мембраны функциональных белков. Внутренние мембранные структуры разбивают клетку на отдельные компартменты. Главные компоненты животной клетки показаны на рис. 3.14.
Рис. 3.14. Мембранные органеллы типичной животной клетки
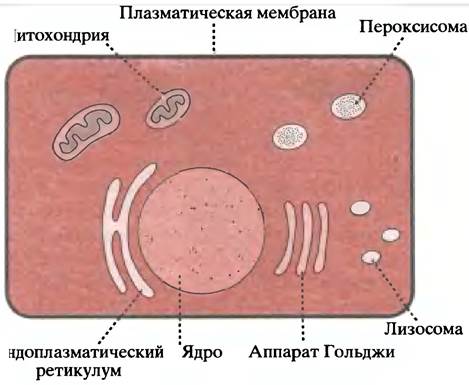
Перечислим наиболее существенные внутриклеточные органеллы и их функции.
1. Ядро, которое содержит ДНК и является местом синтеза ДНК и РНК.
2. Эндоплазматический ретикулум (ЭР) - сеть мембранных трубочек и цистерн, занимающих половину объема клетки. Здесь синтезируются все мембранные белки, а также белки, подлежащие секреции или требующие доставки к определенным участкам клетки. Часть ретикулума усеяна рибосомами - структурами, ответственными за синтез белков. Эти области называют шероховатым ретикулумом, в отличие от гладкого, где рибосом нет.
3. Аппарат Гольджи - стопки уплощенных цистерн; здесь сортируются синтезированные в ретикулуме белки и рассылаются по назначению. И ретикулум, и аппарат Гольджи - полностью замкнутые структуры, все выходящее из них заключено в отпочковывающиеся, окруженные мембранами пузырьки.
4. Митохондрии - место окислительного метаболизма, где образуется большинство молекул АТР (во внутренней митохондриальной мембране), необходимых для различных энергетических нужд клетки.
5. Лизосомы содержат гидролитические ферменты, разрушающие нежелательные для клетки вещества.
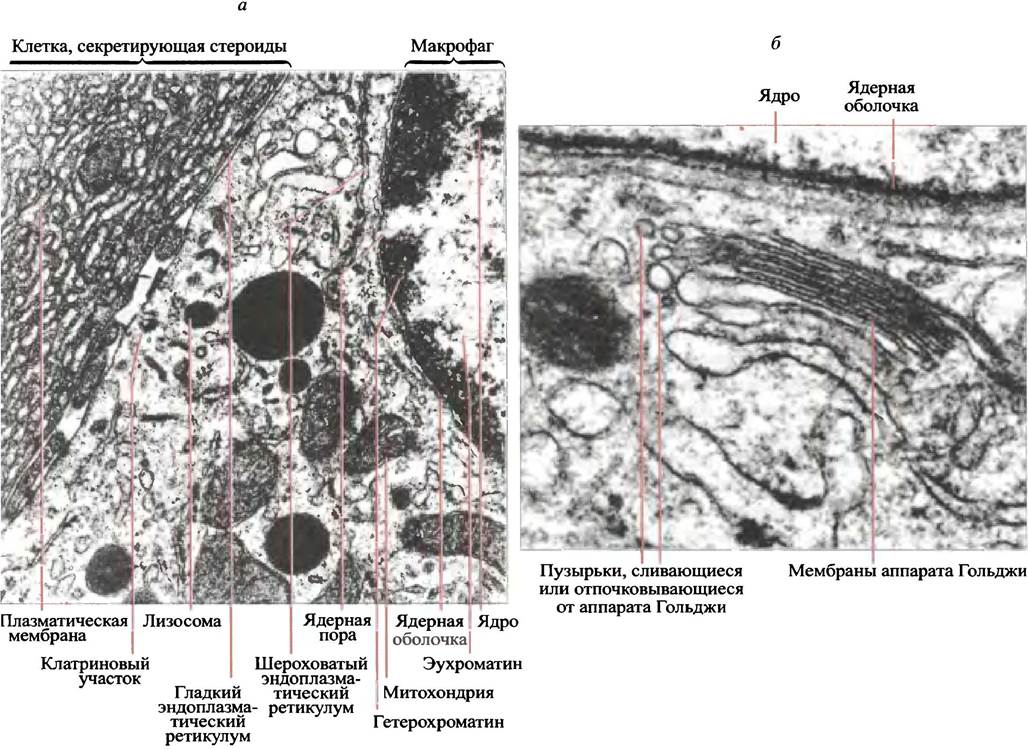
6. Пероксисомы - пузырьки с ферментами, катализирующими различные окислительные реакции. Разные клетки в разной мере нуждаются в тех или иных органеллах. На электронной микрофотографии среза яичка (рис. 3.15, а, б) видны участки гладкого ретикулума, где сосредоточены ферменты, участвующие в синтезе стероидов. Особенно развит ретикулум в клетках, секретирующих белки, например, пищеварительные ферменты или антитела. Клетки, которые нуждаются в большом количестве АТР (например, мышечные), богаты митохондриями. Большой редкостью являются клетки, которые вообще лишены органелл. Примером могут служить зрелые эритроциты.
Рис. 3.15. Электронные микрофотографии срезов яичка: а - Клетка, секретирующая стероиды (обратите внимание на гладкий эндоплазматический ретикулум и макрофаг); б - та же клетка при большом увеличении: хорошо виден аппарат Гольджи
Вопросы к главе 3
1. Какие структурные особенности амфипатических соединений определяют их способность к образованию в воде мицелл или липосом?
2. Входят ли триглицериды в состав биологических мембран?
3. Могут ли белки пройти через липидный бислой?
4. Какова функция холестерина в мембранах эукариотических клеток?
5. Изобразите строение фосфатидной кислоты.
6. Назовите три фосфолипида - производных фосфатидной кислоты, и те группы, которыми они различаются.
7. Опишите строение сфингомиелина.
8. Чем цереброзид и ганглиозид отличаются от сфингомиелина?
9. Что такое сиаловая кислота? Какова ее структура?
10. В чем состоит функциональная роль цис-ненасыщенных жирнокислотных хвостов в фосфолипидах мембран?
11. Почему липидные мембраны плохо проницаемы для полярных молекул?
12. Чем облегченная диффузия через мембраны отличается от обыкновенной? Приведите пример.
13. Объясните, как вычислить энергию, которая требуется для переноса вещества в клетку. Сколько нужно затратить энергии для переноса одного моля вещества, если снаружи его концентрация в десять раз меньше, чем внутри?
14. Как удается клеткам поддерживать внутреннюю концентрацию ионов калия на высоком уровне, а концентрацию ионов натрия на уровне гораздо меньшем, чем в окружающей среде?