Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Стехиометрия и энергетика метаболических превращений
Стехиометрия клеточного роста и образования продуктов метаболизма
Заключение
Теперь мы знаем, что в живой клетке происходит множество чрезвычайно сложных химических превращений. Несмотря на всю сложность химии клеточных процессов, в них очень часто можно обнаружить некоторые ключевые соединения и реакции, общие для всех путей клеточного метаболизма. Вероятно, самыми важными процессами такого типа являются транспорт энергии при посредстве АТР (рис. 5.33) и транспорт восстанавливающих эквивалентов в виде NAD. Мы узнали также, что стехиометрические соотношения на разных уровнях могут использоваться для выяснения взаимосвязей между различными химическими превращениями, являющимися частью клеточного метаболизма.
В следующей главе мы закончим наше краткое изучение биологии и биохимии живой клетки, а затем приступим к трудной проблеме анализа, изучения и проектирования технологических процессов, в которых используются биологические реакции.

РИС. 5.33. Схема потоков энергии в клетке и ее окружении. (Леви А., Сикевиц Ф., Структура и функция клетки. —М.: Мир, 1971.)
Упражнения
5.1. Равновесие. Стандартное изменение свободной энергии в реакций фосфоенолпируват + ADP → пируват + АТР равно —7,50 ккал. Найдите концентрации всех веществ, если исходная смесь содержала 6,0 мМ ADP, 6,0 мМ фосфоенолпирувата, 6,0 мМ АТР и не содержала пирувата.
5.2. Функции химических элементов. Назовите важнейшую биологическую функцию (или функции) в клетке и доминирующую при выполнении каждой из функций химическую форму для каждого из перечисленных в табл. 5У2.1 элементов и соединений. Действительно ли каждый из содержащихся в золе элементов имеет определенную биохимическую функцию? [См. Frey С. N., Ind. Eng. Chem., 22, 1154 (1930).]
Таблица 5У2.1. Ориентировочный состав золы, образующейся при полном окислении дрожжей
Компонент |
Ориентировочное содержание, % |
Компонент |
Ориентировочное содержание, % |
Пентоксид фосфора |
50 |
Оксид кремния |
1 |
Оксид калия |
35 |
Оксид натрия |
1 |
Оксид магния |
5 |
Триоксид серы |
0,5 |
Оксид кальция |
1 |
Хлор, железо |
Следы |
5.3. Стандартное изменение свободной энергии. Изменение свободной энергии реакции ∆G связано с электродными потенциалами Е1 и Е2 индивидуальных полуреакций следующим уравнением:
![]()
где n — число электронов, мигрирующих при превращении одной молекулы, ℱ — константа Фарадея [ℱ ≈ 23 ккал/(В∙моль)], а Ei (i = 1, 2) определяется по уравнению Нернста:
![]()
где si — концентрация реагента в окисленной или восстановленной форме и Еi0 — электродный потенциал при si,red/si, ox = 1,0 по отношению к водородному полуэлементу:
![]()
Электродные потенциалы некоторых необходимых реакций приведены в табл. 5У3.1.
Таблица 5У3.1а
Реакция на электроде |
n |
Е0, В |
Ацетат + СO2 + 2Н+→ пируват + 2Н2O |
2 |
-0,70 |
Ацетоацетат + 2Н+→ β-гидроксибутират |
2 |
-0,27 |
Пируват + 2Н+→ лактат |
2 |
-0,19 |
S + 2H+→ H2S |
2 |
-0,23 |
1/2O2 + 2Н+→ Н2O |
2 |
0,82 |
NAD(P)+ + 2H+ → NAD(P)H + H+ |
2 |
-0,32 |
FAD + 2H+ → FADH2 (свободный кофермент) |
2 |
-0,18 |
Хлорофилл+ → хлорофилл* + е- (фотосинтез в эукариотах, нециклическая часть) |
1 |
-0,2 |
Хлорофилл+ → хлорофилл (фотосинтез в эукариотах, нециклическая часть) |
1 |
0,9 |
NO3- + 2H+ → NO2- + H2O |
2 |
0,42 |
SO42- + 2H+→ SO32- + H2O |
2 |
0,48 |
Ацетат + 2Н+→ ацетальдегид + Н2O |
2 |
-0,60 |
Ацетальдегид + 2Н+→ этанол |
2 |
-0,20 |
а Данные из работы: Wood W. В., Wilson J. Н., Benbow R. М., Hood L. E., Biochemistry: A Problems Approach, pp. 190—191, W. A. Benjamin, Inc., Palo Alto, CA, 1974.
Воспользовавшись приведенными в таблице стандартными электродными потенциалами, выясните, возможны ли следующие реакции в стандартных условиях:
а) перенос электрона от возбужденного хлорофилла,
б) окисление ß-гидроксибутирата кислородом,
в) окисление ацетальдегида ацетальдегидом (дисмутация или радикальное диспропорционирование).
5.4. Изменение свободной энергии в клетке, а) На базе приведенных в табл. 5.3 данных вычислите изменение свободной энергии для каждой стадии гликолиза в эритроцитах человека.
б) По полученным вами данным и величине свободной энергии гидролиза АТР до ADP в тех же условиях докажите необходимость АТР для инициирования отдельных стадий, протекающих с его участием.
в) По данным предыдущих расчетов, определите общее изменение свободной энергии ∆G' в процессе гликолиза в клетке.
5.5. Кинетика взаимосвязанных реакций. В клетке одновременно осуществляется множество реакций, однако часто кажущаяся кинетика последовательности реакций определяется очень небольшим числом стадий.
а) Покажите, что в стационарном состоянии математическое выражение, определяющее скорость образования Р в последовательности реакций, формально отвечающей схеме Михаэлиса — Ментен
E + S ⇄ ES → Е + Р
не отличается от соответствующего выражения для последовательности равновесных реакций:
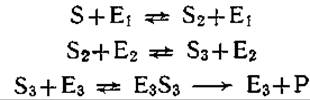
б) Приведенные на рис. 5.4 десять последовательных реакций можно выразить только тремя кинетическими уравнениями, описывающими
![]()
Назовите вещества А, В и С. Таблица 5У5.1
Субстрат |
∆G°', ккал/моль |
Субстрат |
∆G°', ккал/моль |
Фосфоенолпируват |
-12,8 |
Глюкозо-1-фосфат |
-5,0 |
1,3-Дифосфоглицерат |
-11,8 |
Фруктозо-6-фосфат |
-3,8 |
Фосфокреатинин |
-10,5 |
Глюкозо-6-фосфат |
-3,3 |
Ацетилфосфат |
-10,1 |
3-Фосфоглицерат |
-3,1 |
АТР (концевая связь) |
-7,3 |
Глицеро-1-фосфат |
-2,3 |
в) В табл. 5У5.1 приведены стандартные свободные энергии гидролиза ряда фосфатов. Как изменится вычисленная вами (в упражнении 5.4) разность свободных энергий для трех указанных в пункте б стадий, если в клетке отношение ATP/ADP уменьшится в 10 раз (при постоянной суммарной концентрации ATP+ADP)? Какой полезный (или вредный) для клетки эффект будет результатом этого изменения?
5.6. Регенерация ATP. Благодаря сопряжению с гидролизом АТР до ADP или АМР в клетке осуществляется множество реакций с неблагоприятными константами равновесия. Применение для аналогичного синтеза свободных ферментов потребовало бы в конечном счете переноса фосфатной группы (для регенерации АТР) от системы с более высокой свободной энергией гидролиза.
а) Какова стоимость 1 фунта каждого из соединений, перечисленных в табл. 5У5.1, свободная энергия гидролиза которых больше ∆G' АТР? (Данные можно взять из любого каталога биохимических реактивов.)
б) Какой должна быть концентрация фосфорилированного соединения (глюкозо-1-фосфата, фруктозо-6-фосфата, глицеро-1-фосфата), чтобы из АDP образовывался АТР в концентрациях, указанных в табл. 5.3?
5.7. Регенерация NAD в ферментативных трансформациях стероидов. Метод трансформации стероидов в присутствии 20β-гидроксистероид-дегидрогеназы (20ß-HSDH) [Cremonesi Р. et al., Enzymatic preparation of 20ß-Hydroxysteroids in a two phase system, Biotech. Bioeng., 17, 1101 (1975)] состоит из трех стадий:
Гидрирование стероида:
![]()
Окисление этанола:
![]()
Связывание ацетальдегида:
![]()
Константа равновесия протекающих совместно реакций (1) и (2) близка единице.
а) Оцените термодинамическую вероятность превращения кортизона, если принять, что константа равновесия реакций (1) и (2) равна единице и что константа равновесия реакции (3) (которая в состоянии равновесия также должна быть обратимой) составляет 10, 103, 105, 1010 (в единицах обратных концентраций). Выразите результаты в виде графической зависимости степени превращения кортизона от lg К.
б) Поскольку стероиды относительно малорастворимы в воде (в 1 л насыщенного водного раствора содержится от 10-4 до 10-5 моль стероида), для увеличения общего количества кортизона в системе добавляют органические растворители, образующие двухфазную систему. Таким образом, органическая фаза, содержащая относительно высокие концентрации стероида (в 100 мл бутилацетата растворяется 0,160 г кортизона), выполняет функцию резервного источника, постоянно подпитывающего водную фазу. Оцените максимально возможную степень превращения кортизона, приняв, что объемная доля бутилацетата в водно-бутанольной эмульсии равна є, растворимость кортизона в воде равна 10-4 моль/л, дигидрокортизон в воде растворим в той же мере, что и кортизон, а в бутилацетате нерастворим и что К реакции (3) составляет 10, 103 или 105. Выполните те же расчеты, приняв, что растворимость дигидрокортизона в 100 мл бутилацетата равна 0,160 г.
в) Перечислите термодинамические механизмы, использующиеся в этом процессе для осуществления реакции (1).
5.8. Проницаемость. Выведите уравнение (5.40). Обоснуйте все допущения.
5.9. Материальный баланс веществ, участвующих в сети взаимосвязанных реакций. Предположим, что у вас есть рассеянный друг, который, к несчастью, не слишком хороший экспериментатор. На лабораторных занятиях он выполнял задачу по брожению, однако забыл взвесить добавленную глюкозу и определить содержание спирта в образовавшейся смеси. Он установил, что в результате брожения образовались перечисленные в табл. 5У9.1 вещества. Ему известно, что вся глюкоза (С6Н12О6) окисляется по пути ЭМП до пировиноградной кислоты (СН3СОСООН) и что никакие другие соединения, кроме этанола, ие должны образовываться. Он просит вас помочь ему как-нибудь разобраться в этой путанице. Что вы должны ответить ему на вопрос о том, сколько молей этанола образовалось? (Обоснуйте ваш ответ.)
Таблица 5У9.1
Вещество |
Количество, моль |
Вещество |
Количество, моль |
Молочная кислота СН3СНОНСООН |
10 |
Диоксид углерода СО2 |
15 |
Уксусная кислота СН3СООН |
5 |
Водород Н2 |
10 |
5.10. Определение понятия «жизнь». Выскажите свои соображения о необходимости (или ее отсутствии) каждого слова в следующем определении жизни [Perrett J., New Biol., 12, 68 (1952)]: «Жизнь — это потенциально самовозмущающаяся открытая система связанных органических реакций, катализируемых постадийно и практически изотермично сложными и специфическими органическими катализаторами, которые продуцируются этой же системой». Более поздние определения понятия «жизнь» можно найти, например, в книге: Bernal J. D., Theoretical and Mathematical Biology, p. 96, Blaisdell Publ. Co., N.Y., 1965.
5.11. Свободная энергия и перенос электронов. Внутриклеточные соединения-предшественники обычно представляют собой ионы; с другой стороны, перенос свободной энергии в гликолизе, цикле ТКК, митохондриальных и других метаболических процессах тесно связан с миграцией электронов. Отсюда следует, что энергетика внутриклеточных процессов может оцениваться в каких-либо единицах, отражающих явления переноса электронов. Мак-Карти в статье Energetics of Organic Matter Degradation [Water Pollution Microbiology, Mitchell R. (ed.), p. 91, Wiley-Interscience, New York, 1972] предложил использовать особый параметр — коэффициент Ye (количество клеток в граммах, отвечающее 1 химическому эквиваленту образующихся клеток), определяемый как
![]()
где С — количество клеток в граммах, отвечающее 1 химическому эквиваленту в полуреакции их окисления; h — число электронов, действительно переносимых от молекулы-донора, деленное на число химических эквивалентов в моле (в соответствующей электродной полуреакции), обычно h = 1,0; А — отношение количества химических эквивалентов донора электронов (источника энергии) к числу химических эквивалентов образовавшихся клеток.
Если клетке отвечает формула C5H7O2N и полуреакция окисления выражается уравнением
![]()
то вычисленное значение С составляет 5,65.
а) Проверьте правильность вычисленного значения С.
б) Проверьте правильность приведенных в табл. 5У11.1 значений А и Yе по другим данным той же таблицы.
Таблица 5У11.1. Определение коэффициентов Ye по энергетическим параметрам окисления субстрата K = 0,6; источник азота — аммиак)a
Донор электронов |
Акцептор электронов |
∆Grб, ккал |
∆Gp, ккал |
А (вычислено) |
Ye(вычислено), г/экв |
Ацетат |
O2 |
—25,28 |
1,94 |
0,71 |
7,96 |
NO3-(восстановление до N2) |
—23,74 |
1,94 |
0,76 |
7,43 |
|
SO42- |
—1,52 |
1,94 |
11,8 |
0,48 |
|
СO2 |
—0,85 |
1,94 |
21,1 |
0,27 |
|
Глюкоза |
O2 |
—28,70 |
—1,48 |
0,38 |
14,90 |
СO2 |
—4,26 |
—1,48 |
2,58 |
2,19 |
|
Этанол |
O2 |
—26,27 |
0,95 |
0,58 |
9,76 |
СO2 |
—1,83 |
0,95 |
8,3 |
0,67 |
a McCarty Р. L., in Water Pollution Microbiology, Mitchell R. (ed.), p. 107, Wiley-Interscience, New York, 1972.
б Продукты реакции и реагенты в стандартных условиях, за исключением pH (рН-7).
Если К всегда (как в табл. 5У14.1) принимать равным 0,60, то расчетные значения А отличаются от экспериментальных значений (для 25 систем, приблизительно половина из которых анаэробные, а другие — аэробные) обычно не более чем на 50%.
Необходимое в определении Ye (см. выше) значение А находят по уравнению
![]()
где ∆Gp — свободная энергия, необходимая для превращения веществ, являющихся источником углерода в клеточном синтезе, в промежуточные соединения;
∆Gn — свободная энергия, необходимая для превращения неорганических соединений — источников азота в аммиак (степень окисления которого соответствует степени окисления азота в веществах клетки);
∆Gc — свободная энергия, необходимая для превращения промежуточных соединений (источников углерода) и аммиака в компоненты клетки (с учетом эффективности процессов ∆Gc≈7,5 икал на 1 химический эквивалент клеток);
К — средняя эффективность переноса свободной энергии (в гетеротрофах или аутотрофных бактериях K = 0,4—0,8);
∆Gr — изменение свободной энергии при окислении 1 химического эквивалента субстрата.
При указанной выше стехиометрии клетки в зависимости от источника азота значение ∆Gn составляет 0 (аммиак), 3,25 (нитрит), 4,17 (нитрат), 3,78 (N2).
5.12. Сопряженный транспорт. Предположим, что компонент А нерастворим в мембране толщиной L и что его концентрация на наружной и внутренней поверхностях мембраны равна а1 и а2. Существующий только в мембране носитель В образует на поверхности мембраны комплекс AB. Принимая, что реакция комплексообразования равновесна на любой поверхности мембраны (но не внутри ее) и что константы равновесия равны K1 и К2, определите поток А от поверхности 1 к поверхности 2, если коэффициент диффузии AB равен. При каких условиях (если такие условия вообще возможны) будет происходить активный транспорт А?
5.13. Стехиометрия клеточного роста и экономические коэффициенты, а) Приняв, что клетки могут превращать в биомассу две трети (по массе) углеродсодержащего субстрата (углеводорода или глюкозы), вычислите «стехиометрические» коэффициенты утилизации гексадекана или глюкозы:
Гексадекан:
![]()
Глюкоза:
![]()
б) Вычислите три коэффициента Ys, Y0, Y∆. Обратите внимание на то, что Y0 и Y∆ для углеводорода меньше соответствующих коэффициентов для глюкозы даже при условии равных эффективностей превращения углерода в биомассу.
5.14. Метаболические реакции in vitro. Экстракт дрожжей инкубируют с 200 ммоль D-глюкозы, 20 ммоль АТР, 2 ммоль NAD+ и 20 ммоль фосфата (экстракт содержит все ферменты, необходимые для превращения глюкозы в этанол). Какова будет концентрация глюкозы и этанола в состоянии равновесия? Как можно довести процесс брожения до конца?
5.15. Энергетическая эффективность накопления глюкозы в виде гликогена. Сравните количество энергии, необходимой для включения одной молекулы глюкозы в гликоген, с энергией, выделяющейся при последующей деградации одного остатка глюкозы в процессе а) брожения и б) дыхания. Какие энергетические условия способствуют накоплению гликогена?
5.16. Особые случаи стехиометрии метаболизма. Для оценки стехиометрических коэффициентов в процессах метаболизма часто предлагалось определять дыхательный коэффициент [RQ; уравнение (5.51)]. а) Найдите систему двух линейных алгебраических уравнений с двумя неизвестными а и b, входящими в уравнения (5.53) и (5.54) при d [NADH + H+]/dt = 0; используйте при этом определение RQ. б) Найдите условия, при которых матрица коэффициентов в уравнениях для а и b становится сингулярной (т. е. имеет нулевой определитель); объясните физический смысл таких условий, в) Сообщалось, что при росте дрожжей (y = 4,14) на глюкозе (ys = 4,0) и аммнаке (yN = 0) связанное с биосинтезом выделение СO2 невелико (σ = 0,095). Вычислите а и b для значений RQ, равных 1,05 и 1,06. Объясните практическую ценность применения RQ для определения стехиометрии метаболизма в этой системе [12].
Литература
Биоэнергетика
В качестве дополнительной литературы рекомендуются ссылки [4—6] в гл. 2, а также следующие источники:
1. Lehninger A. L, Bioenergetics, 2d ed., W. A. Benjamin, Inc., New York, 1971.
2. Peusner L., Concepts in Bioenergetics, Prentice-Hall, Inc., Englewood Clifts, N.J., 1974. В этой монографии при изучении биоэнергетики значительно больше внимания уделяется термодинамике.
Метаболизм
Рекомендуется вся литература, приведенная в гл. 2, а также следующие источники:
3. Doelle Н. W., Bacterial Metabolism, 2d ed., Academic Press, New York. Великолепный обзор важнейших метаболических процессов в различных бактериях.
4. Atkinson D. Е., Cellular Energy Metabolism and Its Regulation, Academic Press, New York, 1977. Основное внимание в этой очень глубокой монографии уделяется роли энергетических факторов в регуляции метаболизма.
Стехиометрия клеточного роста и образования продуктов метаболизма
5. Atkinson В., Mavituna F., Biochemical Engineering and Biotechnology Handbook, Macmillan Publishers Ltd., Surrey, England, 1983. В этом справочнике собраны превосходно подобранные и удачно расположенные многочисленные данные и сведения по теме настоящей главы и по другим интересным вопросам.
6. Pirt S. J., Principles of Microbe and Cell Cultivation, Blackwell Scientific Publications, Oxford, 1975. Здесь хорошо объясняются понятие об экономических коэффициентах и многие другие аспекты клеточного роста.
7. Herbert D., Stoichiometric Aspects of Microbial Growth, p. 1 in Continuous Culture 6: Applications and New Fields, Dean A. C. R., Ellwood D. C., Evans C. G. T., Meiling J. (eds.), Ellis Horwood Ltd., Chichester, England, 1976. Здесь дано четкое объяснение понятия о С-моле и обсуждается значение этого понятия.
8. Roels J. А., Simple Model for the Energetics of Growth on Substrates with Different Degrees of Reduction, Biotech. Bioeng., 22, 33 (1980).
9. Poels J. A., Bioengineering Report: Application of Macroscopic Principles to Microbial Metabolism Biotech. Bioeng., 22, 1437 (1980).
10. Erickson L. E., Minkevich I. G., Eroshin V. K. Application of Mass and Energy Balance Regularities in Fermentation, Biotech. Bioeng., 20, 1595 (1978).
11. Nagai S., Mass and Energy Balances for Microbial Growth Kinetics, p. 49, in Advances in Biochemical Engineering, v. 11, Ghose T. K., Fiechter A., Blakebrough N. (eds.), Springer-Verlag, Berlin, 1979.
12. Stephanopoulos G., San K. Y., Grosz R., Studies on On-Line Bioreactor Identification I—IV; Biotech Bioeng., 26, 1176, 1189, 1198, 1209 (1984).
13. Stouthamer A. H., A Theoretical Study on the Amount of ATP Required for the Synthesis of Microbial Cell Material; Anton, van Leeuwenhoek, 39, 545 (1973).
14. Minkevich I. G., Mass-Energy Balance for Microbial Product Synthesis — Biochemical and Cultural Aspects, Biotech. Bioeng., 25, 1267 (1983).
15. Cooney C. L., Acevedo F., Theoretical Conversion Yields for Penicillin Synthesis, Biotech. Bioeng., 19, 1449 (1977).
Выделение теплоты в процессах метаболизма
См. приведенные выше ссылки [5, 6, 8, 9, 11, 14] и [4] в гл. 14, а также следующую литературу:
16. Abbott В. J., Clamen A., The Relationship of Substrate, Growth Rate, and Maintenance Coefficient to Single Cell Protein Production, Biotech. Bioeng., 15, 117 (1973).
17. Kanazawa M., The Production of Yeast from n-Paraffins, p. 438 in Single Cell Proteins II, Tannenbaum S., Wang D. I. C. (eds.), MIT Press, Cambridge, MA, 1975.
18. Servizi J. A., Bogan R. H., Thermodynamic Aspects of Biological Oxidation and Synthesis, J. Water Poll. Control Fed., 36, 607 (1961).