Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Молекулярная генетика и системы регуляции
Применение результатов исследования генетики микроорганизмов и популяций мутантов в промышленности
Применение ауксотрофных мутантов
Ауксотрофные мутанты (методы их селекции и идентификации приведены в табл. 6.3) отличаются отсутствием ферментативной активности, необходимой для осуществления одной или нескольких стадий в каком-либо из биосинтетических путей. В результате ауксотрофы не способны синтезировать конечный продукт этого пути метаболизма. Такой мутант может выжить только при наличии в питательной среде несинтезируемого метаболита. Например, триптофановый ауксотроф будет расти только в присутствии триптофана. Если штамм сам синтезирует триптофан, то его называют прототрофным по триптофану.

РИС. 6.18. Для повышения выхода промежуточных продуктов какого-либо пути метаболизма можно использовать ауксотрофные мутанты. В приведенном здесь гипотетическом примере у мутанта отсутствует фермент с и, следовательно, не синтезируется репрессор Е. (Воспроизведено из работы: Demain A. L., Overproduction оf Microbial Metabolites and Enzymes due to Alteration of Regulation, in Advances in Biochemical Engineering 1, Ghose T. K., Fiechter A. (eds.), p. 120, Springer-Verlag, New York, 1971.)
Поскольку отсутствующие метаболиты вводятся в питательную среду, а не синтезируются ауксотрофом, то концентрации этих метаболитов регулирует, по сути дела, не микроорганизм, а инженер-технолог. С практической точки зрения такая ситуация может быть очень удобной, если несинтезируемый продукт метаболизма является репрессором. Как показано на рис. 6.18, неспособные к синтезу репрессора ауксотрофные мутанты можно заставить перепроизводить* тот или иной промежуточный продукт метаболизма. Поддерживая в среде низкую концентрацию репрессора Е, можно свести к минимуму процессы ингибирования по принципу обратной связи и подавления активности ферментов (участвующих в данном пути метаболизма). При этом промежуточное соединение С (обычно являющееся субстратом фермента с, отсутствующего в данном мутанте) образуется в гораздо более высокой концентрации, чем в нативном организме.
* Под «перепроизводством» здесь понимается повышенная скорость биосинтеза вещества по сравнению с оптимальной скоростью, необходимой для роста клетки. Оптимальная для клетки скорость биосинтеза, однако, не обеспечивает выход, достаточно высокий для промышленного производства. Именно поэтому в промышленности используют мутантные штаммы с нарушенными системами регуляции.
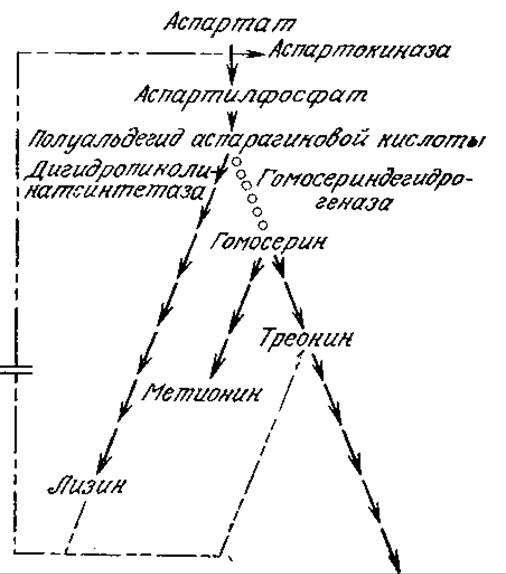
РИС. 6.19. Мутант С. glutamicum, у которого отсутствует фермент гомосерин-дегидрогеназа, продуцирует повышенные количества L-лизина. (Воспроизведено из работы: Demain A. L., Overproduction of Microbial Metabolites and Enzymes due to Alteration of Regulation, in Advances in Biochemical Engineering 1, Ghose T. K, Fiechter A., (eds.), p. 122, Springer-Verlag, New York, 1971.)
Как мы уже указывали в конце предыдущего раздела, в подобной ситуации может возникнуть потребность в дополнительных операциях, обеспечивающих диффузию промежуточного вещества С через клеточную мембрану в среду.
На рис. 6.19 изображен механизм, лежащий в основе промышленного способа производства L-лизина с участием ауксотрофного мутанта С. glutamicum. В высокопродуктивном мутанте отсутствует фермент гомосериндегидрогеназа, поэтому ингибирование синтеза лизина треонином (через аспартокиназу) у этого мутанта не наблюдается. Поскольку ауксотрофный мутант не синтезирует ни треонин, ни метионин, то обе эти аминокислоты должны добавляться к питательной среде.
Сравнение регуляции путей биосинтеза аминокислот семейства аспарагиновой кислоты в С. glutamicum (рис. 6.19) и в Е. coli (рис. 5.12) приводит к важному выводу: организмы, обладающие сходными путями биосинтеза, не обязательно имеют идентичные системы регуляции. Обратите внимание, в частности, на то, что на схеме рис. 5.12 лизин автоингибирует свой собственный биосинтез с помощью реакции, ведущей к дигидропиколиновой кислоте. В диком (немутантном) штамме С. glutamicum соответствующая стадия ингибирования отсутствует. Обнаруженная в Corynebacterium аспартокиназная система, по-видимому, отличается от системы Е. coli тем, что первая подавляется только при совместном присутствии лизина и треонина (согласованное или поливалентное ингибирование по принципу обратной связи), а изоферменты аспартокиназы в Е. coli ингибируются одним лизином. Именно по этим причинам с промышленной точки зрения выгоднее использовать Corynebacterium.
Аналогичный подход успешно применялся при разработке высокоэффективных микробиологических процессов производства вкусовых веществ — пуриновых нуклеотидов гуанозинмонофосфата (GMP), инозинмонофосфата (IMP) и ксантинмонофосфата (ХМР). Как показано на рис. 6.20, минимизация концентраций АМР и GMP с помощью ауксотрофного мутанта Brevibacterium ammoniagenes позволяет интенсифицировать биосинтез инозина и гипоксантина. Концентрация последних в среде возрастает при добавлении небольших количеств (около 10 мкг/л) ионов марганца (Мn2+). Имеющиеся в настоящее время данные показывают, что марганец изменяет проницаемость клеточных мембран.