Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Молекулярная генетика и системы регуляции
Технология рекомбинантных ДНК
Векторы для Escherichia coli
Векторами называют молекулы ДНК, обеспечивающие амплификацию фрагмента ДНК в растущей популяции клеток. Чтобы вектор отвечал всем предъявляемым к нему в процессе клонирования требованиям, он должен обладать следующими свойствами:
1. Способностью реплицироваться в клетке-хозяине.
2. Способностью включать чужеродные ДНК различной молекулярной массы без нарушения способности к репликации.
3. Легкостью введения в клетку-хозяина после включения чужеродной ДНК.
4. Наличием генетического маркера селекции, обеспечивающего быструю положительную селекцию клеток, содержащих вектор.
5. Наличием только одного сайта, подвергающегося расщеплению одной или несколькими рестрикционными эндонуклеазами.
Для клонирования ДНК в Е. coli применяли два класса векторов — плазмиды и бактериофаги. Здесь основное внимание будет уделено плазмидным векторам.
Как мы уже упоминали выше, при введении плазмид в клетки Е. coli используется механизм трансформации. Поскольку трансформированная клетка Е. coli может включить только одну плазмиду, а для последующего выделения, идентификации и применения интересующих нас последовательностей ДНК необходим клон, состоящий из большого числа идентичных клеток, содержащих плазмиды, то плазмида обязательно должна обладать способностью к репликации в растущей бактериальной клетке. Для этого в свою очередь нужно, чтобы в состав плазмиды входил участок начала репликации — нуклеотидная последовательность (около 600 пар оснований в случае плазмид Е. coli типа СоlЕ-1), направляющая и регулирующая процесс репликации таким образом, чтобы каждая клетка содержала достаточное число копий плазмид (обычно около 30).
Немаловажны и генетические маркеры селекции. Если, например, в плазмиду включить ген устойчивости к антибиотику, то быстрая положительная селекция содержащих плазмиды клеток не вызовет затруднений. Для этого достаточно вырастить клетки па среде, содержащей антибиотик в такой концентрации, которая приведет к гибели всех не имеющих плазмиды клеток, но в то же время обеспечит рост клеток, содержащих плазмиды, а следовательно, и ген устойчивости к антибиотику. Другой общий подход к селекции заключается в использовании мутантной клетки-хозяина, у которой отсутствует фермент, необходимый для роста в определенной среде, и в одновременном введении соответствующего этому ферменту нормального гена в рекомбинантную плазмиду. В этом случае экспрессия гена плазмиды комплементирует генетический дефект клетки-хозяина.
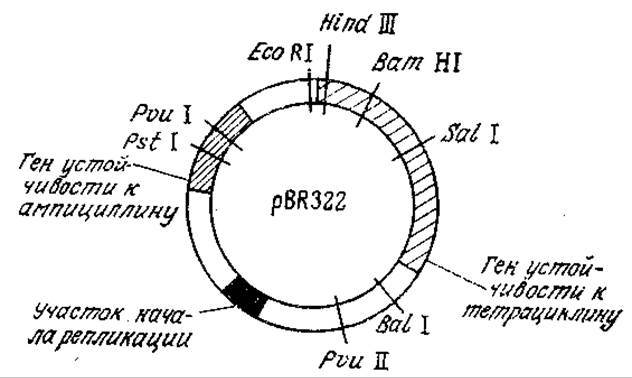
РИС. 6.23. Генетическая карта плазмиды pBR322. Показаны локусы генов и ряд сайтов рестрикции. Расшифрована последовательность всех 4363 пар оснований плазмиды.
В технологии рекомбинантных ДНК маркеры селекции в плазмидах могут выполнять две различные функции. Во-первых, методы положительной селекции, позволяющие быстро идентифицировать содержащие вектор колонии, резко интенсифицируют лабораторные исследования. Во-вторых, при последующем выращивании содержащих плазмиду клеток давление отбора (обусловленное, например, введением в питательную среду антибиотика) сводит к минимуму конкуренцию со стороны любых не содержащих плазмиду клеток, которые могут возникать входе роста популяции.
Плазмидные векторы для клонирования в Е. coli особенно широко изучались в последние годы. К числу наиболее популярных относится плазмида pBR322 (рис. 6.23), содержащая ряд единичных сайтов рестрикции, гены устойчивости к тетрациклину и ампициллину, а также участок начала репликации, обеспечивающий амплификацию плазмиды в клетке. Здесь под амплификацией (экстракопированием) понимается существенное повышение количества плазмид по отношению к хромосомной ДНК. В случае pBR322 и родственных плазмид амплификация становится возможной благодаря тому обстоятельству, что в отличие от хромосомы репликация плазмиды в клетке-хозяине может осуществляться и тогда, когда белковый синтез остановлен. Поэтому добавление к культуральной жидкости ингибитора белкового синтеза, например хлорамфеникола, приводит к синтезу от 30 до 1000 и более копий плазмиды, а следовательно, и клонируемой ДНК. Это позволяет получить последнюю в количествах, достаточных для ее идентификации и последующего использования в качестве реагента при конструировании других ДНК. В плазмиде pBR322 и родственных векторах могут клонироваться сегменты чужеродных ДНК, содержащие до 15 тысяч пар оснований.
В качестве клонирующего вектора широко изучался также бактериофаг λ, который сохраняет способность к репликации и литические функции после делеции 25% генома дикого типа; это позволяет клонировать сегменты чужеродной ДНК, содержащие до 12 тысяч пар оснований. Значительно большие сегменты ДНК (до 50 тысяч пар оснований) удается клонировать с помощью гибридных плазмидно-фаговых λ векторов, называемых космидами; последние могут быть введены в головку и хвост фага Я. По этой причине векторы-бактериофаги предпочтительнее в тех случаях, когда возникает необходимость в клонировании библиотек, состоящих из целого генома эукариоты или из ее очень больших фрагментов. Полезные векторы получали также из фагов с одноцепочечным геномом, например из фага М13. Получаемые с их помощью одноцепочечные клоны особенно удобны для определения нуклеотидных последовательностей ДНК по методу Сэнджера. Следующий раздел будет посвящен методам выяснения последовательностей нуклеотидных остатков и другим методам идентификации клонированных ДНК.