Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Кинетика процессов утилизации субстрата, образования продуктов метаболизма и биомассы в культурах клеток
Кинетика образования продуктов метаболизма
Кинетика образования продуктов жизнедеятельности филаментозными организмами
Кинетика образования продуктов метаболизма и утилизация субстрата плесневыми грибами и другими филаментозными организмами обычно очень сложна. Типичным примером может служить биосинтез пенициллина в периодическом процессе. Как показано па рис. 7.30, существуют три различных режима усвоения субстрата. В течение первых 20 ч происходит быстрая утилизация сахара, сопровождающаяся активным ростом плесени. В стационарной фазе утилизация субстрата замедляется, а скорость образования пенициллина достигает максимума. Затем скорость усвоения сахара опять возрастает и удерживается на высоком уровне вплоть до его истощения.
Аналогичная картина наблюдается и в ходе биосинтеза других антибиотиков, хотя каждый процесс имеет и свою специфику. В производстве стрептомицина, например, максимальная скорость синтеза антибиотика достигается (по сравнению с пенициллином) позднее, а заключительная фаза ускоренной утилизации сахара не наступает вообще. Процесс продуцирования антибиотика окситетрациклина филаментозным микроорганизмом Streptomyces rimosus интересен тем, что здесь результат всего процесса зависит и от морфологии организма. В табл. 7.8 суммированы основные стадии и особенности этого процесса.
Таблица 7.7. Вычисленные и найденные экспериментальным путем величины ß-галактозидазной активности, регулируемой системой lас-промотор-оператор, для дикого типа Е. coli и трех мутантов (i-, iq, isq) с различными внутриклеточными концентрациями lас-репрессора R ([R]0 = 2∙10-8М)а
Генотип |
Концентрация репрессора |
Индуктор |
ß-Галактозидазная активностьб Вычислено |
Найдено |
Литература |
i- |
0 |
_ |
113 |
100—140 |
[33] |
i- |
0 |
+ |
113 |
100—130 |
[33] |
i+ |
[R]0 |
- |
0,1 |
<0,1 |
[33] |
i+ |
[R]0 |
+ |
100 |
100 |
[33] |
iq |
10 [R]0 |
- |
0,011 |
0,01—0,014 |
[34] |
iq |
10 [R]0 |
+ |
62 |
65 |
[35] |
isq |
50 [R]0 |
- |
0,002 |
0,003—0,004 |
[34] |
isq |
50 [R]0 |
+ |
23 |
25 |
[35] |
а Воспроизведено с разрешения из статьи: Bailey J. Е., Hjortso М., Lee S. В., Srienc F., Kinetics of Product Formation and Plasmid Segregation in Recombinant Microbial Populations, Annals N. Y. Acad. Sсi., 413, 71 (1983).
б Относительно индуцированного дикого типа i+ (100%) при концентрации индуктора 10-3 М.
Ниже перечислены некоторые особенности образования продуктов жизнедеятельности, характерные только для филаментозных организмов и найденные экспериментальным путем:
1. Максимальный выход продукта метаболизма достигается в определенной фазе периодического процесса при условии оптимальной начальной концентрации субстрата. Повышение концентрации субстрата приводит к ускорению роста, но при этом субстрат расходуется в основном на образование биомассы, а метаболит синтезируется в очень малых концентрациях. Если же концентрация субстрата слишком низка, то образующееся незначительное количество биомассы не в состоянии синтезировать антибиотик в достаточных концентрациях даже в период максимальной скорости его биосинтеза.
Таблица 7.8. Основные фазы периодического процесса биосинтеза окситетрациклина в погруженной культуре Streptomyces rimosusа
Фаза |
Особенности |
1. Лаг-фаза |
Продолжительность около 90 мин, если объем инокулята мал; метаболическая активность не обнаруживается |
2. Рост первичного мицелия |
Продолжительность от 10 до 25 ч в зависимости от инокулята; интенсивны дыхание, синтез нуклеиновых кислот и другие метаболические процессы; концентрация пировиноградной кислоты максимальна; антибиотик не образуется |
3. Фрагментация первичного мицелия |
Продолжительность около 10 ч; рост мицелия прекращается, интенсивность дыхания и синтеза нуклеиновых кислот снижается, концентрация пировиноградной кислоты падает до очень низкого уровня |
4. Рост вторичного мицелия |
Продолжительность около 25 ч; в этой фазе масса вторичного мицелия в 2—4 раза превышает биомассу в фазе 2; гифы мицелия значительно утоньшаются; быстро возрастает скорость синтеза антибиотика, возобновляется синтез нуклеиновых кислот, а интенсивность дыхания продолжает снижаться; сахара и азот (аммиак) быстро истощаются; концентрация пировиноградной кислоты может немного повыситься. |
5. Стационарная фаза |
В этой фазе рост клеток прекращается, а метаболическая активность снижается; антибиотик еще какое-то время синтезируется, но скорость синтеза сравнительно низка |
а Luedeking R., in Biochemical and Biological Engineering, Blakebrough N. (ed.), vol. 1, p. 208, Academic Press, Inc., New York, 1967; см. также Doskacil J., Sikyta B., Kasparova J., Poskocilova D., Zajlcek J., J. Gen. Microbiol., 18, 302 (1958).
2. Образование продукта метаболизма максимально при минимальном ветвлении активно растущих гиф инокулята. С другой стороны, уменьшение степени ветвления повышает продолжительность лаг-фазы и, следовательно, длительность всего процесса. Очевидно, должна существовать некоторая оптимальная степень ветвления гиф инокулята.
3. Поскольку плесени и другие мицелиальные микроорганизмы являются аэробами, казалось бы, что максимальная интенсивность перемешивания погруженной культуры должна способствовать эффективному переносу кислорода к плесени и, таким образом, росту последней. В случае пенициллина, однако, было установлено, что максимальные выходы антибиотика достигаются при некоторой промежуточной интенсивности перемешивания. Этому факту было дано несколько объяснений. Известно, что на морфологию плесени влияют механические воздействия; возможно, что более энергичное перемешивание способствует ветвлению гиф, которое, как считается, снижает скорость биосинтеза антибиотика. Не исключено также, что существует некоторая оптимальная скорость подачи кислорода, но ввиду сложности системы подтвердить это предположение экспериментальным путем чрезвычайно трудно. (Влияние перемешивания мы рассмотрим подробнее в гл. 8.)

РИС. 7П2.1. Схема морфологически различных форм плесени С. acremonium, их превращений и синтеза цефалоспорина С (ЦСС). [Воспроизведено с разрешения из статьи: Matsumura М., lmanaka Т., Yoshida Т., Taguchi Modeling of Cephalosporin С Production and Its Application to Fed-Batch Culture, J. Ferment. Tech. (Japan), 59, 115 (1981).]
Пример 7.2. Морфологически структурированная модель кинетики биосинтеза цефалоспорина С [14]. Экспериментальное изучение биосинтеза антибиотика цефалоспорина С (ЦСС) в глубинной культуре плесени Cephalosporium acremonium показало, что в ней существуют три морфологически различные формы микроорганизмов: гифы (h), набухшие фрагменты гиф (s) и артроспоры (а). В зависимости от состава среды эти формы могут взаимопревращаться, как это схематично показано на рис. 7П2.1. На этом же рисунке отмечено, что ЦСС преимущественно продуцируется набухшими фрагментами гиф. Скорость синтеза ЦСС непосредственно связана с активностью соответствующих ферментов, которые индуцируются внутриклеточным метионином и подавляются глюкозой.
Эти сведения послужили основой для приведенной ниже структурированной модели биосинтеза ЦСС в периодической культуре:
Рост и дифференциация плесени:

Здесь
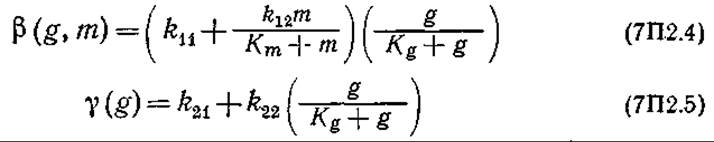
Обратите внимание на то, что в этой модели общая биомасса разделена на три морфологически различных типа, наблюдающиеся в эксперименте. Массовые концентрации глюкозы и метионина в среде обозначены символами g и m соответственно.
Модель утилизации субстрата подразумевает, что глюкоза и метионин усваиваются только морфологическими формами h и s.
Утилизация глюкозы и метионина:
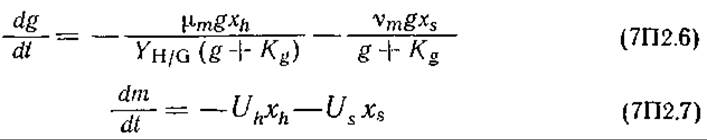
где
![]()
С помощью уравнений (7П2.1) — (7П2.8) были рассчитаны характеристики роста клеток и утилизации субстрата в периодическом процессе, причем для лучшего соответствия расчетных данных результатам эксперимента параметры модели уточняли методом симплексной оптимизации.
Поскольку в регуляции экспрессии ферментов, синтезирующих ЦСС, особую роль играет внутриклеточный метионин, то кинетическая модель химически структурирована таким образом, чтобы можно было раздельно оценить влияние концентраций метионина mih, mis и miа (во всех случаях в числе микромолей в 1 г клеток) в морфологических формах h, s и а соответственно. При этом использовались следующие уравнения материального баланса по метионину:
Внутриклеточный метионин
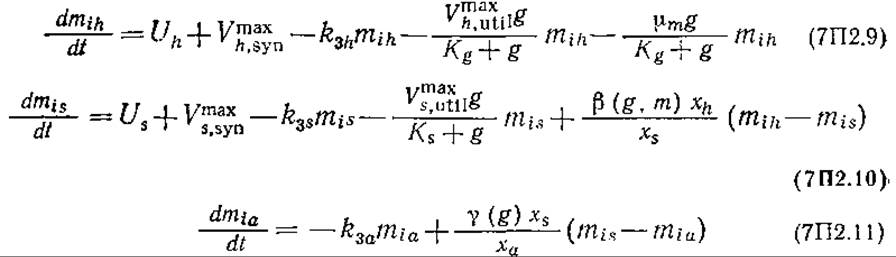
При выводе этих уравнений принималось, что скорость биосинтеза метионина обратно пропорциональна его внутриклеточной концентрации и что присутствие глюкозы в среде повышает скорость утилизации метионина в белковом синтезе. Средняя внутриклеточная концентрация метионина равна
![]()
где
![]()
Теперь модель описывает все основные стороны процесса: рост клеток, утилизацию субстрата и концентрацию внутриклеточного метионина. Сравнением найденных и расчетных значений ![]() можно определить новые параметры, появляющиеся в уравнениях (7П2.9) — (7П2.11). Эти параметры приведены во втором столбце (группа 2) табл. 7П2.1.
можно определить новые параметры, появляющиеся в уравнениях (7П2.9) — (7П2.11). Эти параметры приведены во втором столбце (группа 2) табл. 7П2.1.
В модели допускается, что скорость синтеза антибиотика зависит от активности синтезирующих ЦСС ферментов е (выраженной в мг ЦСС в час в расчете на 1 г клеток), которая описывается следующим уравнением:
Синтез ферментов
![]()
где
![]()
Параметр Q является мерой индуцируемой глюкозой катаболитнон репрессии. Подстрочный индекс (t—tI) указывает на развитие процесса в период t—tI, это отражает наличие лаг-фазы между индукцией и экспрессией гена. Наконец, скорость образования ЦСС в этой модели описывается уравнением
Образование антибиотика
![]()
Параметры уравнений (7П2.15) и (7П2.16) приведены в третьем столбце (группа 3) табл. 7П2.1.
Таблица 7П2.1. Параметры математической модели, описывающей биосинтез цефалоспорина С (ЦСС)а
Группа 1 (параметры роста клеток и утилизации субстрата) |
Группа 2 (параметры накопления эндогенного метионина) |
Группа 3 (параметры образования ферментов синтезирующих ЦСС, и биосинтеза ЦСС) |
μm = 0,069 ч-1 |
Vmaxh,syn = 8,7 мкмоль Met/(г клеток∙ч) |
VmE = 1,2 мг ЦСС/(г клеток∙ч) |
YG = 0,45 г клеток/г Glu |
k3h = 7,1 ч-1 |
Kg =12,0 мкмоль Met/r клеток |
KG = 0,05 г Glu/л |
Vmахh,util = 48,6 ч-1 |
tI= 13,0 ч |
k11 = 0,015 ч-1 |
Vmaxs,syn = 6,6 мкмоль Met/(г клеток∙ч) |
н = 0,29 |
k12 = 0,024 ч-1 |
k3s =1,4 ч-1 |
а = 0,15 |
k21 = 0,004 ч-1 |
Vmaxs,util = 2,2 ч-1 |
η = 1,6 |
k22 = 0,028 ч-1 |
K3а = 7,8 ч-1 |
n = 5,1 |
Km = 0,001 г Met/л |
kED = 0,38 ч-1 |
|
vm = 0,023 г Glu/(г клеток∙ч) |
kPD = 0,012 ч-1 |
|
Umh = 0,0012 г Met/(г клеток∙ч) |
||
Uma = 0,0098 г Met/(г клеток∙ч) |
||
kD = 0,014 ч-1 |
* Воспроизведено с разрешения из статьи: Matsumura М., Imanaka Т., Yoshida Т., Taguchi И., Modeling of Cephalosporin C Production and Its Application to Fed-Batch Culture, J. Ferment. Tech. (Japan), 59, 115 (1981).
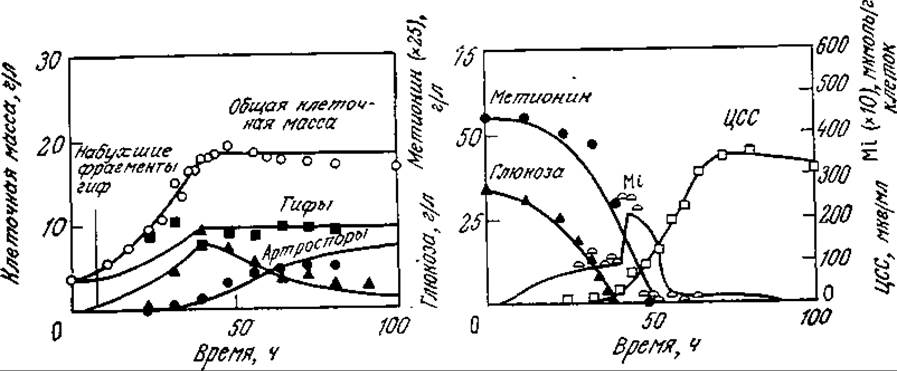
РИС. 7П2.2. Расчетные (сплошные кривые) и экспериментальные (точки) данные, отражающие развитие процесса биосинтеза цефалоспорина С (ЦСС) в периодической культуре С. acremonium (символом Mi обозначены данные для внутриклеточного метионина). [Воспроизведено с разрешения из статьи: Matsumura М., Imanaka Т., Yoshida Т., Taguchi Н., Modeling of Cephalosporin С Production and Its Application to Fed-Batch Culture, J. Ferment. Tech. (Japan), 59, 115 (1981).]
На рис. 7П2.2 изображены экспериментальные (точки) и расчетные (кривые) данные, отражающие клеточный рост, утилизацию субстратов и образование антибиотика в периодическом процессе. Обратите внимание на то, что концентрация набухших фрагментов гиф сначала возрастает, а затем снижается, а артроспоры образуются в основном на поздних стадиях процесса. Модель очень хорошо отражает своеобразный характер изменения во времени концентрации внутриклеточного метионина. В то же время разработка и использование такой сложной модели с параметрами, определение которых очень трудоемко, оправданны только в том случае, если эта модель применима для изучения культивирования в достаточно широком диапазоне условий. Описанная модель вполне отвечает этому требованию. Так, на рис. 7П2.3 приведены рассчитанные с помощью этой модели зависимости количества синтезируемого ЦСС (в единице объема) а) от начальной концентрации глюкозы и б) от времени введения метионина в культуру. В полном соответствии с экспериментальными данными на первой кривой имеется четко выраженный максимум; вторая кривая свидетельствует о целесообразности введения метионина на ранних стадиях процесса, что также подтверждается экспериментом. Эта модель помогла также предсказать, что в периодическом процессе одновременное введение метионина и глюкозы способствует значительному повышению выхода ЦСС, в то время как раздельное (во времени) введение этих питательных веществ менее эффективно. Последующие эксперименты подтвердили и эти расчетные данные.
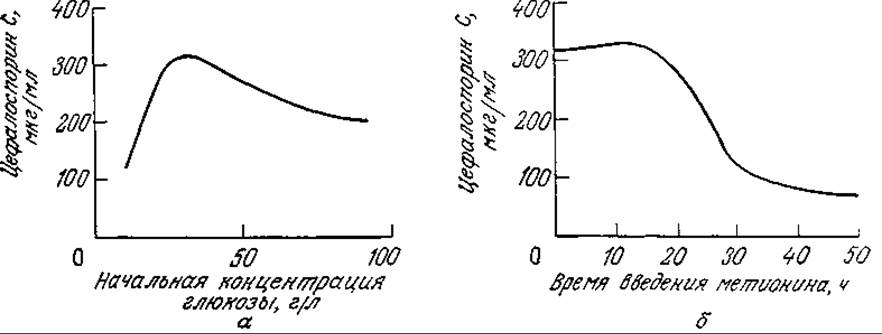
РИС. 7П2.3. Моделирование влияния начальной концентрации глюкозы (а) и времени введения метионина (б) на синтез ЦСС [Воспроизведено с разрешения из работы: Matsumura М., Imanaka Т., Yoshida Т., Taguchi Н., Modeling of Cephalosporin С Production and Its Application to Fed-Batch Culture, J Ferment. Tech. (Japan), 59, 115 (1981).]