Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Процессы переноса в биотехнологических системах
Массообмен между газовой и жидкой фазами в клеточных системах
Основные положения теории массообмена
Растворимость кислорода в водных средах при давлении воздуха 1 атм и комнатной температуре равна приблизительно 10 миллионным долям (млн-1) (табл. 8.1). Популяция дрожжевых клеток в период активного дыхания может потреблять кислород со скоростью около 0,3 г О2 в час (в расчете на 1 г сухого клеточного вещества). Максимальную скорость утилизации кислорода при плотности популяции 109 клеток/мл можно оценить, допустив, что объем клетки составляет 10-10 мл, из которых 80% составляет вода. Тогда абсолютная потребность в кислороде составит
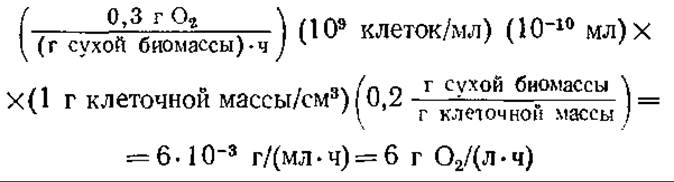

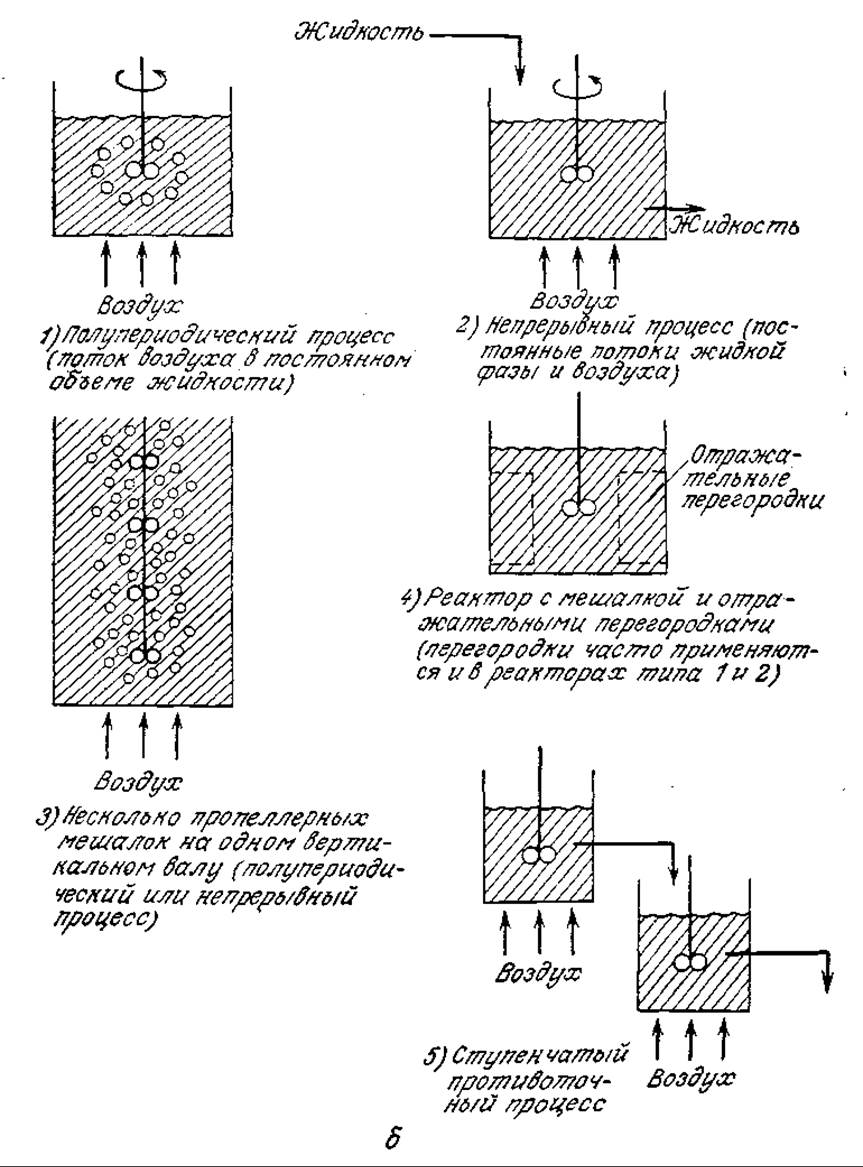
РИС. 8.2. Различные способы контакта между газовой и жидкой фазами: а — свободно поднимающиеся пузырьки газов, свободно опускающиеся твердые частицы и капли жидкости; б — механическое перемешивание.
Следовательно, в период активного дыхания популяция клеток потребляет кислород со скоростью, которая соответствует приблизительно 750-кратному насыщению кислородом в течение часа. Поскольку запасы растворенного кислорода довольно скудны, то популяция жизнеспособных клеток может существовать только при условии непрерывного введения кислорода в жидкую среду. Эта задача далеко не проста, так как низкая растворимость кислорода является причиной малой разности его концентраций, которая представляет собой главную движущую силу переноса кислорода из одной фазы в другую.
В случае ограниченно растворимых веществ, например кислорода и углеводородов в водных средах, зависимость между двумя равновесными концентрациями на границе раздела фаз сgi (со стороны газовой фазы) и сli (со стороны жидкой фазы) обычно можно выразить уравнением, отражающим закон линейного распределения, например закон Генри:
Mcli = сgi (8.1)
Указанное уравнение справедливо, если скорость обмена растворенным веществом через границу раздела фаз значительно выше общей скорости массообмена; обычно это условие удовлетворяется, поскольку при давлении воздуха 1 атм и 25 °С скорость столкновений молекул О2 с поверхностью равна приблизительно 1024 на квадратный сантиметр в секунду, что намного превышает общую потребность в кислороде в приведенном выше примере типичного микробиологического процесса.
В стационарном состоянии скорость переноса кислорода к поверхности раздела фаз газ — жидкость равна скорости его транспорта через пленку со стороны жидкой фазы (рис. 8.1). Если cg и ci — концентрации кислорода в газовой и жидкой фазах соответственно, то мы можем записать равенство двух скоростей переноса:

Здесь klи kg— коэффициенты массоотдачи в жидкой и газовой фазах соответственно.
Поскольку при изучении массообмена непосредственно измерить концентрации на границе раздела фаз не удается, то количественно массообмен обычно выражают через общий коэффициент массопередачи Kl и общую движущую силу (разность концентраций) cl* - cl, где cl* — концентрация растворен-
ного вещества в жидкой фазе, находящейся в равновесии с газовой фазой:
![]()
С помощью этих параметров можно выразить плотность потока растворенного вещества:
Плотность потока = Kl(cl*- сl) (8.4)
Из уравнений (8.1) — (8.4) следует хорошо известное выражение, связывающее общий коэффициент массопередачи Kl с физическими параметрами двухпленочной модели kg, klи М:
![]()
В случае ограниченно растворимых веществ М намного больше единицы. Кроме того, kgобычно намного больше kl. Отсюда следует, что Klприблизительно равно kl, и, таким образом, практически все сопротивление массопередаче сосредоточено на стороне пленки, обращенной к жидкой фазе.
Скорость переноса кислорода в расчете на единицу объема реактора QO2определяется как

Здесь а' = А/V — отношение площади поверхности раздела фаз газ — жидкость к объему жидкой фазы; в уравнении (8.6) принято только что рассмотренное приближение Kl ≈ kl.Поскольку в этой главе основное внимание уделяется процессам аэрации, то в дальнейшем мы будем рассматривать главным образом перенос кислорода и поэтому в качестве коэффициента массопередачи вместо Kl будем применять kl. Входящим в некоторые уравнения символом а обозначают площадь поверхности раздела фаз газ — жидкость в расчете на единицу объема биологического реактора (т. е. на единицу объема дисперсной системы газ — жидкость). Находящийся над жидкой фазой газ не учитывается.
Запомните, что QO2 представляет собой параметр, отражающий локальную объемную скорость поглощения O2; средняя объемная скорость утилизации кислорода (выраженная в молях за единицу времени в единице объема) ![]() во всем объеме жидкой фазы V определяется как
во всем объеме жидкой фазы V определяется как

В общем случае ![]() равна QO2 тогда и только тогда, когда в любой точке объема реактора одинаковы и гидродинамические условия, и отношение площади поверхности раздела фаз к объему, и концентрация кислорода.
равна QO2 тогда и только тогда, когда в любой точке объема реактора одинаковы и гидродинамические условия, и отношение площади поверхности раздела фаз к объему, и концентрация кислорода.
Наблюдаемая средняя скорость массообмена определяется целым рядом явлений и факторов, в том числе потребляемой реактором мощностью (в расчете на единицу объема), реологией жидкой фазы и дисперсной системы, характеристиками барботирующего устройства, общей структурой течений в реакторе. На рис. 8.3 изображены многочисленные связи между наблюдаемой средней скоростью переноса и обусловливающими этот перенос явлениями. Поскольку мы обычно не располагаем важнейшими фундаментальными данными о скоростях коалесценции и повторного диспергирования, о распределении газовых пузырьков по размерам и времени их пребывания в реакторе, то, как правило, мы вынуждены разрабатывать необходимые уравнения на основе соответствующих усредненных величин: среднем размере пузырьков, газосодержании (объемной доли газа, диспергированного в жидкости), среднем времени пребывания пузырьков газа и жидкой фазы в реакторе и т. д.
Приведенные в табл. 8.1 данные говорят о том, что сi* зависит от температуры и состава среды. Зависимость от состава среды усложняется, если растворенный газ может реагировать с жидкой фазой. Такая ситуация типична, например, для диоксида углерода, который может существовать в жидкой фазе в любой из четырех форм: СО2, Н2СО3, НСО3- и СO32-. Соответствующие константы равновесия при 25°С:

показывают, что общая концентрация сT растворенного в виде СO2 углерода в очень сильной степени зависит от pH:

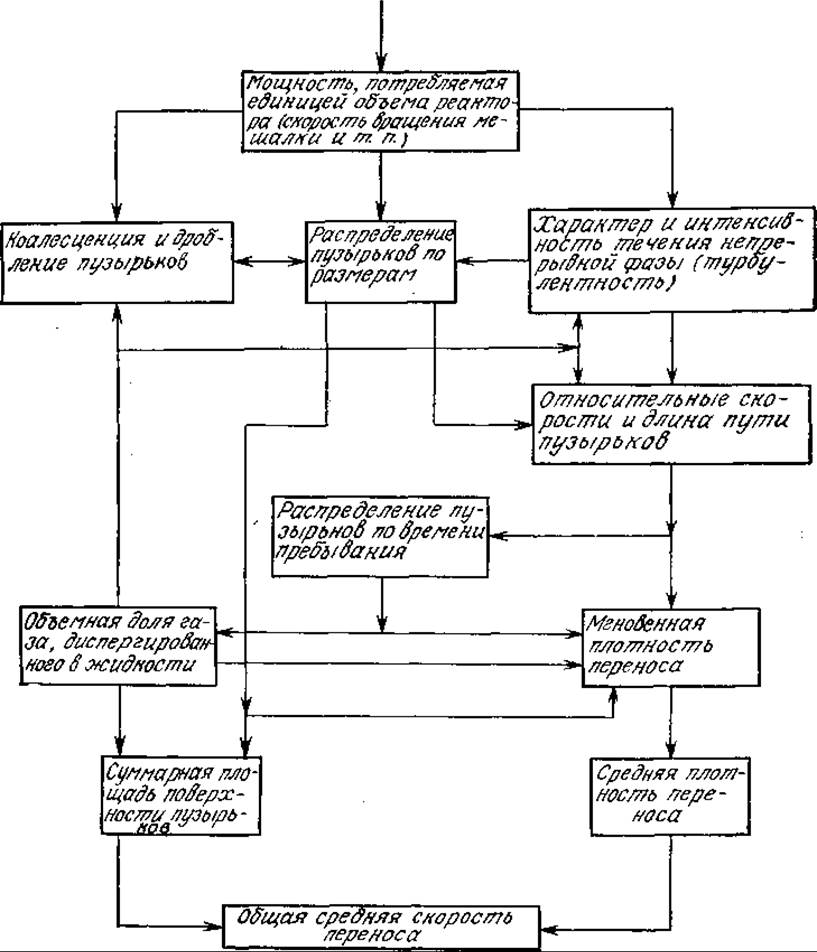
РИС. 8.3. Зависимость между интенсивностью перемешивания и скоростью переноса газа. [Воспроизведено с разрешения из работы: Resnick W., Gal-Or В., Adv. Chem. Eng., 7, 295 (1968).]
Эта зависимость в графической форме представлена на рис. 8.4; нетрудно видеть, что при pH < 5 практически весь углерод находится в виде растворенного молекулярного СO2) бикарбонат доминирует в диапазоне 7 < рН < 9, а карбонат — при рН > 11. Через границу раздела газ — жидкость переносится только растворенный СO2; скорость его переноса может быть описана уравнением (8.2).
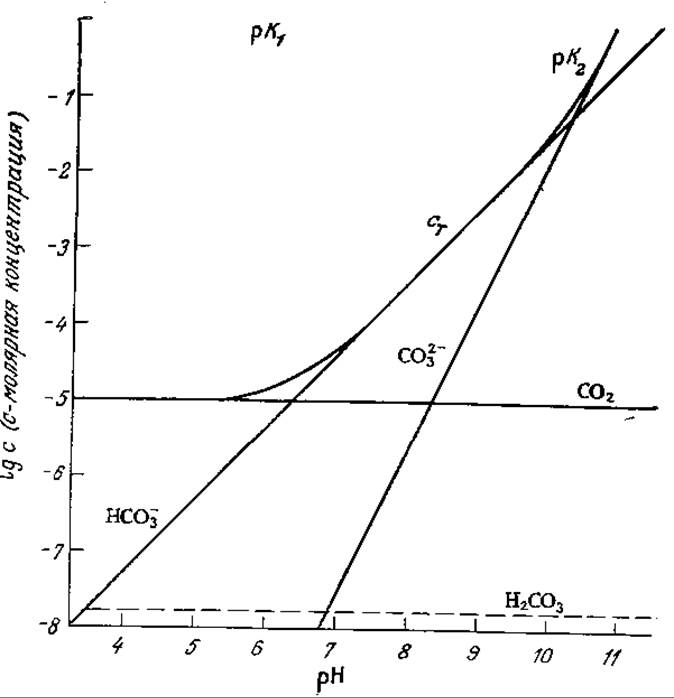
РИС. 8.4. Равновесные концентрации СО2, НСО3-, СО32- и Н2СО3 в растворе (сT — общая концентрация СO2 во всех четырех формах; рCO2 = 10-3,5 атм (что соответствует парциальному давлению СO2 в воздухе); pH доводили до заданного значения сильной кислотой или сильным основанием). (Из работы: Stumm W., Morgan J. J., Aquatic Chemistry, p. 127, John Wiley and Sons, N.Y., 1970.)
В нейтральной или основной среде большую роль играют как эффекты массообмена, так и химические процессы. Так, скорость обратимой реакции (8.11) очень высока;

Напротив, реакция (8.13) протекает значительно медленнее (k1 = 20 с-1; k-1 = 0,03 с-1 при 25°С):
![]()
Следовательно, в зависимости от условий стадией, определяющей скорость перехода СO2 в газовую фазу, может быть или химическая реакция [уравнение (8.13)], или физический процесс [СO2(раствор)→СO2(газ)].