Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Химические основы жизни
Аминокислоты и белки
Белковые аминокислоты и полипептиды
Мономерными звеньями полипептидов являются а-аминокислоты общей формулы

Таким образом, аминокислоты различаются природой группы R, связанной с а-углеродным атомом (соседним с карбоксильной группой). Поскольку в общем случае все заместители у этого атома углерода различны (за исключением глицина, у которого R = H), этот углеродный атом асимметричен.
Многие биологически важные органические соединения, в том числе сахара и аминокислоты, оптически активны, т. е. обладают по меньшей мере одним асимметрическим атомом углерода и поэтому могут существовать в двух формах, как это показано ниже на примере аминокислот:
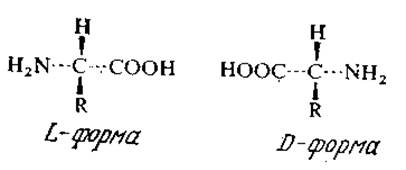
Раствор одного изомера вращает плоскость поляризации света вправо (правая или d-форма) или влево (левая или l-форма). Оптическая изомерия представляет собой чрезвычайно важное явление, поскольку при отсутствии ферментов, превращающих один изомер в другой, живые организмы могут усваивать только один из изомеров. Ферменты, как правило, также катализируют превращения только одного из оптических изомеров. Это свойство ферментов используется в промышленности для разделения смесей рацемических ациламинокислот, когда гидролизу подвергается только один из изомеров, так что в продуктах реакции содержатся два существенно различающихся и, следовательно, легче разделяемых вещества. Подробнее этот процесс мы рассмотрим в гл. 4. Поскольку метод прямого физического разделения оптических изомеров дорог и неэффективен, подобные микробиологические и ферментативные (а также химические) способы разделения могут оказаться гораздо более выгодными.
Интересно, что в подавляющем большинстве белков найдены только L-изомеры аминокислот. D -Аминокислоты в природных источниках встречаются редко; они были обнаружены в клеточных стенках некоторых микроорганизмов и в ряде антибиотиков.
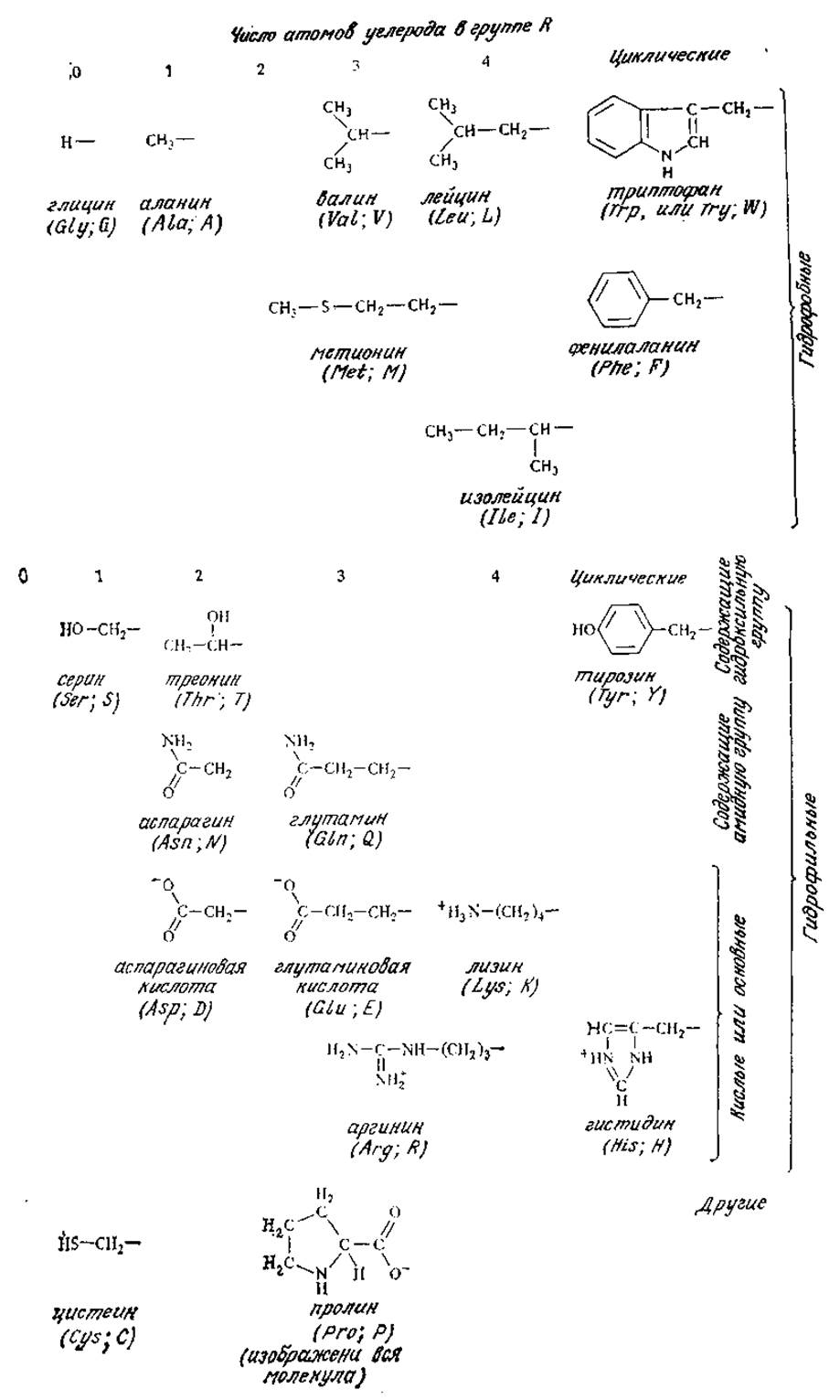
РИС. 2.15. 20 белковых аминокислот.
Кислотная (—СООН) и основная (—NH2) группировки аминокислот в водных растворах могут подвергаться ионизации.
Таблица 2.7. Величины рK (—lg К) концевых аминных и карбоксильных групп, а также группировок в боковых цепях Ra
Аминокислота |
pK1 а-СООН |
рK2 a-NHs |
pKR группа R |
Глицин |
2,34 |
9,6 |
|
Аланин |
2,34 |
9,69 |
|
Лейцин |
2,36 |
9,60 |
|
Серин |
2,21 |
9,15 |
|
Треонин |
2,63 |
10,43 |
|
Глутамин |
2,17 |
9,13 |
|
Аспарагиновая кислота |
2,09 |
9,82 |
3,86 |
Глутаминовая кислота |
2,19 |
9,67 |
4,25 |
Гистидин |
1,82 |
9,17 |
6,0 |
Цистеин |
1,71 |
10,78 |
8,33 |
Тирозин |
2,20 |
9,11 |
10,07 |
Лизин |
2,18 |
8,95 |
10,53 |
Аргинин |
2,17 |
9,04 |
12,48 |
а Воспроизведено из работы: Lehninger A. L., Biochemistry, 2d ed., Table 4-2, Worth Publishers, Inc., New York, 1975; есть перевод более раннего издания: Ленинджер А., Биохимия.— М.: Мир, 1976.
Аминокислота несет положительный заряд (катион) при низких значениях pH и отрицательный заряд (анион) при высоких pH. При некотором промежуточном значении pH аминокислота представляет собой биполярный ион (цвиттер-ион) с нулевым результирующим зарядом. Эта величина pH называется изоэлектрической точкой и определяется природой заместителя R (табл. 2.7). В изоэлектрической точке аминокислота под влиянием электрического поля не способна мигрировать ни к аноду, ни к катоду, и, кроме того, ее растворимость минимальна. На этих свойствах аминокислот основаны такие методы разделения смесей, как ионный обмен, электродиализ и электрофорез (гл. 11).
На рис. 2.15 приведены формулы 20 аминокислот, обычно встречающихся в белках. Помимо характерных для всех аминокислот карбоксильной и аминной (кроме пролина) групп некоторые из них содержат ионизирующиеся группы и в заместителе R. Для одних аминокислот типичны неполярные гидрофобные группы R, в других заместители R обладают гидрофильными свойствами. Как мы увидим в следующем разделе, природа этих боковых цепей важна с точки зрения как функции белка, так и его структуры.
Простые белки представляют собой полимеры, образующиеся путем конденсации одних только аминокислот. Реакция конденсации, лежащая в основе синтеза белков, осуществляется между аминогруппой одной аминокислоты и карбоксильной группой другой и приводит к образованию пептидной связи:
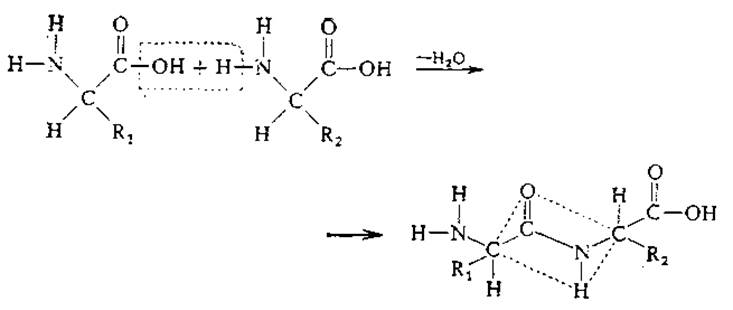
Пептидная связь частично имеет характер двойной связи, поэтому шесть атомов (на схеме они лежат внутри прямоугольника, ограниченного штриховыми линиями) расположены в одной плоскости. Запомните, что каждая аминокислота соединяется с последующей пептидной связью, поэтому вся белковая цепь может строиться с помощью одного фермента; в то же время порядок расположения аминокислот определяется другими механизмами (гл. 6).
Название образовавшегося в результате возникновения пептидной связи фрагмента (аминокислотного остатка) производят от названия соответствующей аминокислоты путем добавления окончания ил; например, остатками глицина и аланина являются глицил и аланил соответственно. Перечисление остатков в олигопептиде начинают с конца, несущего свободную аминогруппу.
Полипептиды представляют собой сравнительно короткие цепи, построенные из аминокислотных остатков (рис. 2.16). Понятно, что по мере увеличения длины цепи физико-химические свойства полимера все в большей степени будут определяться природой групп R аминокислотных остатков, а роль концевых аминной и карбоксильной групп будет все менее и менее важной. Полипептидами принято называть относительно небольшие полиаминокислотные цепи. Многие полипептиды имеют большое биологическое значение; в частности, к числу полипептидов относится ряд гормонов, например инсулин, гормон роста и соматостатин.
Большие полиаминокислотные цепи называют белками; граница между полипептидами и белками строго не определена; обычно считают, что она лежит в пределах 50—100 аминокислотных остатков. Поскольку средняя молекулярная масса аминокислотного остатка составляет около 120, то молекулярная масса белков должна превышать 10 000; известны отдельные белки с молекулярной массой более миллиона.
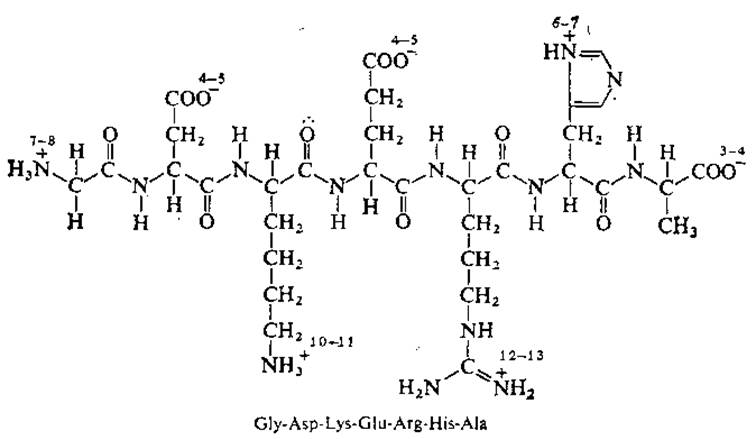
РИС. 2.16. Гипотетический полипептид с различными ионизированными группами. Запомните, что перечисление аминокислотных остатков начинают с N-конца последовательности. Числа возле каждой ионизированной группы указывают соответствующие величины рК.
Аминокислотный состав какого-либо белка или смеси белков может быть определен с помощью автоматического аминокислотного анализатора. Полный гидролиз белка осуществляют нагреванием в 6 н. НСl в течение 10—24 ч при 100—120°С. При этом с количественным выходом в виде гидрохлоридов образуются все аминокислоты (за исключением триптофана, аспарагина и глутамина); их разделяют и определяют количественно. Для определения содержания триптофана можно применить щелочной гидролиз. Результаты такого изучения белков из кишечной палочки Е. coli приведены в табл. 2.8. Эти и ряд других данных показывают, что не все 20 аминокислот (перечисленных на рис. 2.15) входят в состав любого белка. Ни в одном известном белке аминокислоты не содержатся в эквимолярных количествах. Для любого конкретного белка, однако, относительные количества различных аминокислот представляют собой строго определенные величины.
Аминокислоты не являются единственными компонентами белков. В состав многих сложных белков входят другие органические или даже неорганические группировки, называемые простетическими группами. Если белок построен только из остатков аминокислот, его иногда, как уже упоминалось выше, называют простым белком. Широко известный пример сложных белков представляет гемоглобин — переносчик кислорода в красных кровяных тельцах, — в состав молекулы которого входят четыре группировки гема, представляющие собой железосодержащие металлоорганические комплексы. В близком по структуре, но меньшем по молекулярной массе миоглобине имеется один гем. Каждая молекула фермента оксидазы L-аминокислот, катализирующей дезаминирование ряда L-аминокислот, содержит два остатка флавинадениндинуклеотида (FAD) (см. рис. 2.9). Как указывалось выше, простетической группой рибосом можно считать РНК.
Таблица 2.8. Относительные количества различных аминокислот в белках Е. coliа
Аминокислота |
Относительное содержание (содержание аланина принято равным 100) |
Аминокислота |
Относительное содержание (содержание аланина принято равным 100) |
Аланин |
100 |
Треонин |
35 |
Глутаминовая |
Пролин |
35 |
|
кислота и глутамин |
Изолейцин |
34 |
|
83 |
Метионин |
29 |
|
Аспарагиновая |
Фенилаланин |
25 |
|
кислота и аспарагин |
Тирозин |
17 |
|
76 |
Цистеин |
14 |
|
Лейцин |
60 |
Триптофан |
8 |
Глицин |
60 |
Гистидин |
5 |
Лизин |
54 |
||
Серин |
46 |
||
Валин |
46 |
||
Аргинин |
41 |
а Воспроизведено из работы: Lehninger A. L., Biochemistry, 2d ed.. Table 5-3, Worth Publishers, Inc., New York, 1975; есть перевод более раннего издания: Ленинджер 4., Биохимия. — М.: Мир, 1976.