Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Химические основы жизни
Аминокислоты и белки
Первичная структура
Под первичной структурой белка подразумевают свойственную ему последовательность аминокислотных остатков. Первым белком, у которого удалось выяснить полную первичную структуру, был инсулин (Сэнджер и сотрудники, 1955 г.). Теперь можно считать доказанным, что для любого белка характерен не только определенный аминокислотный состав, но и специфическая аминокислотная последовательность. Как мы увидим ниже (разд. 6.1), эта последовательность определяется нуклеотидной последовательностью ДНК.
Детальное изучение методов определения аминокислотной последовательности не входит в цели настоящей книги, поэтому мы ограничимся только самыми общими сведениями. Существует много методов расщепления белка на различные полипептидные фрагменты. Известны, например, ферменты, способные расщеплять связи между строго определенными аминокислотными остатками. Определить аминокислотную последовательность образующихся относительно коротких полипептидных цепей можно далее с помощью методов, разработанных Сэнджером и другими исследователями. Известные частично перекрывающиеся последовательности фрагментов белка затем комбинируют таким образом, чтобы в конце концов получить полную картину, характеризующую аминокислотную последовательность всего белка. На автоматических приборах для определения аминокислотной последовательности в белках (секвенаторах) с вращающимся реакционным сосудом можно последовательно определить до 100 аминокислотных остатков в цепи; для определения одного остатка требуется около 2 ч. Предложенный недавно газофазный метод позволил значительно снизить количество белка, необходимое для определения его аминокислотной последовательности. Например, для выяснения полной первичной структуры полипептида, состоящего из 50 аминокислотных остатков, на газофазном секвенаторе требуется 50—100 пикомолей вещества, а на анализаторе с вращающимся сосудом 1—5 наномолей вещества. Как мы увидим позднее в гл. 6, аминокислотная последовательность белка может быть выяснена и косвенным путем на основе результатов экспериментального определения нуклеотидной последовательности соответствующего гена.
В настоящее время известна аминокислотная последовательность многих полипептидов и белков. Пока что в белках не было обнаружено повторяющихся участков с идентичными последовательностями, хотя некоторые данные позволяют предположить, что подобная картина возможна для ряда фибриллярных белков. В качестве примера на рис. 2.17 приведена аминокислотная последовательность фермента из яичного белка, называемого лизоцимом. Как мы уже неоднократно отмечали, нумерация аминокислотных остатков начинается с N-концевого, в данном случае лизина, и завершается С-концевым остатком, которым в этом ферменте является лейцин.
Боковые цепи аминокислотных остатков взаимодействуют друг с другом и с непосредственным окружением белка, тем самым определяя геометрическую конфигурацию белковой молекулы. Складывание полипептидной цепи в строго определенную трехмерную структуру приводит к белковой молекуле сложной, запутанной формы типа изображенной на рис. 2.17,6 для случая лизоцима. Такое сложное пространственное строение белка детерминируется в первую очередь его первичной структурой.
Значимость первичной структуры белков становится особенно очевидной, если учесть, что она в свою очередь определяется клеточной системой кодирования (разд. 6.1). Таким образом, аминокислотная последовательность белков является как бы тем звеном, которое соединяет главный командный центр клетки, ДНК, со сложными, высокоспецифичными молекулами белков, осуществляющими и регулирующими разнообразные биохимические процессы, необходимые для роста и выживания клетки.
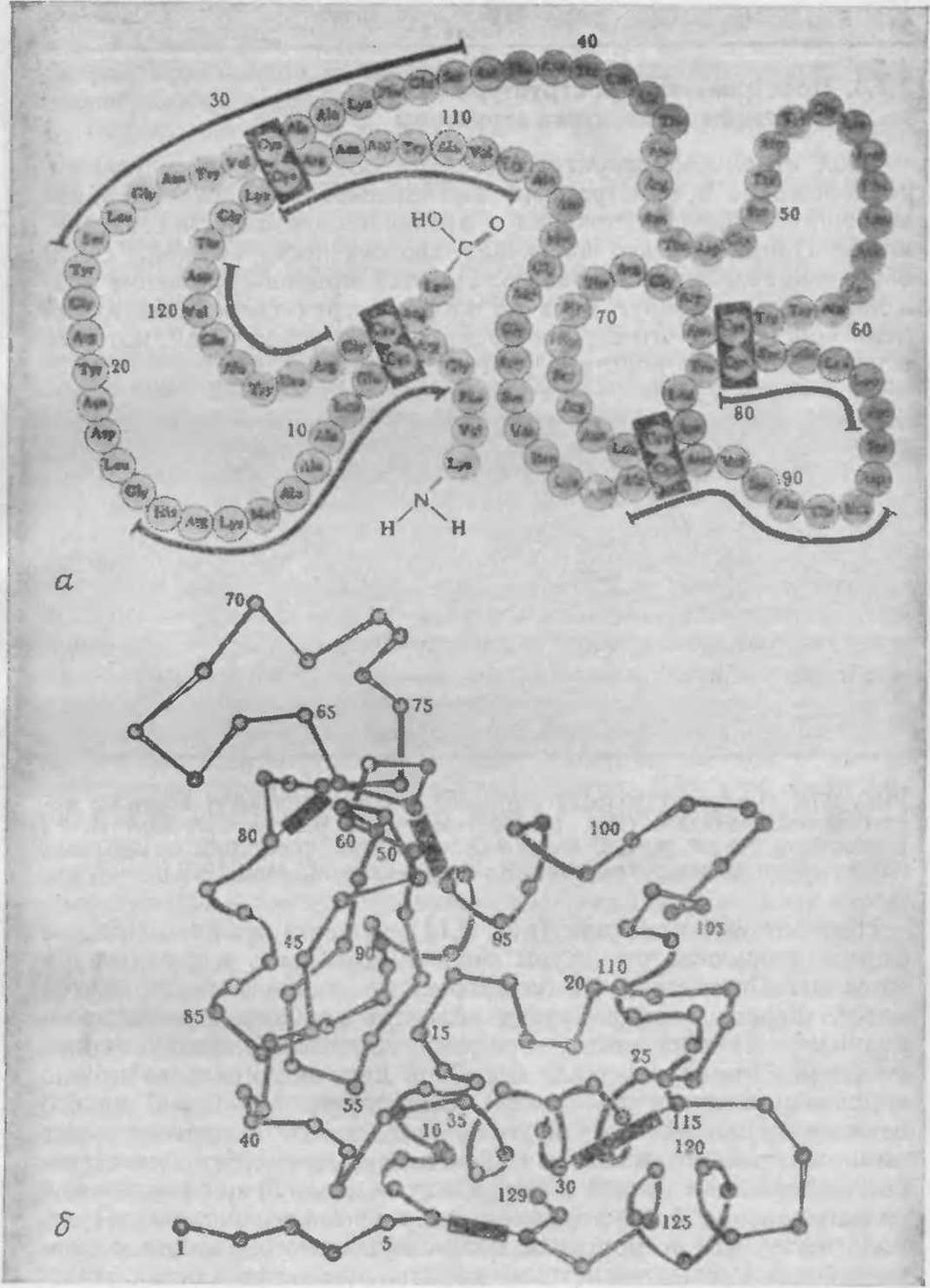
РИС. 2.17. а — аминокислотная последовательность или первичная структура фермента яичного белка лизоцима; б — трехмерная (третичная) структура молекулы кристаллического лизоцима. [Воспроизведено с разрешения автора и издательства из работы: Blake С. С. F., Structure of Hen Egg-White Lysozyme; Nature, 206, 757 (1965).]