Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Кинетика катализируемых ферментами реакций
Регуляция ферментативной активности
Механизмы обратимой регуляции ферментативной активности
Многие из известных конкурентных ингибиторов по своей химической природе близки обычным субстратам; такие ингибиторы называют субстратными аналогами. Полагают, что подобные ингибиторы имеют пространственную структуру типа ключа, который может входить в «замочную скважину» активного центра фермента, однако «ключ» не вполне подходит к данному «замку» и реакция не идет. Рассмотрим, например ингибирование процесса дегидрирования янтарной кислоты малоновой кислотой:

В данном случае малоновая кислота может образовывать комплекс с сукцинилдегидрогеназой, но на этом процесс останавливается.
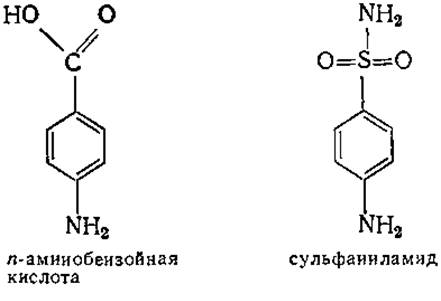
Конкурентное ингибирование лежит в основе механизма действия одного из лекарственных сульфамидных препаратов — сульфаниламида (стрептоцида). Структура последнего очень близка структуре n-аминобензойной кислоты — важного витамина многих бактерий. Сульфаниламид ингибирует фермент, участвующий в превращении n-аминобензойной кислоты в фолиевую кислоту, тем самым блокируя биохимический аппарат бактерии, что приводит к ее гибели.
При другом механизме, называемом аллостерической регуляцией, поведение фермент-субстратной системы типично для неконкурентного ингибирования. Считается, что механизм аллостерической регуляции вообще играет доминирующую роль в неконкурентном ингибировании и активации. Название аллостерический (имеющий другую форму) было дано этому механизму сначала на том основании, что по своему строению многие эффекторы ферментативной активности существенно отличаются от субстратов. Отсюда был сделан вывод, что регуляторное действие таких эффекторов основано на их связывании со специфическим регуляторным центром фермента, отличным от активного центра, в котором осуществляется катализ превращений субстрата. Соответственно ферменты, обладающие центрами регуляции и катализа, были названы аллостерическими ферментами.
Аллостерическая регуляция может как ингибировать (снижать), так и активировать (повышать) каталитическую способность фермента. Процесс аллостерической регуляции схематически изображен на рис. 3.20. Обратите внимание на то, что фермент здесь изображен в виде двух субъединиц; известно, что многие аллостерические ферменты и на самом деле являются олигомерными белками.
Наиболее убедительным доказательством справедливости аллостерической теории ферментативной активности явилось экспериментальное изучение аспартилтранскарбамоилазы (АТС-азы). После разделения фермента на две субъединицы выяснилось, что на обладающую каталитической активностью большую субъединицу ингибитор интактного фермента СТР (цитидинтрифосфат) не влияет. Напротив, меньшая субъединица каталитически не активна, но связывает СТР.
В отсутствие экспериментальных доказательств типа приведенных выше для АТС-азы нельзя быть уверенным в том, что эффектор не связывается активным центром фермента. С кинетической точки зрения, однако, представляет интерес только влияние эффектора на ряд параметров, в том числе на сродство субстрата к ферменту, концентрацию несвязанного фермента и (или) скорость распада комплекса. В следующем разделе мы попытаемся найти математические выражения, характеризующие эти эффекты количественно.

РИС. 3.20. В симметричной модели аллостерической регуляции ферментативной активности связывание активатора А и субстрата S приводит к каталитически активной R-форме фермента, а связывание ингибитора изменяет конформацию всех субъединиц в олигомерном белке таким образом, что молекула белка принимает неактивную Т-форму. (Из работы: Лёви А., Сикевиц Ф., Структура и функция клетки. — М.: Мир, 1971, с. 306.]