Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Применение реакций, катализируемых ферментами
Технологические процессы с участием иммобилизованных ферментов
Утилизация и регенерация кофакторов
Наряду с применением в аффинной хроматографии кофакторы представляют интерес и с точки зрения их способности обеспечивать активность ферментов. В отсутствие кофакторов только два класса ферментов из шести способны проявлять каталитическую активность. Очевидно, что для широкомасштабного промышленного использования ферментов четырех других классов необходимо располагать эффективными способами получения, разделения и выделения достаточных количеств органических кофакторов. Более того, для эффективной утилизации и регенерации коферментов необходимы специальные реакторы и каталитические установки. К настоящему времени многие из перечисленных задач еще не решены, хотя в этой области и проводятся интенсивные исследования, направленные на реализацию больших потенциальных практических и научных возможностей тщательно отработанной технологии кофакторов. Здесь мы вкратце рассмотрим только некоторые из проблем, возникающих при проектировании фермент-коферментных реакторов; более подробные сведения по вопросам применения кофакторов можно найти в соответствующей литературе, приведенной в конце главы.
Если фермент и кофермент помещены в полые волокна с полупроницаемыми стенками, через которые могут проникать и субстрат, и продукты реакции, то ферментативную реакцию можно провести без потери фермента и кофермента. На рис. 4.15 приведена схема лабораторного реактора, основанного на таком принципе. Очевидно, что при достаточной активности и стабильности каталитической системы подобная схема может быть взята за основу и при проектировании более крупномасштабного процесса. В таком реакторе, в частности, изучали протекающую в присутствии NAD двустадийную реакцию окисления этанола:
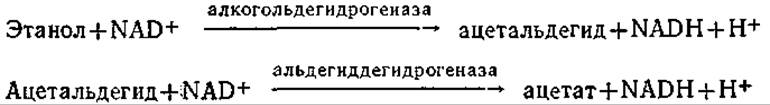
Очевидно, что этот процесс может протекать непрерывно только при условии постоянной регенерации NAD+ путем окисления NADH; для этой цели в реакционную смесь, находящуюся внутри полых волокон, добавляли фермент диафоразу (из сердца свиньи). Диафораза катализирует окисление NADH кислородом, причем в процессе регенерации кофактора NAD+ образуется также Н2О2. Поскольку пероксид водорода инактивирует многие ферменты, ферментную систему дополняют еще ферментом — каталазой. Понятно, что такой подход может быть распространен и на другие ферментативные реакции. В то же время если молекулярная масса субстрата близка молекулярной массе кофермента (коферментов) и ферментов, то потребуется некоторая модификация схемы. (Объясните, почему.) Если же и молекулы кофермента относительно невелики, то устранить их потерю за счет ультрафильтрации можно, например, путем ковалентного связывания с растворимым полимером типа полиэтиленгликоля, декстрана или полилизина.
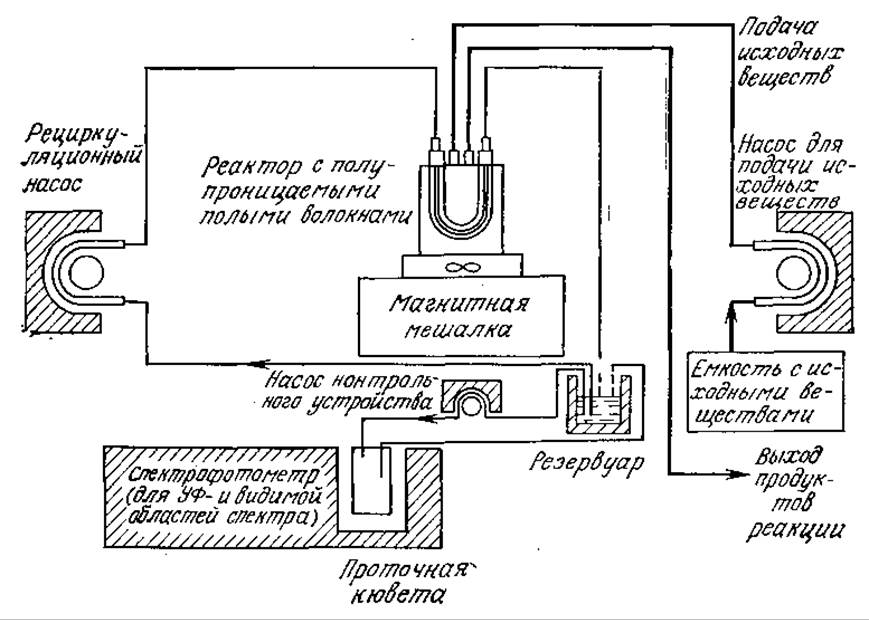
РИС. 4.15. Схема лабораторного реактора с полыми полупроницаемыми волокнами, в котором осуществляется непрерывный процесс, катализируемый фермент-коферментной системой.
Теперь рассмотрим такие катализируемые фермент-коферментной системой процессы, в которых ферменты и (или) соответствующие коферменты связаны с нерастворимыми носителями. Любой катализатор такого типа должен обеспечивать, во-первых, физический контакт фермента с коферментом и, во-вторых, возможность регенерации кофактора. Можно наметить по меньшей мере три различных подхода к решению такого типа задач.
1. Можно иммобилизовать кофермент, а фермент и все необходимые для регенерации вещества вводить в растворенном виде. Тогда в реакционной смеси на выходе из реактора будут содержаться все реагенты, за исключением кофермента.
2. Можно иммобилизовать фермент, а кофермент оставить в растворе; следовательно, он перейдет и в продукты реакции. Другие ферменты и субстраты, необходимые для регенерации кофермента, можно вводить в реактор в виде раствора. В альтернативном варианте процесс регенерации может осуществляться в отдельном реакторе, в котором также могут использоваться иммобилизованные ферменты.
3. Можно, наконец, соединить молекулы фермента и кофермента длинной гибкой цепью и затем иммобилизовать этот комплекс фермент — кофермент («кофермент на привязи»).
Первый и второй подходы были реализованы в лабораторных экспериментах, а возможности третьего подхода пока еще только изучаются. При переходе к промышленному производству выбор между первым и вторым подходами будет определяться целым рядом технологических и экономических факторов, из которых важнейшими являются легкость осуществления, эффективность и стоимость процессов выделения и повторного использования фермента, кофермента и (или) системы регенерации последнего. Если, например, повторное использование ни одного из этих компонентов реакционной смеси не представляется возможным, то первый подход может оказаться более целесообразным, поскольку большинство коферментов намного дороже любого другого компонента смеси.
Высокая эффективность процессов утилизации и регенерации кофакторов в живых клетках подсказывает принцип альтернативного подхода к разработке процессов, катализируемых фермент-коферментными системами. Этот подход заключается в иммобилизации живых клеток и последующем использовании природных систем синтеза и регенерации кофакторов. Практическая реализация этого внешне заманчивого подхода, однако, пока что была не слишком успешной. В частности, до сих пор не решены проблемы обеспечения стабильности иммобилизованных клеток и введения необходимых фермент-коферментных систем в легкоиммобилизуемые, активные клетки. Последняя проблема в принципе может быть решена методами генетической инженерии, позволяющими внедрить в геном подходящей клетки ген, синтезирующий необходимый фермент; тогда клетка будет выполнять в основном функции хранилища кофактора и соответствующей системы его регенерации. Другое принципиальное затруднение, возникающее при работе с иммобилизованными клетками, связано с регуляцией транспорта через оболочку клетки. Точно так же, как и в случае фермент-коферментной каталитической системы, иммобилизованной полупроницаемой мембраной, живая клетка должна пропускать внутрь клетки субстраты, выделять во внеклеточную среду продукты реакции и в то же время не должна терять ферменты, кофакторы и другие вещества, необходимые для нормального функционирования внутриклеточных каталитических систем.