Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Применение реакций, катализируемых ферментами
Кинетика реакций, катализируемых иммобилизованными ферментами
Влияние внешнего сопротивления массопередаче
Чтобы читателю было легче усвоить некоторые основные понятия и специфическую терминологию, мы начнем с самого простого варианта. Предположим, что фермент иммобилизован только на наружных поверхностях носителя, имеющего форму пластины. В этом случае мы должны рассматривать только массопередачу из раствора к поверхности носителя и реакцию на этом носителе.
Одна из традиционных моделей, которую биохимики называют диффузионным слоем Нернста, а технологи — стоячей пленкой или граничным слоем, приводит к следующему выражению для потока (выраженному в молях в единицу времени на единицу поверхности) субстрата из жидкой фазы (биохимики иногда называют ее пулом) к границе раздела фаз:
Ns = ks(s0 - s) (4.2)
Здесь s и s0 — концентрации субстрата на границе раздела фаз и в жидкой фазе соответственно, a ks — коэффициент массопередачи. Последний зависит от физических свойств среды, а также от гидродинамических условий вблизи границы раздела фаз и может быть определен по известным корреляциям, рассматриваемым в гл. 8. В частности, ks возрастает при повышении скорости потока через реактор колонного типа с насадкой иммобилизованного фермента.
В стационарном состоянии субстрат не может аккумулироваться на поверхности катализатора, поэтому скорость поступления субстрата за счет массопередачи должна быть равна скорости его расхода в реакции на поверхности катализатора. Если допустить, что скорость м ферментативной реакции на поверхности (выраженная в молях в единицу времени на единице поверхности) подчиняется уравнению Михаэлиса — Ментен, то получим
![]()
Число необходимых для описания системы параметров (ks, s0, vmax и Km) можно уменьшить до двух (Da и н) путем введения следующих безразмерных переменных:
![]()
С учетом этих параметров уравнение материального баланса по субстрату примет вид
![]()
где 0 ≤ x ≤ 1,0.
Здесь необходимо подчеркнуть физический смысл параметра Da, числа Дамкелера:
![]()
Так, если Da значительно меньше единицы, то максимальная скорость массопередачи намного превышает максимальную скорость реакции (низкое сопротивление массопередаче). Если же сопротивление массопередаче велико, то этот фактор ограничивает скорость всего процесса, а Da принимает значения, намного превышающие единицу. Эти случаи известны как лимитируемый реакцией режим и лимитируемый диффузией режим соответственно.
Алгебраическим преобразованием уравнения (4.5) легко получить квадратное уравнение, позволяющее определить х аналитическим путем:
![]()
где
![]()
В уравнении (4.7) знаки + и — применяются при ß > 0 и ß < 0 соответственно. Если ß = 0, то ![]() Используя это выражение для s/s0, мы можем с помощью правой или левой части уравнения (4.7) оценить безразмерную наблюдаемых) скорость реакции
Используя это выражение для s/s0, мы можем с помощью правой или левой части уравнения (4.7) оценить безразмерную наблюдаемых) скорость реакции ![]() Следует помнить, что в общем случае зависимость
Следует помнить, что в общем случае зависимость ![]() от s0 не выражается уравнением Михаэлиса — Ментен. Кроме того, Кm уже нельзя считать равным S1/2, когда
от s0 не выражается уравнением Михаэлиса — Ментен. Кроме того, Кm уже нельзя считать равным S1/2, когда ![]() ровно в два раза меньше наблюдаемой максимальной скорости реакции
ровно в два раза меньше наблюдаемой максимальной скорости реакции ![]() поскольку величина s1/2зависит от Da.
поскольку величина s1/2зависит от Da.
Тем не менее параметр s1/2часто называют кажущейся константой Михаэлиса (Кmaрр) и используют для оценки влияния массопередачи. Если перед исследователем стоит только задача определения s1/2, такое упрощение может оказаться удобным, но в общем случае оно может привести к серьезным ошибкам. Например, можно прийти к выводу, что наблюдаемой скорости реакции соответствует следующее некорректное уравнение:
![]()
В каком-то конкретном случае это уравнение может даже удовлетворительно описывать наблюдаемую кинетику процесса, но в целом оно неверно, поскольку в нем не учтена зависимость Кmарр от свойств жидкой среды и гидродинамических свойств слоя вблизи границы раздела фаз. Как показывают экспериментальные данные, такая зависимость может резко изменять кинетику процесса (рис. 4.17).
В химической технологии влияние массопередачи на общую скорость реакции традиционно выражают через коэффициент эффективности η, физический смысл которого определяется следующим образом:

Следовательно, в нашем случае
![]()
Поэтому η ≤ 1, и, таким образом, в общем случае повышение сопротивления массопередаче будет сопровождаться снижением наблюдаемой активности катализатора. На рис. 4.18 приведены результаты эксперимента, подтверждающие такую зависимость.
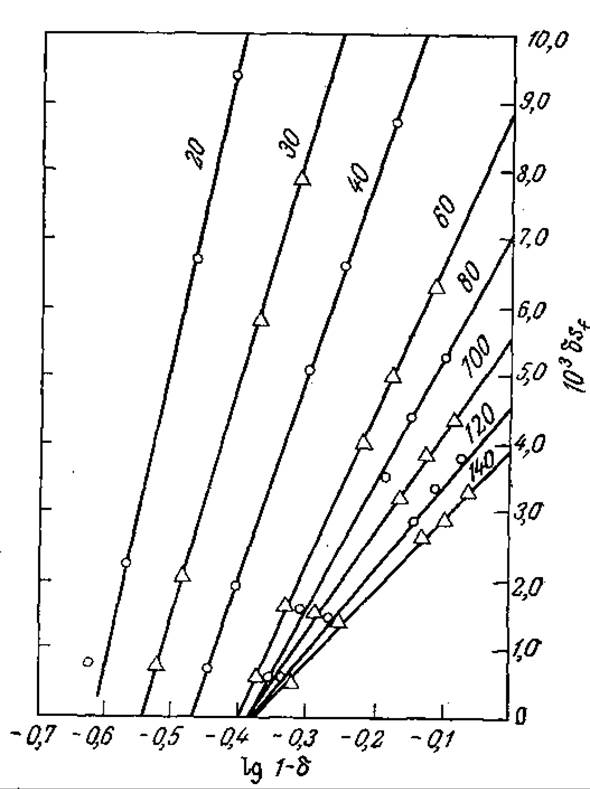
РИС. 4.17. Экспериментальное обнаружение взаимосвязи между скоростью трансформации субстрата δ [δ = (sf - se)/sf, где sf и se — концентрации субстрата в исходной смеси и в продуктах реакции соответственно] и скоростью потока [указана цифрами на кривых (мл/ч)] в реакторе со слоем иммобилизованного фермента (изучалась реакция гидролиза этилового эфира бензоил-L-аргинина фицином на карбоксиметилцеллюлозе). Если бы кинетика процесса подчинялась уравнению Михаэлиса — Ментен, то при потоке идеального вытеснения наклон всех кривых был бы одинаков и равен Кm. Изменение наклона с изменением скорости потока свидетельствует о значительном влиянии массопередачи на кинетику процесса в целом. [Воспроизведено с разрешения из статьи: Lilly М. D., Hornby W. Е., Crook Е. М., The Kinetics of Carboxymethylcellulose — Ficin in Packed Beds, Biochem. J., 100, 718 (1966).]
Если параметр Da близок нулю (очень медленная по сравнению с максимальной скоростью массопередачи реакция), то, согласно уравнению (4.5), х приближается к единице, и, следовательно, для лимитируемого реакцией режима (Da→O)
![]()
В этом случае кинетика процесса не отличается от истинной, собственной кинетики реакции на границе раздела фаз жидкость — твердое тело. Если приготовлен новый катализатор, содержащий иммобилизованный фермент на поверхности, то всегда следует экспериментально оценить, как методика иммобилизации отразилась на каталитических свойствах фермента. Необходимое для цели определение параметров vmaх и Km должно проводиться в условиях, когда Da ≤ 1; только тогда будут устранены маскирующие диффузионные эффекты.

РИС. 4.18. Экспериментальный метод обнаружения эффектов внешней диффузии; здесь v* — скорость реакции при высоких скоростях потока через насадочную колонну (изучалась реакция гидролиза 4∙10-4 М раствора n-нитроанилида N-бeнзил-DL-аргинина иммобилизованным трипсином при pH 8 и 25 °С). [Воспроизведено с разрешения из работы: Ford J. R. et al, Recirculation Reactor System for Kinetic Studies of Immobilized Enzymes, in Enzyme Engineering, Wingard L. B., Jr. (ed.), Wiley-Interscience, New York, 1972.]
Сведения о собственной кинетике ферментативной реакции необходимы также при разработке и проектировании реакторов с иммобилизованными ферментами, поскольку только таким путем можно достаточно надежно учесть влияние свойств жидкой среды, формы носителя фермента и характеристик смешения. Разработано много типов экспериментальных реакторов, предназначенных для изучения реакций обычного гетерогенного катализа в лимитируемом реакцией режиме. Некоторые из таких реакторов применяли и для исследования кинетики реакций, катализируемых иммобилизованными ферментами (рис. 4.19). В целях минимизации сопротивления массопередаче во всех этих реакторах вблизи катализатора создавались высокие скорости потока (большие ks, малые Da). Что касается иммобилизованных ферментов, то такой подход имеет несколько недостатков. Во-первых, как мы уже упоминали в разд. 3.7.3, гидродинамическое воздействие может вызвать частичную или даже полную денатурацию ферментов, связанных с носителем. Во-вторых, механическое перемещение одних частиц катализатора относительно других может приводить к потере фермента за счет истирания.
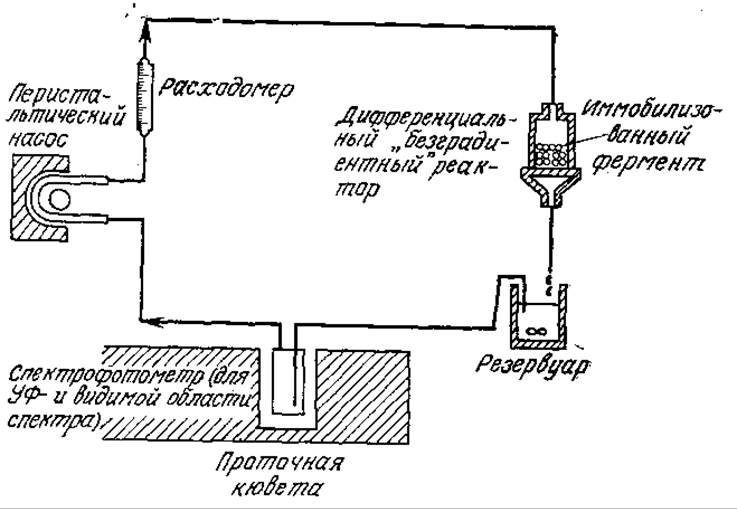
РИС. 4.19. Реактор с рециркуляцией для изучения влияния внешней массопередачи на кинетику реакций, катализируемых иммобилизованными ферментами.
В системах, в которых скорость процесса зависит как от химической реакции, так и от массопередачи, лимитируемый диффузией режим возникает тогда, когда vmax значительно больше kss0, т. е. при Da ≫ 1. Для лимитируемого диффузией режима (Da → ∞, н ограничен) путем ряда преобразований уравнения (4.7), включая разложение в ряд квадратного корня, можно получить следующие выражения:
![]()
Таким образом, при очень больших значениях Da реакция имеет первый порядок по общей концентрации субстрата и ее скорость v совершенно не зависит от собственных параметров катализатора vmах и Кm. В такой ситуации собственные кинетические параметры иммобилизованных ферментов вообще не проявляются. В лимитируемом диффузией режиме, например, при заданном s0 наблюдаемая активность постоянна, даже если ферменты на границе раздела фаз на самом деле теряют активность, в частности за счет изменения в неблагоприятную сторону температуры, pH или других условий процесса. Поэтому изучение скорости денатурации иммобилизованного фермента должно проводиться только в условиях, максимально приближенных к лимитируемому реакцией режиму.