ОСНОВЫ СТРОЕНИЯ И КИНЕТИКИ ФЕРМЕНТОВ В БИОЛОГИЧЕСКИХ СИСТЕМАХ - О. А. Науменко - 2017
3 Биоэнергетика
3.1 Метаболизм и его функции, регуляция метаболизма
3.1.1 Определение метаболизма и его функции в живых системах, регуляция метаболизма
Метаболизм - это совокупность обменных процессов в организме. В результате обмена веществ организм взаимодействует с окружающей средой, получает энергию для процессов жизнедеятельности (энергетический обмен) и материал для построения субклеточных структур, клеток, органов, тканей и организма в целом (пластический обмен).
Среди всего разнообразия живых организмов на нашей планете, отчетливо прослеживается единство метаболизма. В целом общий метаболизм всех классов органических соединений в основных принципах одинаков, а метаболизм многих органических соединений идентичен для всех живых организмов.
Выделяют два основных направления метаболизма в живых системах:
- анаболизм или пластический обмен - синтез веществ, требующий затрат энергии;
- катаболизм или энергетический обмен - распад веществ с выделением энергии, в результате которого клетка обеспечивается макроэргами.
Эти процессы в живых системах идут параллельно и одновременно, регуляция метаболизма на всех уровнях организации от клетки до целого организма осуществляется белками ферментами.
В зависимости от регуляции направления метаболизма все ферменты можно разделить на 3 большие группы:
1) анаболические (регулируют процесс синтеза веществ);
2) катаболические (катализируют реакции энергетического обмена);
3) амфоболические (регулируют оба процесса).
Вывод: таким образом, регуляция метаболизма в организме сводится к регуляции деятельности ферментов.
Функции метаболизма:
- обеспечение организма энергией, полученной при расщеплении богатых энергией пищевых веществ или путём преобразования энергии солнца;
- превращение пищевых молекул в предшественники, которые используются в клетке для биосинтеза собственных макромолекул;
- сборка макромолекулярных (биополимеры) и надмолекулярных структур живого организма, т. е. пластическое и энергетическое поддержание его структуры;
- синтез и разрушение биомолекул, выполняющих специфические функции в организме (мембранные липиды, внутриклеточные посредники и пигменты).
В ходе метаболизма осуществляются следующие основные типы химических реакций:
- окислительно -восстановительные;
- синтез соединений с использованием энергии АТФ;
-изомеризации;
- добавления или удаления функциональных групп.
Эти реакции носят ферментативный характер, поэтому типы химических реакций совпадают с классификацией ферментов.
Ферментативная цепь химических реакций в котором продукты одной реакции становятся субстратом для следующей реакции называется метаболическим путём (МП).
Часть метаболических путей являются линейными, другие - разветвлёнными, третьи - циклические.
Линейный МП - когда один исходный продукт - один конечный продукт, например, гликолиз, дыхательная цепь транспорта электронов.
Разветвлённый МП - когда несколько конечных продуктов из одного предшественника или превращение нескольких исходных веществ в один продукт - цикл трикарбоновых кислот, цикл биосинтеза мочевины.
Циклический МП - когда одно из веществ, вступающих в метаболический путь, регенерируют в серии последовательных реакций.
По форме усвоения углерода все живые организмы делятся на две группы:
- автотрофные (сами себя питающие) усваивают СО2 воздуха в процессе фотосинтеза и из него строят все свои органические вещества (фотосинтезирующие бактерии, зелёные растения);
- гетеротрофные (питающиеся за счёт других) получают углерод из сложных органических соединений (клетки высших животных и большинства микроорганизмов), т. е. питаются продуктами жизнедеятельности других организмов.
В биосфере автотрофы и гетеротрофы являются участниками кругооборота углерода и кислорода.
По отношению к кислороду гетеротрофы делят на:
- аэробы (требуют наличие кислорода);
- анаэробы - для окисления питательных веществ кислород не требуется;
- факультативные анаэробы - существуют в кислородной и бескислородной среде;
- облигатные анаэробы - живут только в бескислородной среде.
Что касается азота, то организмы нуждаются в азоте, используя его для синтеза аминокислот, нуклеотидов.
Регуляция метаболизма осуществляется изменением активности ферментов. Изменение количества фермента осуществляется путём индукции или репрессии генов, а также путем его протеолитического распада в клетке.
Ферменты, количество которых в живом организме относительно постоянно называют конститутивными, а чье количество изменяется в зависимости от метаболической ситуации - адаптивными или индуцибельными.
Еще одним механизмом регуляции метаболизма является изменение проницаемости мембран. Изменение функций мембраны приводит к изменению скоростей потоков метаболитов, газов, электрохимического потенциала, передачи нервных импульсов, функционирования рецепторов.
В организме человека координация метаболизма осуществляется нервной и эндокринной системами.
3.1.2 Фазы метаболизма
Метаболизм состоит из совокупности противоположных катаболических и анаболических процессов, которые имеют ряд отличительных черт (таблица 3.1)
Таблица 3.1 - Особенности катаболических и анаболических процессов
Катаболизм |
Анаболизм |
1. Расщепление (деградация) |
1. Биосинтез |
2. Окисление |
2. Восстановление |
3. Выделение энергии |
3. Потребление энергии |
4. Из различных исходных соединений образуются одинаковые конечные продукты |
4. Из одинаковых исходных соединений образуются различные конечные продукты. |
Катаболические и анаболические пути во многих отношениях хотя и различаются, но тесно взаимосвязаны. В разные периоды жизни имеет место преобладание анаболических процессов над катаболическими, и наоборот.
3.2.1.1 Метаболические циклы. Протекание некоторых путей метаболизма характеризуется тем, что в конце процесса происходит регенерация одного из исходных метаболитов, что ведет к замыканию метаболического пути и образованию кругового, циклического процесса. Такие замкнутые метаболические пути называют метаболическими циклами (Н —> Н). Циклическими путями метаболизма являются цикл трикарбоновых кислот, глиоксилатный цикл, орнитиновый цикл биосинтеза мочевины, цикл Кори, цикл Кальвина и др.
Существование метаболических циклов имеет глубокий биологический смысл, т. к. в них совершаются определенные биохимические реакции, чрезвычайно экономно используя одно и то же количество исходного соединения, которое при каждом кругообороте регенерируется и вновь вступает в процесс.
Отдельные реакции метаболического пути (цикла) называются этапами, звеньями или ступеньками метаболизма.
Метаболические пути могут пересекаться. Место пересечения путей метаболизма называют узловой точкой метаболизма, а соответствующий метаболит, через который проходят различные пути обмена веществ, - узловым (или ключевым) метаболитом (D). Так, например, узловыми (ключевыми) метаболитами являются глюкозо - 6 - фосфат, ацитил - СоА и др., через которые может происходить переключение метаболизма с одного метаболического пути на другой.
Очень часто образование одного и того же метаболита может осуществляться двумя или несколькими путями.
3.1.2.2 Основные и побочные пути метаболизма. Метаболический путь, обменная мощность которого больше, называют основным путем метаболизма (А —> В —> С —> D), а другой или другие пути, у которых метаболическая мощность меньше, относят к вторичным путям метаболизма (А —> М —> N —> D).
Побочными путями метаболизма называют пути, которые исходят из общего метаболита основного пути, но приводят к образованию другого (побочного) конечного продукта (метаболита) (Е —> О —> Р).
Регуляторные (ограничивающие) этапы. Интенсивность метаболического потока, или обменная мощность данного пути метаболизма, зависит от узкого звена, так называемого «ограничивающего этапа», т. е. от этапа, обладающего наименьшей метаболической мощностью.
В целях повышения (усиления) метаболического потока нет необходимости изменять все этапы метаболического пути, а достаточно изменить один или несколько. Как правило, регуляторные этапы представляют собой необратимые реакции. Регуляторным этапом чаще всего является первый ферментативный этап метаболического пути. Таким этапом в гликолитическом пути является гексокиназная реакция, в окислительном пентозофосфатном пути - глюкозо — 6 - фосфатдегидрогеназная реакция и т. д. В ограничивающих этапах Природой заложена экономность регуляторных систем метаболизма.
В зависимости от последовательности протекания процессов обмена веществ в организме последовательность процессов метаболизма разделяют на три этапа.
1. Пищеварение и резорбция (всасывание). В процессе пищеварения в желудочно-кишечном тракте происходит гидролиз высокомолекулярных соединений с образованием простых. Сюда относится и бактериальное воздействие на пищевые вещества со стороны желудочно-кишечной флоры, что имеет особое значение для жвачных. Затем происходит резорбция питательных веществ через слизистые оболочки кишок и поступление через мембраны в клетки.
2. Промежуточный обмен - совокупность внутриклеточных химических реакций синтеза и деградации с образованием промежуточных и конечных продуктов метаболизма.
3. Выделение конечных продуктов обмена.
3.1.3 Последовательность процессов метаболизма, стадии извлечения энергии питательных веществ
В зависимости от количества освобождаемой энергии в процессе расщепления и окисления питательных веществ Г. Кребс выделяет три основные стадии извлечения энергии питательных веществ.
На первой стадии (подготовительной) большие (полимерные) молекулы питательных веществ в желудочно-кишечном тракте расщепляются на малые (мономеры). Полисахариды распадаются до моносахаридов (в основном до гексоз: глюкозы, фруктозы, галактозы). Жиры расщепляются до глицерола и жирных кислот, а белки - до аминокислот. Конечными продуктами первой стадии являются примерно 25-30 различных химических соединений (аминокислоты, моносахариды, глицерол, жирные кислоты). При этом освобождается около 0,6 - 1 % общей энергии питательных веществ, которая может быть использована только для образования тепла (но не для других целей). Значение химических реакций первой стадии - в подготовке питательных веществ к дальнейшему освобождению энергии.
На второй стадии (начальной фазе промежуточного метаболизма) вещества, образовавшиеся на первой стадии, подвергаются дальнейшему расщеплению. Распад полимеров до промежуточных продуктов. Результат этих превращений, на первый взгляд, кажется неожиданным, т.к. из большого количества химических соединений, являющихся конечными продуктами первой стадии, образуется три главных метаболита: 2-оксоглутарат, оксалоацетат и ацетил - СоА, среди которых преобладает ацетил - СоА. Метаболиты второй стадии играют центральную роль в метаболизме. На этой стадии освобождается 25 - 30 % энергии, содержащейся в питательных веществах.
Третья стадия (конечная фаза промежуточного метаболизма распад до СО2 и Н2О с участием кислорода) включает цикл трикарбоновых кислот и дыхательную цепь транспорта электронов - конечные пути в окислении питательных веществ СО2 и Н2О. На третьей стадии освобождаются остальные 70 - 75 % энергии питательных веществ, которые сосредотачивается в фосфатных связях АТФ.
Цикл трикарбоновых кислот и дыхательная цепь транспорта электронов, сопряженная с окислительным фосфорилированием, являются общими магистральными путями обмена веществ и энергии, через которые проходит метаболизм углеводов, липидов и белков.
Контрольные вопросы по изучаемой теме
4. Дайте определение метаболизма.
5. Какие функции выполняет метаболизм.
6. Как осуществляется регуляция метаболизма.
7. Катаболизм и анаболизм, их взаимосвязь.
8. Последовательность процессов метаболизма и стадии извлечения энергии питательных веществ.
9. Что такое метаболический путь?
10. Какие виды метаболического пути выделяют?
11. Что такое разветвленный МП?
12. Как называется общее вещество для различных МП?
13. Какова роль ацетил - коэнзима А в биохимических реакциях?
3.2 Биологическое окисление (тканевое дыхание)
3.2.1 Определение биологического окисления. Пути использования кислорода
Перенос фосфатной группы на АДФ - с образованием АТФ является основной реакцией биоэнергетики. Источником энергии для этой реакции служит поток электронов при окислительно - восстановительных реакциях.
У нефотосинтезирующих организмов источником электронов является восстановленные компоненты (пища); у фотосинтезирующих - донором электронов служат химические молекулы, которые переходят в возбуждённое состояние под действием света.
Биологическое окисление, или тканевое дыхание, представляет собой совокупность окислительно - восстановительных процессов, протекающих в живых клетках, основной функцией которого является обеспечение организма энергией в доступном для использования виде и восстановительными эквивалентами для биосинтетических процессов.
Вещество окисляется, если теряет электроны или одновременно электроны и протоны (водородные атомы, дегидрирование) или присоединяет кислород (оксигенирование). Противоположные превращения - это процессы восстановления.
Способность молекул отдавать электроны другой молекуле характеризуется окислительно-восстановительным потенциалом (редокс - потенциалом, Е°′).
Редокс - потенциал определяют путём измерения электродвижущей силы в вольтах. В качестве стандарта принят редокс - потенциал реакции при PH 7,0: Н2 ⇄ -2Н+ + 2 е-, равен 0,42 В.
Редокс - потенциалы связаны с изменением свободной энергии ТС уравнением Нернста:
∆G°’ = -zF x ∆Е°’
z - число перенесённых в реакции электронов; F - постоянная Фарадея, ∆Е°’ - разность ре доке - потенциалов электронно - донорной и электронно - акцепторной пар.
В XVIII столетии А. Лавуазье установил, что процесс дыхания связан с окислением веществ, и обратил внимание на сходство процессов горения органических веществ и дыхания животных, в связи с чем, науке долгое время господствовало мнение, что биологическое дыхание представляет собой медленное горение.
Принципиальной особенностью тканевого дыхания в отличие от горения является то, что окислительные процессы в организме протекают при низкой температуре без резких перепадов и без появления пламени, т. к. энергия выделяется не одновременно, а порционно (частями).
Вторая особенность состоит в том, что при биологическом окислении вода является не только конечным продуктом, как при горении, но непосредственным участником окислительных процессов, которые более интенсивно протекают в тканях с высоким содержанием воды.
Третьей особенностью биологического окисления является то, что реакцией, поставляющей энергию в живых организмах, за незначительным исключением, является реакция окисления водорода кислородом, которая в обычных условиях протекает со взрывом.
В целях объяснения особенностей биологического окисления было выдвинуто несколько теорий.
Первой из них была теория активирования кислорода (А. Н. Бах, К. Энглер и Вилд), затем В. И. Палладии и Г. Виланд выдвинули теорию активирования водорода. Открытие цитохромов (Д. Кейлин, 1925), снимающих электроны с водорода, и фермента цитохромоксидазы (О. Варбург, 1928), на которую передаются электроны с водорода, несколькими годами позже позволило создать современную теорию биологического окисления (или тканевого дыхания), получившую название дыхательной цепи транспорта электронов, которая в значительной мере базируется на двух предыдущих теориях.
При изучении окислительных процессов в клетках целесообразно придерживаться следующей схемы использования кислорода (таблица 3.2):
Таблица 3.2 - Пути использования кислорода в клетках
Окисление субстрата |
||||
Дегидрирование |
Оксигенирование |
Свободнорадикальное окисление |
||
-2Н |
-2Н |
+1/2 O2 |
+ O2 |
O'- |
на 1/2 O2 |
на O2 |
+1/2 O2 |
+ O2 |
НО'- NO' ONOO- O3 |
Н2O |
Н2O2 |
R-OH |
RO2 |
|
Тканевое дыхание |
Простые окислительные системы |
Монооксигеназный путь |
Диоксигеназный путь |
|
АТФ |
обезвреживание |
обезвреживание |
разрыв ароматическ их колец |
|
Тепло |
Тепло |
|||
Выделяют три пути использования кислорода:
1) окисление субстрата путём дегидрирования с переносом двух атомов водорода на атом кислорода с образованием Н2O (энергия окисления аккумулируется в форме АТФ, на этот процесс расходуется более 90 % кислорода) или молекулу кислорода с образованием Н2O2;
2) присоединение атома кислорода с образованием гидроксильной группы или молекулы кислорода;
3) образование кислородных свободных радикалов, служащих как для защиты внутренней среды организма от чужеродных молекул, так и для повреждения мембран в механизмах окислительного стресса.
3.2.2 Стадии тканевого дыхания
В биохимии и клеточной биологии под тканевым (клеточным) дыханием понимают окислительно - восстановительные процессы, в результате которых происходит поглощение клеткой кислорода и выделение углекислого газа.
У аэробно дышащих клеток конечным акцептором электронов и протонов является кислород. В этой связи тканевое дыхание в аэробных клетках проходит три основные стадии.
1. Образование ацетил-СоА из органических молекул (глюкозы, жирных кислот, аминокислот) путём окисления последних.
2. Ацетил-СоА вступает в цикл трикарбоновых кислот, где его ацетильная группа ферментативно окисляется до СО2 и выделяется HS КоА. Энергия, высвобождаемая при окислении, накапливается в восстановленных переносчиках - коферментах (НАД, ФАДН2).
3. Электроны переносятся на О2, как конечный акцептор, через последовательную цепь ферментов - переносчиков электронов, которая получила название дыхательной цепи или цепи переноса электронов (ЦПЭ).
При переносе электронов по дыхательной цепи выделяется большое количество энергии, которая используется для синтеза АТФ путём окислительного фосфорилирования.
Процесс тканевого дыхания оценивают с помощью дыхательного коэффициента (ДКО2):
ДКО2 = число молей образованного СО2 / число молей поглощённого О2.
Этот показатель позволяет оценить тип топливных молекул, используемых организмом, так при полном окислении углеводов дыхательный коэффициент равен 1, белков - 0,8, жиров - 0,71, при смешанном питании величина ДКО2 = 0,85.
ЦПЭ встроена во внутреннюю мембрану митохондрий. Электроны передаются по цепи от более электроотрицательных компонентов к более электроположительному кислороду: от НАДН (-0,32 В) до кислорода (+0,82 В).
3.2.3 Особенности строения митохондрий
Наружная мембрана митохондрий проницаема для многих молекул и ионов (электрозависимые анионные каналы), поскольку содержит митохондриальные порины - белки молекулярной массой от 30 до 35 кДа (атомные единицы массы - дальтоны (Да)).
Функциональные составляющие митохондрий:
1) внешняя мембрана митохондрий (ограничивает внутреннее пространство) проницаема для О2 и ряда низкомолекулярных веществ;
2) содержит ферменты метаболизма липидов и моноаминов;
3) межмембранное пространство (ММП) содержат аденилаткиназу и ферменты фосфорилирования АДФ, не связанные с дыхательными цепями;
4) внутренняя мембрана митохондрий (ВММ) содержит белки, 20-25 % которых - белки-ферменты цепи переноса протонов и электронов и окислительного фосфорилирования, Проницаема только для малых молекул (кислорода, мочевины) и содержит специфические трансмембранные переносчики).
5) матрикс содержит ферменты цикла трикарбоновых кислот, β-окисления жирных кислот, ферменты митохондриального синтеза ДНК, РНК, белков.
Контрольные вопросы по изучаемой теме
1. Пути потребления кислорода (биологическое окисление).
2. Понятие редокс -потенциала.
3. Уравнение Нернста.
4. Пути использования кислорода в окислительных процессах.
5. Дыхательный коэффициент.
6. Особенности строения мембраны митохондрий.
7. Чему равен дыхательный коэффициент белка и углеводов?
8. Что такое тканевое дыхание?
9. Назовите три основные стадии тканевого дыхания.
10. Где расположена ЦПЭ?
3.3 Дыхательные цепи
3.3.1 Типы переноса электронов в дыхательной цепи
Митохондриальная дыхательная цепь состоит из белков - ферментов, последовательно передающих электроны.
Различают три типа переноса электронов:
1) прямой перенос электронов, например, за счёт восстановления Fe3+ в Fe2+;
2) перенос атомов водорода (Н+ и е-);
3) перенос гидрид - иона водорода (Н)-, который содержит два электрона. Электроны для дыхательной цепи образуются в результате действия
ферментов дегидрогеназ - пиридинзависимых дегидрогеназ и флавиновых ферментов, которые собирают электроны от субстратов катаболических путей и аккумулируют их в универсальных акцепторах электронов - никотинамидных нуклеотидах (НАД+ или НАДО) или флавиновых нуклеотидах (ФМН+ или ФАД+).
3.3.2 Компоненты дыхательной цепи
Дыхательная цепь является частью процесса окислительного фосфорилирования. Компоненты дыхательной цепи катализируют перенос электронов от НАДН+ и Н+ или восстановленного убихинона (QН2) на молекулярный кислород. Из-за большой разности окислительно-восстановительных потенциалов доноров (НАДН+ и Н, QH2) и акцептора (О2), реакция является высокоэкзергонической. Большая часть выделяющейся при этом энергии используется для создания градиента протонов и, наконец, для образования АТФ с помощью АТФ - синтазы.
Дыхательная цепь включает три белковых комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану, и две подвижные молекулы - переносчики: убихинон (кофермент Q) и цитохром С. Фермент сукцинатдегидрогеназа (СДГ), принадлежащая собственно к цитратному циклу, рассматривается как комплекс II дыхательной цепи (рисунок 3.1). АТФ - синтаза называется комплексом V, хотя она и не принимает участия в переносе электронов.
Рисунок 3.1 - Строение дыхательной цепи
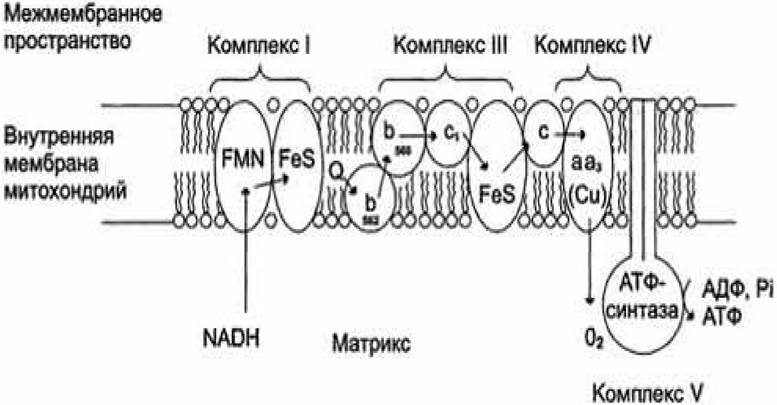
Комплексы дыхательной цепи построены из множества полипептидов и содержат ряд различных окислительно - восстановительных коферментов, связанных с белками. К ним принадлежат флавин (ФМН (FMN) или ФАД (FAD), в комплексах I и II), железо - серные центры (в I, II и III комплексах) и группы Гема (в II, III и IV комплексах). Структура комплексов представлена в таблице 3.3.
В переносе электронов принимают участие различные типы гемов, ковалентно связанных с белком. Гемы типа b соответствуют гемоглобинам. В комплексе IV непосредственно с кислородом взаимодействуют ион меди (Сuв) и гем а3.
Таблица 3 - Комплексы митохондриальной цепи переноса электронов
Наименование ферментативных комплексов |
Молекулярная масса (кДа) |
Число субъединиц |
Простетические группы |
IНАДН - дегидрогеназа (НАДН - Ко Q - оксидоредуктаза) |
850 |
42(14) |
ФМН, FeS |
II сукцинатдегидрогеназа |
140 |
5 |
ФАД, FeS |
III убихинон: цитохром с- оксидоредуктаза |
250 |
11 |
Гемы, FeS |
цитохром С комплекс |
13 |
1 |
Гем |
IV цитохромоксидаза (цитохром С - оксидаза) |
160 |
13 (3-4) |
Гемы, CuA CuB |
Примечание - цитохром с не входит в состав комплекса; цитохром с является растворимым белком и перемещается между комплексами III и IV.
3.3.3 Типы окисляемых субстратов
Субстраты окисления - это молекулы, которые при окислении дегидрируются (теряют 2Н). Различают три типа субстратов:
1) субстраты первого типа (углеводородные) — сукцинат, ацетил - КоА. Средняя энергия отщепления пары е- составляет около 150кДж/моль. Это меньше, чем энергия е- в коферменте НАДН. Именно поэтому НАД не может участвовать в дегидрировании этих субстратов;
2) субстраты второго типа (спиртовые). При их дегидрировании возникают кетоны. Средняя энергия отщепления пары электронов - около 200 кДж/моль, поэтому НАД может участвовать в дегидрировании субстратов II типа;
3) субстраты третьего типа (альдегидные). Энергия отщепления пары е- составляет около 250 кДж/моль. Дегидрогеназы субстратов III типа часто содержат несколько коферментов. При этом часть энергии запасается до цепи переноса электронов.
3.3.4 Работа ферментов дыхательной цепи
Электроны от субстратов доноров второго и третьего типов поступают в дыхательную цепь различными путями. При окислении НАДН+ и Н+ комплекс I переносит электроны через ФМН и FeS - центры на убихинон. Образующиеся при окислении сукцината, ацил - КоА и других субстратов первого типа электроны переносятся на убихинон комплексом II или другой митохондриальной дегидрогеназой через связанный с ферментом ФАДН2 или флавопротеин, При этом окисленная форма кофермента Q восстанавливается в ароматический убигидрохинон. Последний переносит электроны в комплекс III, который поставляет их через два гема b, один Fe/S-центр и гем c1 на небольшой гемсодержащий белок цитохром с. Последний переносит электроны к комплексу IV, цитохром с - оксидазе. Цитохром с - оксидаза содержит для осуществления окислительно-восстановительных реакций два медьсодержащих центра (СuA и СuB) и гемы а и а3, через которые электроны, наконец, поступают к кислороду. При восстановлении О2 образуется сильный основной анион О2-, который связывает два протона и переходит на воду. Поток электронов сопряжен с образованным комплексами I, III и IV протонным градиентом.
Таким образом, комплекс I и II катализирует перенос электронов от различных доноров: комплекс I — от НАДН, комплекс II — от сукцината; комплекс III переносит электроны от убихинона к цитохрому С, а комплекс IV переносит электроны от цитохрома С на кислород.
Перенос протонов комплексами I, III и IV протекает векторно из матрикса в межмембранное пространство. При переносе электронов в дыхательной цепи
повышается концентрация ионов Н+, т. е. понижается значение pH. В интактных митохондриях по существу только АТФ - синтаза позволяет осуществить обратное движение протонов в матрикс. На этом основано важное в регуляторном отношении сопряжение электронного переноса с образованием АТФ.
Убихинон благодаря неполярной боковой цепи свободно перемещается в мембране. Водорастворимый цитохром с находится на внешней стороне внутренней мембраны.
Окисление НАДН (NADH) комплексом I происходит на внутренней стороне мембраны, а также в матриксе, где происходит также цитратный цикл и β-окисление — самые важные источники НАДН. В матриксе протекают, кроме того, восстановление O2 и образование АТФ. Полученный АТФ переносится по механизму антипорта (против АДФ) в межмембранное пространство, откуда через белки порины проникает в цитоплазму.
Изменение свободной энергии ∆G в реакциях восстановления зависит только от разности окислительно-восстановительных потенциалов донора и акцептора. Общая величина энергии реакции (более 200 кДж/моль) разбивается на небольшие и более удобные «пакеты», величина которых определяется разностью окислительно восстановительных потенциалов соответствующих промежуточных продуктов. Это обеспечивает дыхательной цепи удивительно высокий выход энергии, составляющий примерно 60%.
3.3.5 Полная и укороченная дыхательные цепи
В зависимости от типа субстрата окисления (т. е. от энергии отщепления пары е-) выделяют полную и укороченную дыхательные цепи (цепи переноса электронов - ЦПЭ).
ЦПЭ - это универсальный конвейер по переносу протонов и электронов от субстратов окисления к кислороду. В полную ЦПЭ вступают субстраты II и III типов; в укороченную - первого типа. В укороченной ЦПЭ отсутствуют пиридинзависимые дегидрогеназы.
Полная дыхательная ЦПЭ. Субстраты второго и третьего типов передают протоны и электроны (т. е. дегидрируются) на кофермент НАД пиридинзависимых дегидрогеназ (первый комплекс ЦПЭ). Кофермент НАД не связан прочно с дегидрогеназой и после реакции дегидрирования субстрата свободно диффундирует к внутренней мембране митохондрий.
НАДН - дегидрогеназа локализована во внутренней мембране митохондрий и имеет две простетические группы - ФМН и FeS - белки. В переносе двух атомов водорода участвует ФМН, далее FeS - белки забирают 2е, а оставшиеся 2Н+ выталкивают в межмембранное пространство и «ждут» момента, когда 2е- зарядят атом кислорода отрицательно, иными словами, на стадии НАДН - дегидрогеназы разделяются потоки протонов и электронов.
Неполная (укороченная) дыхательная ЦПЭ. Начинается от субстратов первого типа. Их дегидрирование происходит с помощью связанного с внутренней мембраной митохондрий ФАД-содержащего Ко Q фермента сукцинатдегидрогеназы. ФАД присоединяет два атома водорода от субстрата, затем FeS забирает 2е~, а два протона выталкиваются в матрикс, далее электроны передаются на кислород, как и в полной ЦПЭ.
3.3.6 Свойства кофермента Q и цитохромов
Два электрона передаются убихинону KoQ. В тканях человека присутствует KoQio, имеющий боковую цепь из 10 изопреновых единиц. KoQ может передвигаться в липидной фазе мембраны и передавать 1e~ или 2е~ на цепи цитохромов. До KoQ был двухэлектронный перенос; после KoQ - одноэлектронный.
Каждая молекула восстановленного KoQ передает электрон на цепь цитохромов. (Следовательно, далее должны участвовать по две цепи цитохромов.) Цитохромы располагаются в соответствии с их редокс -потенциалом. Это гемсодержащие ферменты. В качестве простетической группы содержат гем и гемоподобные структуры. Гемо производные протопорфирина IX — гем гемоглобина и гем цитохрома b — аналогичны по строению.
Цитохромы различаются:
1) по радикалам в порфириновом кольце;
2) по строению апофермента;
3) по типу связи простетической группы с апоферментом.
В цитохроме b атом железа пятой и шестой координационными связями присоединен к азоту имидазольных колец гистидина апофермента. В цитохроме с пятая связь соединена с гистидином, а шестая с метионином апофермента. При переносе электрона валентность атома железа меняется: от Fe3+ до Fe2+. К шестой координационной связи железа цитохрома а могут присоединиться HCN, H2S, СО. При этом валентность железа (Fe) становится постоянной и поток электронов прекращается. Это механизм действия ингибиторов дыхательной цепи.
Комплекс цитохромов а + а3 называют цитохромоксидазой. В цитохроме а3 имеются атомы меди. Электроны принимаются субъединицами цитохрома а и передаются цитохрому а3 который передает их на кислород. Этот перенос сопровождается сменой валентности меди от Сu2+ на Сu1+. Атом кислорода заряжается отрицательно и приобретает способность взаимодействовать с протонами и образовывать Н2O.
Контрольные вопросы по изучаемой теме
1. Назовите основные пять комплексов дыхательной цепи.
2. Какие комплексы встроены в мембрану митохондрий?
3. Какие комплексы находятся в межмембранном пространстве?
4. Какие особенности строения первого комплекса?
5. Как работает дыхательная цепь?
6. Какие типы окисления субстратов выделяют?
7. Какие субстраты относятся к первому типу?
8. Что такое полная дыхательная цепь?
9. Что такое укороченная дыхательная цепь?
10. Типы переноса электронов.
11. Что такое цитохромы?
3.4 Окислительное фосфорилирование
3.4.1. Понятие окислительного фосфорилирования
Синтез АТФ из АДФ и неорганического фосфата, сопряженный с переносом протонов и электронов по дыхательной цепи от субстратов к кислороду, называется окислительным фосфорилированием.
Энергия окисления, достаточная для образования молекулы АТФ, выделяется в дыхательных цепях на следующих участках:
1) НАДН - дегидрогеназа;
2) убихинон: цитохром с - оксидоредуктаза;
3) цитохром с - оксидаза.
Энергии достаточно для образования макроэргической связи АТФ (30,2 кДж/моль). Уменьшение свободной энергии, сопровождающее перенос протонов и электронов на кислород в результате одного дегидрирования, составляет примерно 220 кДж/моль. При этом на синтез АТФ в полной дыхательной цепи может быть израсходовано 30,2 х 3 = 90,6 кДж/ моль. Отсюда КПД ЦПЭ около 40 %. Остальная энергия рассеивается в виде тепла (поддержание температуры тела).
Известны три основных гипотезы окислительного фосфорилирования.
Механохимическая, или конформационная (Грин, Бойер, 60-е гг. XX в.). В процессе переноса протонов и электронов изменяется конформация белков - ферментов. Они переходят в новое богатое энергией состояние, а затем при возвращении в исходную конформацию отдают энергию для синтеза АТФ. Гипотеза частично подтверждена: Е окисл.—> Е конформ. сдвигов —> ЕАТФ.
Гипотеза химического сопряжения (Липман, Слейтер, Ленинджер, 30 - 40-е гг. XX в.). В сопряжении дыхания и фосфорилирования участвуют сопрягающие вещества, например, вещество Х.Вещество «X» акцептирует протоны и электроны от первого фермента в пункте сопряжения, и взаимодействует СН3РО4. В момент отдачи протонов и электронов второму ферменту пункта сопряжения связь становится макроэргической. Далее макроэрг передаётся на АДФ с образованием АТФ.
Хемиосмотическая гипотеза П. Митчела (1961). Питер Митчелл предположил, что синтез АТФ сопряжен с протонным градиентом поперек внутренней мембраны митохондрий. При этом, перенос электронов вдоль компонентов дыхательных цепей внутренней мембраны митохондрий обеспечивает перенос протонов через (поперек) внутреннюю мембрану митохондрий на ее цитозольную сторону. В результате на внутренней мембране митохондрий формируется электрохимический градиент.
По современным представлениям дыхание и фосфорилирование связаны между собой электрохимическим потенциалом (ЭХП) на внутренней мембране митохондрий.
Для объяснения необходимы следующие понятия:
а) внутренняя мембрана митохондрий непроницаема для Н+ и ОН-;
б) во внутреннюю мембрану митохондрий вмонтирована АТФ -синтаза (комплекс V), катализирующая обратимую реакцию:
АТФ + Н2O ⇄ АДФ + Р;
в) синтез АТФ осуществляется при перемещении протонов через АТФ -синтазу в направлении от ММП (межмембранное пространство) к матриксу.
Суть окислительного фосфорилирования: за счет энергии переноса электронов в ЦПЭ (Е окисления), происходит движение протонов через мембрану в межмембранное пространство митохондрий и создается электрохимический потенциал (Еэхп). При возвращении протонов назад через АТФ - синтазу энергия электрохимического потенциала (ЭХП) трансформируется в энергию связи: АТФ - остаток фосфорной кислоты.
Комплексы дыхательной цепи: НАДН - дегидрогеназа, убихинон: цитохром с - оксидоредуктаза и цитохром с - оксидаза выталкивают протоны в межмембранное пространство. Протоны берутся из Н2O матрикса или за счет конформационных изменений в ферментах. Со стороны матрикса на мембране будет преобладать отрицательный заряд (избыток ОН-), а со стороны ММП положительный (за счет Н+). В результате возникает ЭХП, который состоит из двух компонентов:
- химического (разности концентраций ионов Н);
- электрического (разности электрических потенциалов ∆μН+ = ∆φ + ∆pH). Эта величина измерена, она равна - 0,14 В.
При обратном токе протонов через канал АТФ - синтазы (разрядка мембраны) синтезируется АТФ.
3.4.2 Структура АТФ - синтазы
АТФ - синтаза состоит из следующих компонентов:
- F0 (oligomycin - sensitive) - гидрофобный сегмент из 13 полипептидных цепей, связанный с внутренней мембраной митохондрий;
- F0 - это протонный канал, по которому в норме через мембрану могут перемещаться только протоны;
- F1 (сопрягающий фактор, который был определен как необходимый для окислительного фосфорилирования) - периферический мембранный белок, катализирующий синтез АТФ при перемещении протонов.
Митохондриальный F1, компонент состоит из 9 субъединиц пяти типов: α, β, y. β субъединицы имеют один каталитический сайт для синтеза АТФ. Головка каталитического F1, компонента представляет собой сферу высотой 8 нм и шириной 10 нм, состоящей из α и β - субъединиц, расположенных подобно долькам апельсина (рисунок 3.1). Полипептиды, которые образуют стебель F1, расположены асимметрично: один домен y - субъединицы образует центральный ствол, который проходит через F1; второй домен у -субъединицы связан с одной из трех β - субъединиц, которая обозначается β - «пустая».
Рисунок 3.1 - Структура фермента АТФ - синтазы

Хотя аминокислотная последовательность трех β - субъединиц идентична, они отличаются по конформации и поэтому у - субъединица может связываться только с одной из β - субъединиц. Конформации β - субъединиц обозначаются, как β - АТФ, β - АДФ и β - «пустая», показывая, какие нуклеотиды с ними связаны в данный момент. Это важно для механизма действия комплекса.
F0 компонент образует протонный канал и состоит из субъединиц трех типов: а, b и с. С - субъединица представляет собой небольшой гидрофобный полипептид, состоящий из двух трансмембранных спиралей, локализованных почти полностью в мембране с небольшой петлей, выступающей из матриксной стороны мембраны.
3.4.3 Механизм синтеза АТФ
Механизм синтеза АТФ был предложен Р. Воуег и включает 3 стадии, в результате которых происходит изменение конформации β субъединицы:
1) β субъединица находится в β - АДФ конформации и связана АДФ и неорганическим фосфатом;
2) субъединица изменяет конформацию, которая обеспечивает β - АТФ форму, которая прочно связывает и стабилизирует АТФ;
3) субъединица изменяет конформацию на β - «пустая», которая имеет низкое сродство к АТФ и вновь синтезированная молекула освобождается с поверхности фермента.
Следующий цикл начинается, когда β субъединица снова переходит в конформацию β - АДФ и связывает АДФ и неорганический фосфат.
Конформационные изменения происходят при движении протонов через F0 компонент АТФ синтазы. Движение протонов через F0 канал вызывает поворот центрального ствола y - субъединицы.
Таким образом, полный поворот у - субъединицы вызывает прохождение каждой β - субъединицы через все возможные конформационные состояния и за один поворот головки синтезируются 3 молекулы АТФ.
3.4.4 Количественная оценка окислительного фосфорилирования
Для количественного выражения окислительного фосфорилирования введён коэффициент, который представляет собой отношение числа молекул неорганического фосфата, перешедших в состав АТФ в процессе дыхания, на каждый поглощенный атом кислорода.
Возникает вопрос, какое количество протонов необходимо для синтеза 1 молекулы АТФ? Для синтеза 1 молекулы АТФ необходимо 4Н+, один из которых используется для транспорта Рн, АТФ и АДФ через митохондриальную мембрану. Следовательно, коэффициент P/О равен 2,5 (10/4).
3.4.5 Дыхательный контроль
Дыхательный контроль - это регуляция скорости переноса электронов по дыхательной цепи отношением АТФ/АДФ. Чем меньше это отношение (преобладает АДФ), тем интенсивнее идёт дыхание (что обеспечивает реакцию АДФ + Рн. —> АТФ).
Разобщение дыхания и окислительного фосфорилирования возникает при повышении проницаемости мембраны митохондрий для протонов в любом месте, а не только в канале АТФ - синтазы. При этом не создается электрохимический потенциал, и энергия окисления рассеивается в виде тепла. Так действуют ионофоры (2,4 - динитрофенол, валиномицин и др.). Они переносят обратно протоны через мембрану, выравнивая градиенты pH и мембранного потенциала. Лекарственные препараты (аминобарбитал), продукты жизнедеятельности микроорганизмов, избыток тироидных гормонов (вызывают накопление ненасыщенных жирных кислот, являющихся ионофорами) и др. приводят к разобщению дыхания и фосфорилирования, обеспечивая гипертермию.
На разобщении дыхания и фосфорилирования базируется терморегуляторная функция тканевого дыхания. Тканевое дыхание, протекающее в митохондриях и не сопровождающееся образованием макроэргов, называют свободным или нефосфорилирующим окислением.
Природным разобщающим агентом является термогенин, протонный канал в митохондриях бурых жировых клеток. Бурый жир обнаружен у новорожденных и животных, впадающих в зимнюю спячку, и служит для теплообразования. При охлаждении организма норадреналин активирует гормонзависимую липазу. Благодаря
активному липолизу в организме образуется большое количество свободных жирных кислот, которые распадаются в результате β-окисления и в дыхательной цепи. Так как жирные кислоты одновременно открывают протонный канал термогенина, их распад не зависит от наличия АДФ, т. е. протекает с максимальной скоростью и генерирует энергию в форме тепла.
3.4.6 Свободно - радикальное окисление. Антиоксидантная защита
Сдерживание процессов свободно-радикального окисления осуществляется с помощью неферментативных и ферментативных механизмов.
1. Неферментативная защита включает: комплексны, связывающие металлы (этилендиаминотетрауксусная кислота); в водной фазе - витамин С, ураты; в липидной фазе - Вит А, Е, тироксин, стероиды.
2. Ферментативная защита включает ферменты: супероксид - дисмутазу, каталазу, пероксидазу (чаще глутатионпероксидазу).
В продукты питания добавляют антиоксидантные добавки: β-каротин, α- токоферол, бутиловый гидроксианизол. Для профилактики радиационных поражений используют комплексы витаминов А, Е, С и β - каротин, Е, С.
Контрольные вопросы по изучаемой теме
1. Определение окислительного фосфорилирования.
2. Какой механизм окислительного фосфорилирования?
3. Расскажите три гипотезы осуществления механизма окислительного фосфорилирования.
4. Структура АТФ-синтазы.
5. Механизм синтеза АТФ.
6. Количественная оценка окислительного фосфорилирования.
7. Дыхательный контроль и нарушение клеточного дыхания.
8. Ингибиторы дыхания.
9. Разобщение дыхания и окислительного фосфорилирования.
10. Какие выделяют гипоэнергетические состояния?
11. Что такое свободнорадикальное окислени?
12. Что такое антиоксидантная защита клеток?
13. Что такое окислительный и восстановительный стресс?
14. Какие ферменты входят в систему антиоксидантной защиты?
3.5 Цикл трикарбоновых кислот
3.5.1 История открытия цикла трикарбоновых кислот
Немецко - английский биохимик Ханс Адольф Кребс родился в Хильдесхайме (Германия), в семье оториноларинголога Георга Кребса и Алмы Кребс (Давид-сон). Начальное образование он получил в Андреанум-гимназии в Хильдесхайме. В 1937 г., изучая промежуточные стадии обмена углеводов, Кребс сделал второе важнейшее открытие в биохимии. Он описал цикл лимонной кислоты, или цикл трикарбоновых кислот, который в настоящее время называется циклом Кребса. Этот цикл представляет собой общий конечный путь распада углеводов, белков и жиров до углекислого газа и воды и является главным источником энергии для большинства живых организмов.
В 1953 г. Кребсу была присуждена Нобелевская премия по физиологии и медицине «за открытие цикла лимонной кислоты». Кребс разделил эту премию с Фрицем Липманом. В поздравительной речи исследователь из Каролинского института Эрик Хаммарстен сказал: «Цикл Кребса объясняет два одновременно происходящих процесса: реакции распада, при которых высвобождается энергия, и синтетические процессы, при которых эта энергия расходуется». На рисунке 3.2 представлен данный цикл в общем виде.
Рисунок 3.2 - Цикл трикарбоновых кислот
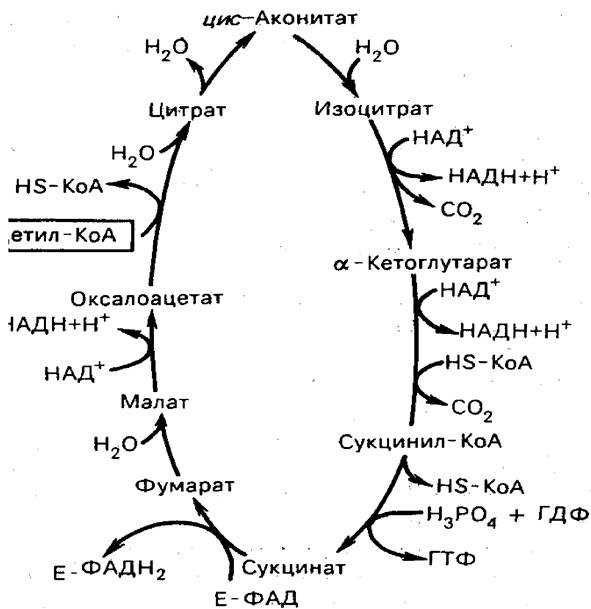
Полное «сгорание» как жирных кислот, так и углеводов требует окисления до СO2 и воды ацетильного остатка, связанного с коферментом А. Сгорание происходит в системе реакций, называемых циклом трикарбоновых кислот или цикле Кребса.
3.5.2 Стадии цикла трикарбоновых кислот
Ферменты ЦТК локализованы в матриксе митохондрий. Эта система реакций начинается с присоединения ацетильного остатка ацетилкофермента А к оксалоацетату (соль щавелевоуксусной или кетоянтарной кислот) с образованием соли трикарбоновой лимонной кислоты - цитрата. Далее цитрат претерпевает ряд последовательных превращений, сопровождающихся двумя актами декарбоксилирования, т. е. выделения СO2, и в конечном итоге приводящих к регенерации оксалоацетата.
Рассмотрим каждую стадию цикла трикарбоновых кислот.
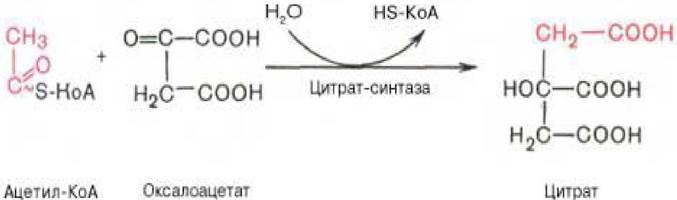
1. Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двух декарбоксилирований (отщепление СO2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т. е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СO2 и Н2O, а молекула оксалоацетата регенерируется. Первая реакция катализируется ферментом цитрат - синтазой (рисунок 3.3):
Рисунок 3.3 - Первая реакция цикла трикарбоновых кислот
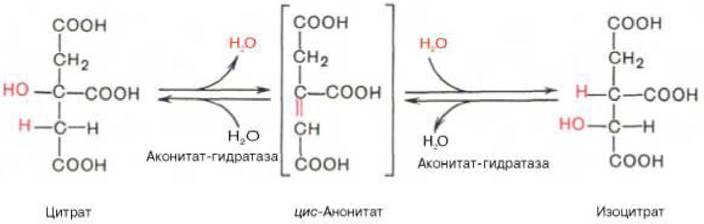
2. В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис - аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации - дегидратации фермент аконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата (рисунок 3.4):
Рисунок 3.4 - Вторая реакция цикла трикарбоновых кислот
3. Третья реакция. Изолимонная кислота дегидрируется в присутствии НАД - зависимой изоцитратдегидрогеназы. В ходе изоцитрат - дегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется (рисунок 3.5):
Рисунок 3.5 - Третья реакция цикла трикарбоновых кислот
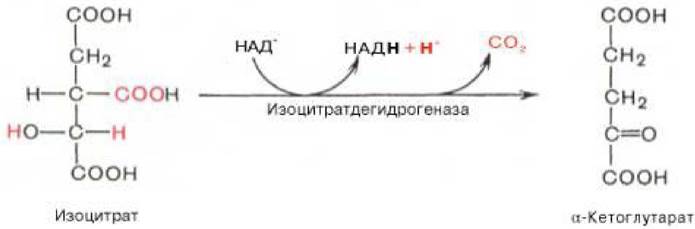
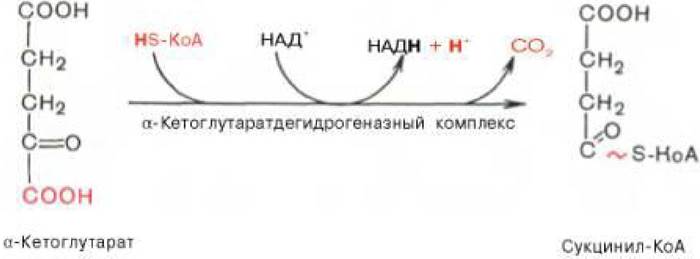
4. Во время четвертой реакции происходит окислительное декарбоксилирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил - КоА. В реакции принимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS - КоА, ФАД и НАД+ (рисунок 3.6):
Рисунок 3.6 - Четвертая реакция цикла трикарбоновых кислот
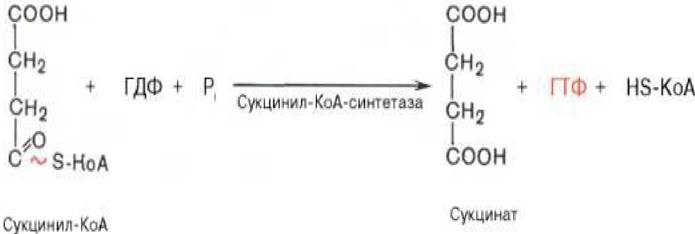
5. Пятая реакция катализируется ферментом сукцинил - КоА - синтетазой. В ходе этой реакции сукцинил - КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил - КоА (рисунок 3.7):
Рисунок 3.7 - Пятая реакция цикла трикарбоновых кислот
6. В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД (рисунок 3.8):
Рисунок 3.8 - Шестая реакция цикла трикарбоновых кислот

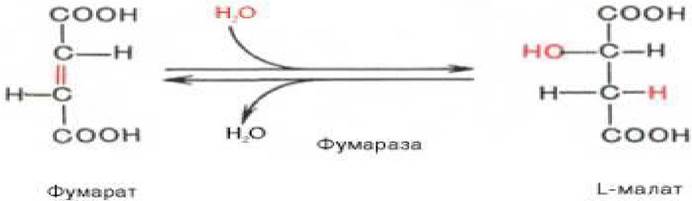
7. Седьмая реакция осуществляется под влиянием фермента фумаратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат) (рисунок 3.9):
Рисунок 3.9 - Седьмая реакция цикла трикарбоновых кислот
8. В ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД - зависимой малатдегидрогеназы происходит окисление L- малата в оксалоацетат (рисунок 3.10):
Рисунок 3.10 - Восьмая реакция цикла трикарбоновых кислот

Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление («сгорание») одной молекулы ацетил - КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил - КоА, а коферменты (НАД+ и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов в дыхательной цепи (в цепи дыхательных ферментов), локализованной в мембране митохондрий.
3.5.3 Итог цикла Кребса
Как отмечалось, одна молекула НАДН (3 молекулы АТФ) образуется при окислительном декарбоксилировании пирувата в ацетил - КоА.
При расщеплении одной молекулы глюкозы образуется 2 молекулы пирувата, а при окислении их до 2 молекул ацетил - КоА и последующих 2 оборотов цикла трикарбоновых кислот синтезируется 30 молекул АТФ (следовательно, окисление молекулы пирувата до СO2 и Н2O дает 15 молекул АТФ).
К этому количеству надо добавить 2 молекулы АТФ, образующиеся при аэробном гликолизе, и 6 молекул АТФ, синтезирующихся за счет окисления 2 молекул внемитохондриального НАДН, которые образуются при окислении 2 молекул глицеральдегид-3-фосфата в дегидрогеназной реакции гликолиза.
Следовательно, при расщеплении в тканях одной молекулы глюкозы по уравнению С6Н12О6 + 6O2 —> 6СO2 + 6Н2O синтезируется 38 молекул АТФ.
Несомненно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробный гликолиз.
Необходимо отметить, что образовавшиеся в процессе превращения глицеральдегид - 3 - фосфата 2 молекулы НАДН в дальнейшем при окислении могут давать не 6 молекул АТФ, а только четыре. Дело в том, что сами молекулы внемитохондриального НАДН не способны проникать через мембрану внутрь митохондрий.
При стационарном функционировании цикла трикарбоновых кислот никакие главные компоненты цикла не расходуются. Однако некоторые из них необходимы для осуществления биосинтетических процессов, например, для синтеза некоторых аминокислот и нуклеотидов.
Однако отдаваемые ими электроны могут включаться в митохондриальную цепь биологического окисления с помощью так называемого глицерофосфатного челночного механизма.
Контрольные вопросы по изучаемой теме
1. Какова история открытия цикла трикарбоновых кислот?
2. Какая последовательность реакций цикла трикарбоновых кислот?
3. Дайте характеристику каждой из восьми стадий цикла Кребса.
4. Биологическое значение цикла трикарбоновых кислот.
5. Регуляция цикла трикарбоновых кислот.
6. Что такое челночный механизм работы ферментов?
7. Сколько образуется молекул АТФ при расщеплении 1 молекулы глюкозы?
8. Как восстанавливаются кофакторы ферментов цикла Кребса?