Основы биохимии - Филиппович Ю. Б. 1999
Белки
Характеристика отдельных групп белков
Каталитически активные белки. Массовая расшифровка первичной и четвертичной структур каталитически активных белков (ферментов) и исчерпывающие сведения о третичной структуре некоторых из них позволили прийти к обобщениям, касающимся специфики строения белков, относящихся к этой группе, и связи последней с каталитической функцией этих белков. Не вдаваясь в детали (см. гл. III), отметим, что специфика строения ферментов сводится к следующему.
а-Спиральная и ß-складчатая структуры, представленные в том или ином количестве в их молекулах, тесно прилегая друг к другу и чередуясь, упаковываются в блоки, обладающие функциональной активностью. Даже неупорядоченные фрагменты полипептидной цепи частично, но своеобразно структурированы, образуя, например, ω-петли и другие квазиструктурные элементы. Радикалы аминокислот, несущие заряды, направлены, как правило, к поверхности глобулы, и только те из них, которые имеют функциональное значение и ассоциированы с другими полярными радикалами, ориентированы внутрь глобулы. В противоположность этому на поверхности глобулы обнаруживается ограниченное число гидрофобных радикалов аминокислот; большинство из них обращено внутрь молекулы, где они объединяются в одно или несколько гидрофобных ядер.
У многих белков-ферментов указанные ядра сходны и служат, если их несколько, центрами для формирования двух- или многоядерной белковой глобулы. Так построены многие ферменты-мономеры (см. рис. 34, структура рибонуклеазы и лизоцима). На границе двух (или более) оформленных или отчетливо не выраженных частей молекулы фермента располагается активный центр, локализованный в щели или впадине. Глубина, форма и размеры последней соответствуют пространственной структуре субстрата, чем обеспечивается специфичность действия каталитически активных белков.
Структура самого активного центра организована столь тонко, что делает возможным строго координированное в пространстве и во времени осуществление каталитического акта. Большинство ферментов располагает аллостерическими центрами, которые служат для контакта с аллостерическими регуляторами их активности. Большая часть каталитически активных белков обладает четвертичной структурой, которая в значительной мере предопределяет способность ферментов образовывать изоферменты; с изучением последних связана новая и увлекательная область ферментологии.
Перечисленные основные особенности строения ферментов показывают, что между структурой их молекул и способностью ускорять протекание соответствующих химических реакций существует теснейшая взаимосвязь, характерная именно для этой обширной группы белковых тел.
Белки-гормоны. Характерной особенностью этой группы белков является способность воздействовать на фундаментальные механизмы регуляции обмена веществ: проницаемость клеточных мембран и биосинтез вторичных посредников.
Изучены структура и биологическая активность нескольких десятков белковых гормонов (см. гл. XII). Молекулярные массы подавляющего их числа лежат между 20 000 и 30 000 Да. Самой важной особенностью белковых гормонов является наличие в составе их полипептидных цепей относительно небольших фрагментов (до нескольких десятков аминокислотных остатков), которые являются носителями гормональной активности, тогда как остальная часть полипептидной цепи несет какие-то иные функции, в частности видоспецифические. В составе белковых гормонов выявлены якорные площадки, обеспечивающие их соединение с рецептором гормона. Их вторичная структура дополняет или продолжает таковую рецептора гормона, в результате чего возникает комплементарно завершенный комплекс, необходимый и достаточный для формирования биологического сигнала.
Регуляторные белки. Исследование группы регуляторных белков осуществляется в последние годы необычайно интенсивно, так как их функциональная активность связана с репрессией и дерепрессией генома и регуляцией таких важнейших процессов, как рост, развитие и морфогенез растений и животных.
Одной из наиболее изученных подгрупп указанных белков являются гистоны (см. с. 81), локализованные в хроматине клеточных ядер, где они ассоциированы с ДНК. Гистоны, входящие в состав хроматина, не отличаются большим разнообразием и отнесены к пяти видам, которым различные авторы в разное время присвоили те или иные названия или индексы (табл. 9).
Таблица 9 Классификация, номенклатура и физико-химическая характеристика гистонов
|
Номенклатура |
||||||||
историческая |
по Иван я др. |
по Джонсу и Батлеру |
по Рассмуссену и др. |
современная |
предполагаемая по IUPAC |
Отношение лиз/арг |
Молекулярная масса |
Число аминокислотных остатков |
Лизиновые |
Богатые ала, очень богатые лиз |
f1 |
I |
Н1 |
КАР |
20 |
21000 |
215 |
|
Умеренно лизиновые |
Богатые лей |
f2а |
IIb1 |
Н2а |
LAK |
1,2 |
14500 |
129 |
Богатые сер |
f2b |
IIb1 |
Н2b |
KAS |
2,5 |
13800 |
125 |
|
|
Аргининовые |
Богатые глу и арг |
f3 |
III |
Н3 |
ARE |
0,7 |
15300 |
135 |
Богатые гли и арг |
f2fI |
IV |
Н4 |
GRK |
0,8 |
11300 |
102 |
|
Примечание. Трехбуквенная номенклатура гистонов основана на перечислении в их составе трех преобладающих аминокислот (в порядке убывания), где А — аланин, G — глицин, Е — глутаминовая кислота, К — лизин, L — лейцин, Р — пролин, R — аргинин, S — серин. Однако, несмотря на наглядность, она пока не получила распространения.
Первичные структуры гистонов из различных биологических объектов (эритроциты цыпленка, семенники карпа, зобная железа свиньи, теленка и быка, семена гороха и многие другие) выяснены и внутри каждого вида гистонов оказались весьма сходными, более того — консервативными, за исключением, пожалуй, гистона НІ, варьирующего как по молекулярной массе, так и по последовательности аминокислотных остатков.
Что касается вторичной и третичной структур гистонов, то они характеризуются присутствием коротких а-спиральных участков и доминированием неупорядоченной полипептидной цепи, образующей на участках, богатых основными аминокислотами, растянутую спираль с 2,5 аминокислотными остатками на виток и шагом в 0,8 нм.
Соединяясь с ДНК ионными связями и силами слабых взаимодействий, гистоны стабилизируют ее структуру. Естественно, что дестабилизация ДНК, необходимая для проявления ее матричной активности, осуществима лишь при ослаблении (в силу тех или иных причин) связей между ДНК и гистоном, чем и определяется регуляторная роль гистонов в функционировании генома. Согласно современным данным, первый уровень структуры хроматина реализуется в виде нуклеосом (см. гл. VI).
Другая подгруппа регуляторных белков, также локализованная в хроматине ядра клетки, — иегистоновые белки. Они изучены в гораздо меньшей степени, чем гистоновые. Эти белки крайне гетерогенны, так как при их фракционировании методами электрофореза и изоэлектрофокусирования в полиакриламидном геле обнаружено около 500 полипептидов с молекулярными массами от 5000 до 200 000 Да. Некоторая часть негистоновых белков активно участвует в дерепрессии генома, препятствуя образованию суперспирализованной ДНК на тех ее участках, где они присоединились в S-периоде цикла деления клетки.
Негистоновые белки группы высокой подвижности (HMG-белки), изученные в последние годы достаточно подробно, способствуют присоединению гистонов к ДНК, формированию нуклеосом и взаимодействию с хроматином гормон-рецепторных комплексов.
Перечень регуляторных белков, равно как и данные о соотношении их структуры и функций, непрерывно расширяются. К категории регуляторных белков относят: более десятка белковых факторов, участвующих в репликации ДНК (см. гл. VI); белки, ковалентно связанные с ДНК и РНК вирусов и фагов и инициирующие репликацию нуклеиновых кислот у них; более 50 ядерных белковых факторов, усиливающих или ослабляющих транскрипционные процессы (см. гл. VI), механизм узнавания которыми специфических последовательностей нуклеотидных остатков в молекуле ДНК при посредстве определенных олигопептидных фрагментов в составе белковых транскрипционных факторов все более проясняется; более двух десятков факторов инициации, элонгации и терминации, контролирующих этапы сборки полипептидных цепей при биосинтезе белков (см. гл. VII); белки теплового шока (а в более широком понимании — стрессовые белки), возникающие при тепловом и иных стрессовых воздействиях, защищающие клетки от повреждения и восстанавливающие метаболизм в них после снятия физиологического стресса; G-белки (некоторые из них получены в гомогенном виде и охарактеризованы), регулирующие биосинтез циклических аденозин- и гуанозинмонофосфатов — вторичных посредников при передаче гормональных и иных сигналов (см. гл. XIII); онкобелки, противоборство которых с антионкобелками приводит к злокачественному перерождению клеток; кейлоны и антикейлоны, имеющие отношение к регуляции пролиферации клеток.
Несомненно, что изучение структуры и функций перечисленных выше белков открывает перспективу познания наиболее глубоких основ регуляции процессов жизнедеятельности, в том числе на уровне генома; современные представления о типах взаимодействия регуляторных белков с ДНК показаны на рис. 41.
Защитные белки. К группе защитных белков принадлежат антитела — вещества белковой природы, вырабатываемые животным организмом в ответ на введение антигенов. Взаимодействуя с последними, они инактивируют их, защищая таким образом организм от воздействия чужеродных соединений, вирусов, бактерий, клеток и тканей. Для обозначения белков, синтезирующихся в организме в ответ на антигенное воздействие, предложен термин — иммуноглобулины (сокращенно Ig). Так как они впервые были обнаружены в медленно движущейся при электрофорезе белков сыворотке крови фракции у-глобулинов, их называют также у-иммуноглобулинами.
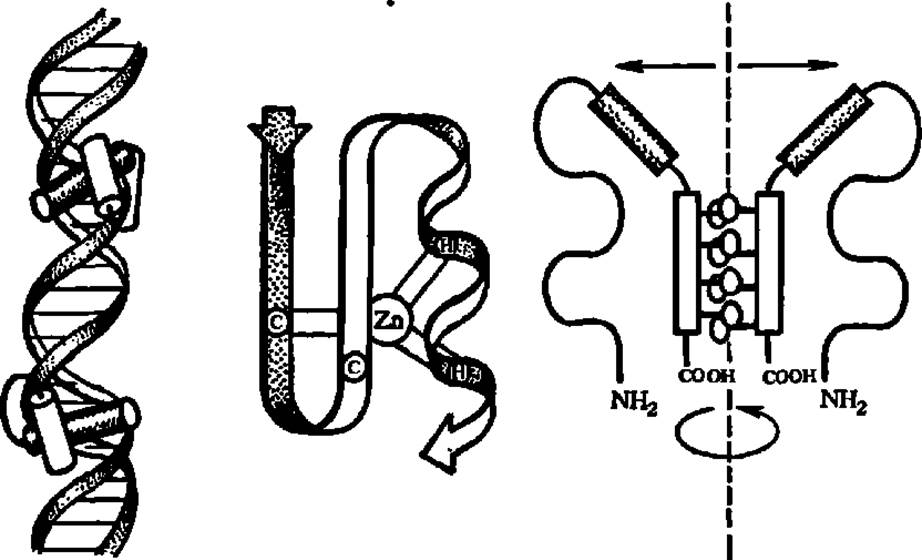
Рис. 41. Варианты связывания регуляторных белков с ДНК
В левой ластя рисунка перекрещенные а-спирали регуляторного белка взаимодействуют с симметрично расположенными центрами связывания в двойной спирали ДНК. локализованные в большом желобе ДНК. Узнающая а-спираль представлена тёмным цилиндром, а расположенная над ней другая а-спираль (белый цилиндр) помогает распознать связывающий центр. В средней части рисунка — ßß'a-надвторичная структура с атомом Zn в центре (связан с двумя остатками цистеина (С) ß-слоя и двумя остатками гистидина (Н) а a-спираля), обеспечивающая электростатический тип связи с ДНК за счет диполя в ßß'a-структуре (полярные области заштрихованы). В правой части рисунка — димер регуляторного белка, скрепленный, гидрофобной застежкой богатых лейцином а-cпиралей; пунктиром показана ось вращательной симметрии; заштрихованными прямоугольниками — высокоосноаные фрагменты, прямо взаимодействующие с ДНК, стрелками — парные полуцентры распознавания сайта связывания в ДНК
Согласно современной классификации, существует 5 видов иммуноглобулинов (IgG, IgM, IgA, IgD и IgE), структурные элементы молекул которых представлены легкими и тяжелыми полипептидными цепями (рис. 42). Их молекулярные массы лежат в пределах 150000—950 000 Да. Тяжелые цепи различных иммуноглобулинов обозначают строчными буквами греческого алфавита соответственно прописным буквам латинского алфавита, которые служат для указания вида иммуноглобулина, т. е. для IgG — у (гамма); IgM — μ (мю), IgA — а (альфа), IgD — δ (дельта) и IgE — ε (эпсилон). Тяжелые полипептидные цепи (Н-цепи, от англ. heavy — тяжелый) у разных видов иммуноглобулинов отличаются друг от друга. Наоборот, легкие полипептидные цепи (L-цепи, от англ. light — легкий) у разных иммуноглобулинов только 2 типов: и (каппа) и λ (ламбда). В свою очередь, у некоторых иммуноглобулинов отмечено существование подвидов, например IgG1, IgG2, IgG3и IgG4, в небольшой мере отличающихся друг от друга первичной структурой полипептидных цепей. Основную массу иммуноглобулинов сыворотки крови человека составляет IgG (75—85% от их суммы); IgA содержится в ней в количестве 7— 15%, IgM — 5—10%, IgD — 0 ,3 и IgE — 0,003% (тоже от суммы). IgA локализован, кроме того, в секретах (слеза, слюна, желчь, кишечный сок и т. п.) и лимфе.
Первичная структура тяжелых и легких цепей многих иммуноглобулинов выяснена: в тяжелых цепях зафиксировано от 439 до 450 (у-цепи) и от 568 до 576 (μ-цепи) аминокислотных остатков, а в легких — от 208 до 220. Удивительной особенностью является то, что как в легких, так и в тяжелых цепях иммуноглобулинов выявлены вариабельные зоны, расположенные преимущественно в первой половине цепи, т. е. со стороны аминогруппы. В отличие от этого первичные структуры легких и тяжелых цепей у различных иммуноглобулинов близки во второй их половине, т. е. со стороны С-концевой аминокислоты. Вариабельная часть молекулы ответственна за взаимодействие иммуноглобулинов с разнообразными антигенами, тогда как часть, отличающаяся относительным постоянством первичной структуры, выполняет общие для всех иммуноглобулинов функции (связывание комплемента, фиксация на мембранах).
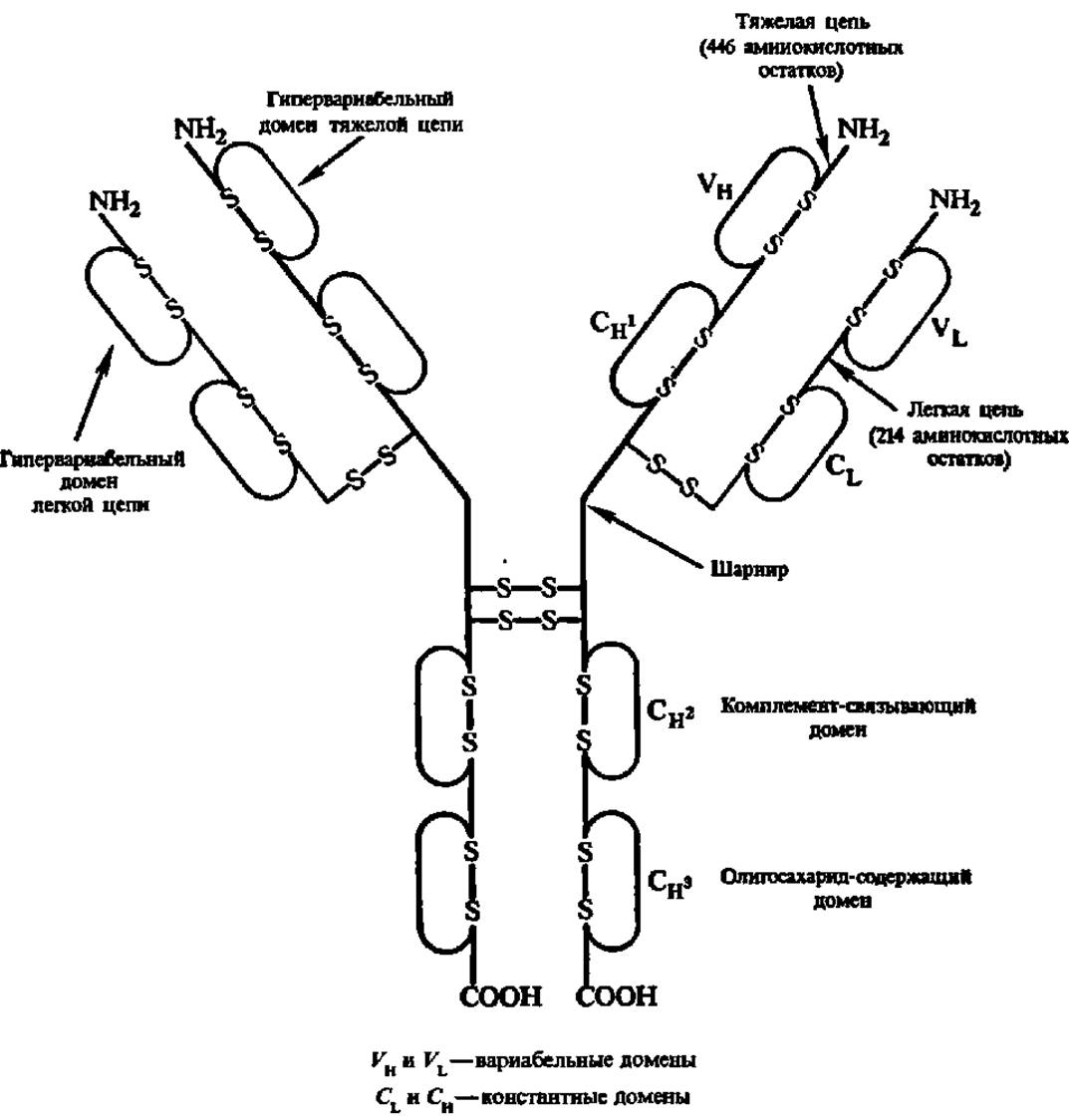
Рис. 42. Структура иммуноглобулина G1 человека
Две легкие и две тяжелые полипептидные цепи попарно связаны дисульфидными (—S—S—) - связями; в каждой из цепей ест» внутренние днсульфидные мостики, отграничивающие разнообразные домены; Сн1, Сн2, Сн3 — константные домены тяжелой цепи
Высшие параметры структуры у различных иммуноглобулинов еще более однотипны и получили название иммуноглобулиновой унаковки, характеризующейся стандартным расположением доменов по отношению друг к другу и общими закономерностями их пространственной ориентации.
Определенную роль в функционировании иммуноглобулинов играют углеводы, входящие в их состав в количестве от 2 до 12%. Они присоединяются к легким и тяжелом цепям иммуноглобулинов в основном по радикалам аспарагина и в некоторых случаях — треонина и представлены олигосахаридами, в состав которых входят N-ацетилглюкозамин, манноза, галактоза, фукоза и сиаловая кислота в соотношении, в большинстве случаев близком к 4:3:2:1:1.
Таким образом, в строении иммуноглобулинов удивительно тонко сочетается взаимосвязь структуры и функции и необыкновенно наглядно выступает специфика молекулярной организации белков, характеризующихся определенной, в данном случае защитной, биологической активностью.
Кроме иммуноглобулинов защитные функции выполняют белки системы свертывания крови, интерфероны, интерлейкины, белки-антифризы, гаптоглобины, антигены тканевой совместимости, лизоцимы, антивирусные белки растений и антибактериальные белки насекомых.
Токсические белки. Группа токсических белков в последние годы изучается весьма интенсивно ввиду ее большого практического значения.
С точки зрения первичной структуры наиболее полная информация получена о токсических белках змей: она расшифрована у нескольких десятков токсинов, полученных из ядов лесной, африканской, азиатской, египетской, королевской, мозамбикской, индийской и других видов кобры, африканской зеленой и черной древесных змей, морской змеи и др.
Крайне любопытно, что токсины ядов змей, характеризующиеся молекулярными массами от 6700 до 7000 Да, составлены в большинстве случаев из 60 аминокислотных остатков; примерно такую же величину имеют токсические полипептиды скорпиона, пчелы и осы; близки к ним (45 аминокислотных остатков) токсины из пшеничной муки (пуротонин А, летальный для пивных дрожжей), морских актиний и омелы белой (вискотоксины). В подавляющем большинстве они являются нейротоксинами, так как, взаимодействуя с холинэнергическими белками, блокируют передачу нервных импульсов. Их нейротоксическое действие зависит от третичной структуры, задаваемой в основном многочисленными (4—5) дисульфидными мостиками (см. структуру эрабутоксина на рис. 40).
Почти столь же детально изучены высокомолекулярные белковые токсины микроорганизмов и растений. Структура и механизм действия нескольких десятков из них выяснены. В одних случаях они представлены мультимерами (дифтерийный и холерный токсины, токсин шигеллы и др.), построенными из одной субъединицы типа А (20,0; 28,0 и 32,0 кДа соответственно) и пяти субъединиц типа В (25,0; 12,0 и 7,7 кДа соответственно). Контактируя с клеточной поверхностью субъединицами типа В, они вводят субъединицу типа А внутрь клетки, где она блокирует биосинтез белков на рибосомах. В других — двухкомпонентны (растительные токсины — рицин, абрин, модецин, лектин и др.), причем субъединица В связывается с рецепторами клетки и обеспечивает перенос субъединицы А внутрь ее, что приводит к инактивации 60S субчастицы рибосомы и прекращению синтеза белка. В третьих — одноцепочечныe (энтеротоксин из стафилококка, гемолизин из кишечной палочки, стрептолизин и др.) и их крупные полипептидные цепи (от 34 до 110 кДа) встраиваются в клеточную мембрану, образуют в ней поры, что сопровождается лизисом клетки. Здесь, как и в случае нейротоксинов, прослеживается тесная связь структуры и функции токсических белков.
Транспортные белки. Представителем транспортных белков является сывороточный альбумин. Он выделен в высокоочищенном состоянии, его получение налажено препаративно. Основной функцией этого белка является перенос различных веществ, особенно жирных кислот. Кроме высших жирных кислот, сродство к которым у сывороточного альбумина весьма высоко, он переносит разнообразные анионы и катионы. Сывороточный альбумин связывает до 50% кальция, находящегося в крови, служит переносчиком ионов меди из кишечника в печень, является носителем стероидных гормонов. Молекулярная масса сывороточного альбумина человека равна 65 000, изоэлектрическая точка (рІ) — 4,7 (при ионной силе 0,15). Он способен образовывать димеры с константой седиментации 6,7S. Первичная структура сывороточного альбумина человека, состоящего из 585 аминокислотных остатков, выяснена.
Из других белков сыворотки крови человека транспортными функциями обладают церулоплазмин (М = 160 000, рI = 4,4) — переносит ионы меди из печени в клеточные органеллы; трансферрин (М = 90000, рІ = 5,9) — переносит ионы трехвалентного железа; ß-липопротеин (М = 3 200 000, рI = 5,4) — переносит липиды, жирорастворимые витамины и гормоны; та же функция свойственна другим липопротеинам сыворотки крови. Липопротеины очень низкой плотности у человека ежесуточно переносят 25—50 г эндогенных триглицеридов, а другие их виды — холестерол, ß-каротин, фосфолипиды, углеводороды и ациклические спирты. Широко известными транспортными белками, переносящими кислород, являются гемоглобины позвоночных и ряда низших животных, гемоциаиины моллюсков, ракообразных, паукообразных и мечехвостов, гемэритрины (коричневые дыхательные белки) кольчатых червей, хлорокруорины (зеленые дыхательные белки) многощетинковых червей, гемованадины (содержащие ванадий) морских животных (оболочников).
Транспортные белки характерны не только для биологических жидкостей. В последние годы внимание исследователей особенно привлекли белки, встроенные в наружные и внутренние мембраны клеток и обеспечивающие перенос через них разнообразных низко- и высокомолекулярных веществ. Эти белки получили название порины, так как они образуют в мембранах поры, через которые идет транспорт. Некоторые из этих белков (порин I из наружной мембраны кишечной палочки—молекулярная масса 37205 Да, 340 аминокислотных остатков; порин из митохондрий печени крысы — димер из двух идентичных полипептидов и др.) выделены и охарактеризованы. Сюда же относятся белки — транслоказы, механизм переноса которыми веществ через мембраны ясен из рис. 43.
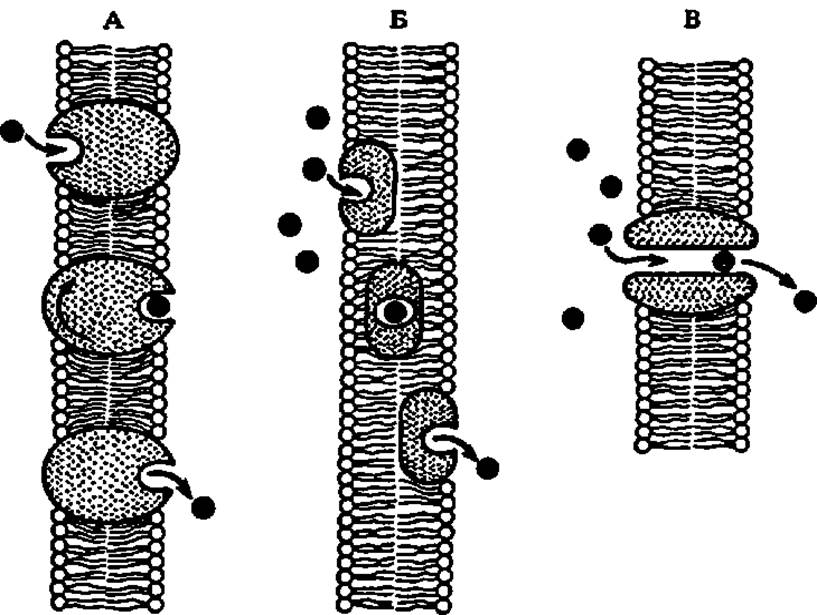
Рис. 43. Перенос веществ через мембраны при посредстве белков:
А — вращающийся белок-переносчик; Б — подвижный белок-переносчик; В — пора, образованная из белков-переносчиков
Структурные белки. Многочисленные и разнообразные белки несут в биологических объектах структурные функции.
Эту роль выполняют прежде всего белки, являющиеся компонентами различных биологических мембран, исключая, конечно, те из них, что обладают иной функциональной активностью (мембранносвязанные ферменты, поровые белки, белки переносчики, рецепторные белки и т. п.).
Данные о молекулярных массах структурных белков мембран противоречивы. У структурных белков митохондрий сердца и печени быка они составляют от 20000 до 60000, а у бактерий — от 10000 до 160000 Да. Структурные белки мембран отличаются резко выраженной способностью к агрегации. При pH 12 они существуют в виде мономеров, но при понижении значения pH олигомеризуются с образованием фибриллярных структур и микрокристаллов. Более того, они способны соединяться в стехиометрических соотношениях с другими белками (например, миоглобином) и особенно с ферментами, характеризующимися мембранной локализацией (цитохромами c1 и b, цитохромоксидазой, малатдегидрогеназой и др.), причем каталитическая активность последних при этом заметно изменяется. Поэтому полагают, что роль структурных белков мембран не ограничивается только лишь закреплением ферментов в мембране.
Свойства структурных белков мембран в определенной мере предопределяются их аминокислотным составом. В них содержатся в высокой пропорции аминокислоты, обладающие гидрофобными радикалами (глицин и аланин — 10—15%, валин, лейцин и изолейцин — в среднем 5—6% каждый, а в ряде случаев — до 9—13%), и сравнительно невелико содержание основных и кислых аминокислот. Но самое любопытное состоит в том, что гидрофобные аминокислоты образуют в полипептидной цепи структурных белков мембран локальные зоны (сегменты), включающие 20 и более остатков только гидрофобных аминокислот и занимающие в общем до 20% от длины всей полипептидной цепи. Это способствует возникновению гидрофобных центров в молекулах структурных белков мембран, в том числе центров, локализованных на поверхности глобулы. Указанное обстоятельство в известной мере объясняет высокую способность этих белков к агрегации, а также то, что субъединицы в олигомерах связаны силами слабых взаимодействий.
Из аминокислотного состава структурных белков мембран вытекает еще одно существенное следствие. Содержание в их составе аминокислот, препятствующих спирализации, таково, что доля а-спиральной структуры может составить в среднем 40% полипептидной цепи. Действительно, экспериментальные данные, полученные методом инфракрасной спектрофотометрии, дисперсии оптического вращения и кругового дихроизма, убеждают в том, что значительная часть полипептидной цепочки структурных белков мембран находится в а-спиральной форме (от 30 до 50%).
Наконец, еще одно специфическое свойство структурных белков мембран состоит в том, что все они независимо от источника выделения очень охотно связывают фосфолипиды при нейтральных значениях pH. Так как последние сохраняют при этом свой заряд, связывание структурных белков мембран и фосфолипидов идет за счет сил слабых взаимодействий, т. е. при посредстве гидрофобных центров белков и углеводородных радикалов фосфолипидов.
Кроме мембранных белков структурные функции несут белки межклеточного матрикса (коллаген, ретикулин), кристаллины, а также белки ядерного матрикса и цитоплазматического скелета. Число последних, частично или полностью охарактеризованных, достигло сейчас уже нескольких десятков и это одна из самых острых проблем современной белковой химии.
Сократительные белки. Сократительные белки локализованы как в мышечных клетках животных, так и в немышечных клетках примитивных и высокоорганизованных живых существ. К их числу относятся миксомиозин (нитевидный белок с диаметром молекулы 7,0 нм, выделенный из плазмодия гриба физарума); белки микротрубочек (диаметр субъединицы в трубочке 4,5—7,0 нм), обеспечивающих движение протоплазмы в растительных и животных клетках, миозино- и актомиозиноподобные белки фибриллярного аппарата амебы, ответственные за перетекание ее протоплазмы; белки трубчатых фибрилл, участвующих в движении хромосом в процессе деления клетки; белки центральных и периферических фибрилл жгутиков и ресничек простейших, а также жгутиков сперматозоидов; актин и миозин мышечных волокон.
Кроме контрактильных свойств, подавляющее большинство перечисленных выше сократительных белков обладает аденозинтрифосфатазной активностью, т. е. соединяет в себе два качества — способность совершать механическую работу и ускорять химическую реакцию. Это свойство сократительных белков было открыто в 1939 г. В. А. Энгельгардтом и М. Н. Любимовой, которые в октябрьском номере журнала «Nature» (т. 144, с. 688) опубликовали результаты своих опытов в статье под названием «Миозин и аденозинтрифосфатаза». Таким образом, эти белки характеризуются механохимическими свойствами. Общей особенностью, присущей сократительным белкам, является также то, что их функция зависит от действия ряда дополнительных белков — активаторов и регуляторов их активности и от присутствия низкомолекулярных соединений (Mg2+, Са2+, АДФ). Так, например, деятельность актомиозинового комплекса мышц регулируется тропомиозином и тропонином.
Конкретные сведения о сократительных белках, выделенных из тех или иных источников, отличаются различной степенью полноты и достоверности, а в. ряде случаев противоречивы. Наиболее изучены миозин и актин мышц. Миозин представляет собой волокнистый белок с молекулярной массой 500000 Да, а актин — глобулярный белок с молекулярной массой от 46000 до 58 000 Да (рис. 44). Первичная структура фрагмента цепи миозина протяженностью до 200 аминокислотных остатков, что составляет примерно десятую часть его полипептидной цепи, выяснена. Удалось расшифровать также первичную структуру актина из мышц кролика — белка, состоящего из 374 аминокислотных остатков. Актин обладает сильно выраженной способностью к агрегации, протекающей с образованием надмолекулярных структур в виде суперспирализованных длинных двойных нитей.
О других сократительных белках сведения менее полны. Миксомиозин имеет молекулярную массу около 6 000 000 Да и размеры молекул 7 х 400— 500 нм. Сократительный белок из ресничек простейших ближе к миозину мышц по молекулярной массе (400000), аминокислотному составу и свойствам. Однако контрактильный белок из фибрилл митотического веретена глобулярен (диаметр глобулы от 15 до 20 нм, М = 880 000); для него характерна субъединичная структура. Тубулин микротрубочек представлен димером с молекулярной массой 110000 Да.
Выяснение структуры и особенно механизма действия сократительных белков представляет огромный интерес и еще очень далеко от завершения.
Рецепторные белки. Выделение рецепторных белков в особую группу связано с интенсивным исследованием механизмов передачи информации в биологических системах.
Мишенью действия агентов, несущих сигнальные функции, являются рецепторные белки, локализованные в мембранном аппарате клетки. Одним из примеров может служить рецептор ацетилхолина — медиатора передачи нервного импульса (см. гл. III). Он представлен олигомерным белком (М = 285 000), составленным из пяти субъединиц (a2ßyδ), образующих ионный канал (рис. 45). В отсутствие ацетилхолина этот канал закрыт, но после рецепции секретируемого ацетилхолина он открывается на короткое время (до момента разрушения медиатора ацетилхолинэстеразой) и пропускает Na+, что сопровождается изменением степени поляризации клеточной мембраны и передачей сигнала через синапс нервной клетки.
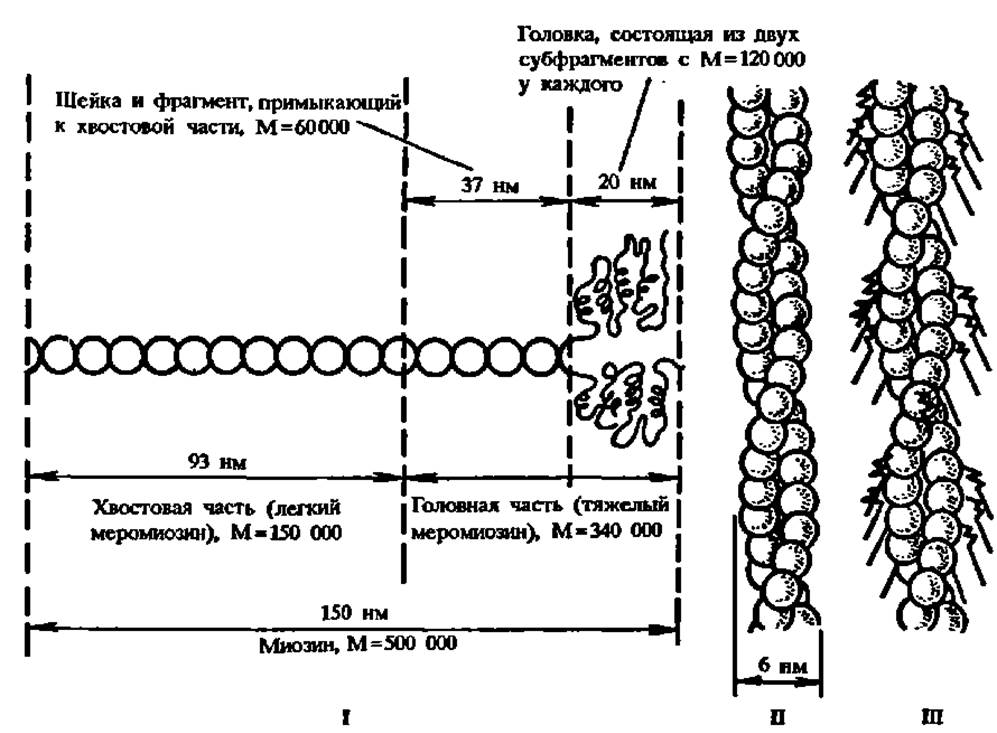
Рис. 44. Схема строения сократительных белков мышц:
1 — структура молекулы миозина, составленной из двух полипептидных цепей, включающих около 1800 аминокислотных остатков каждая. Большая часть молекулы представлена суперспиралью (горизонтальная часть рисунка), образованной двумя почти полностью спирализованными полипептидными цепями; меньшая — двумя фрагментами полипептидных цепей в глобулярном состоянии, где содержание а-спиралей достигает 30% (головка, ответственная за связывание актина и АТФазную активность). Хвостовая часть (легкий меромиознн) отчленяется от головной части (тяжелый меромиозии) в результате протеолитического расщепления трипсином. Глобулярная часть (головка) отщепляется при протеолизе папаином; II — суперспираль, составленная из глобул актина. Каждый шар на рисунке соответствует молекуле актина (М = 46 000); III — точка прикрепления головной части молекул миозина (показаны стрелками) к суперспирали актина в процессе мышечного сокращения
Рецепция того или иного вида энергии внешней среды органами чувств, как показали работы последнего времени, имеет единый механизм, складывающийся из двух этапов: 1) восприятия энергии стимула рецепторными белками; 2) преобразования энергии стимула особыми белковыми молекулами в специфическую информацию и передача ее в центральную нервную систему.
Сведения о рецепторных белках и механизме их взаимодействия с сигналами внешней среды весьма скудны. Представителем фоторецепторных белков является опсин, существующий в виде соединения с ретиналем (родопсин) и изменяющий свою конформацию, что связано с преобразованием светового сигнала в нервные импульсы в процессе зрительного акта (см. гл. IV, рис. 60). Из вкусовых рецепторных белков изучен сладкочувствительный белок (М = 150 000). Его аминокислотный состав характеризуется высоким содержанием дикарбоновых аминокислот и их амидов, лизина, лейцина, валина и пролина. Он способен связывать моносахариды и дисахариды. Обонятельный белок выделен из половых сенсилл самцов дубового шелкопряда; он взаимодействует с половым феромоном самок этого насекомого. В восприятии звуковых колебаний и их преобразовании в нервные импульсы придают большое значение холинорецепторным белкам, которые, как показано недавно, ответственны за проницаемость клеточной мембраны.
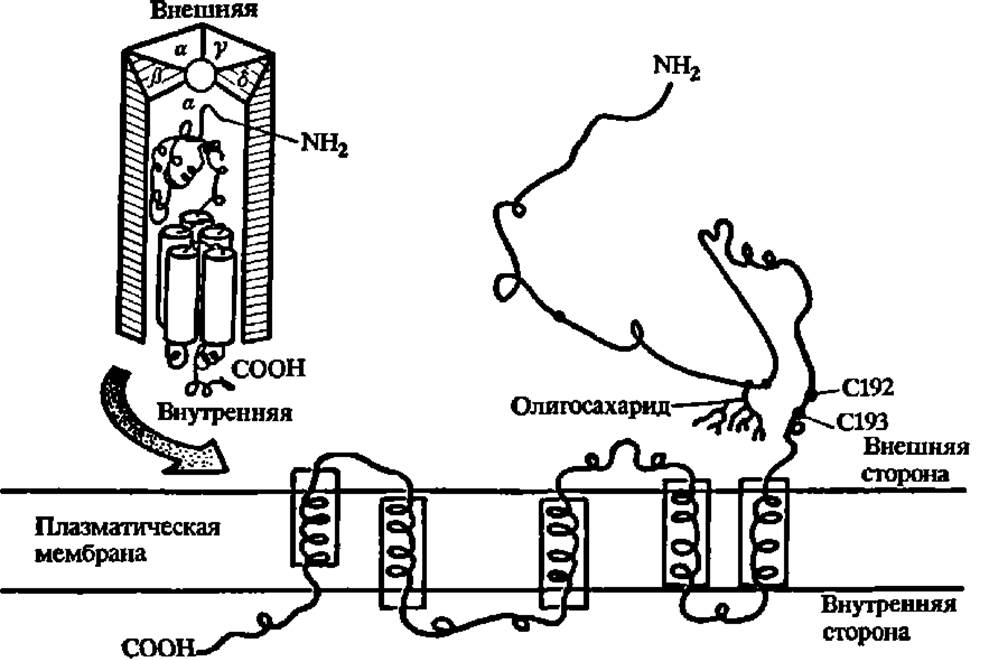
Рис. 45. Структура ацетилхолинового рецептора
В верхнем левом углу—олигомерная форма рецептора; показана пространственная структура а-субъединицы (М = 40000), входящей в состав пентамера; окружность в центре пентамера—ионный канал диаметром 0,65 нм. В нижней части рисунка — развернутая структура a-субъединицы рецептора, встроенной в плазматическую мембрану клетки; спиральные участки полипептидной цепи а - субъединицы обогащены гидрофобными аминокислотными радикалами, взаимодействующими с остатками высших жирных кислот фосфолипидной мембраны; с N-конца полипептидные цепи субъединиц гликозилированы и углеводная компонента в целом составляет примерно 20% массы рецептора; С192 и С193 — остатки цистеина, участвующие в рецепции ацетилхолина
Большие перспективы открываются при изучении рецепторных белков насекомых, особенно тех, которые осуществляют рецепцию аттрактантов и репеллентов.
Белки—ингибиторы ферментов. Вещества белковой природы составляют самую многочисленную группу ингибиторов ферментов, причем наиболее изучены из ее состава белки, ингибирующие активность протеаз. Белковые ингибиторы образуют с протеолитическими ферментами стойкие при физиологических условиях комплексы, в составе которых фермент полностью или частично теряет свою активность. Так как константы диссоциации этих комплексов лежат в пределах 10-12—10-9 моль, они действительно отличаются высокой прочностью, а ингибиторы, входящие в их состав, — большой мощностью действия.
Выделено и изучено несколько десятков белковых ингибиторов, подавляющих активность трипсина, химотрипеина, карбоксипептидазы, калликреина, эластазы, плазмина и других протеолитических ферментов. Многие из них получены в гомогенном кристаллическом состоянии. Молекулярные массы ингибиторов белковой природы колеблются от нескольких тысяч до нескольких сотен тысяч, но в основном они представлены белками с молекулярными массами около 6000 Да. Многие из белков — ингибиторов ферментов — являются гликопротеинами. Первичная структура нескольких десятков ингибиторов расшифрована; среди них—ингибиторы трипсина I и II из поджелудочной железы свиньи и быка, соевых бобов, арахиса и фасоли, ингибиторы протеиназ из яда гадюки, лимских бобов и ананаса, ингибитор химотрипсина из картофеля, инактиватор калликреина (тразилол) из легких быка, ингибитор субтилизина из стрептомицета и др.
Белки вирусных оболочек. Из многочисленных вирусов выделены и изучены разнообразные белки. Их молекулярные массы колеблются от нескольких тысяч до нескольких десятков тысяч дальтон. Наряду с основной функцией (защита нуклеиновой кислоты) некоторые белки вирусных оболочек необходимы для созревания вирусных частиц, обладают ферментативной активностью (нейраминидаза, лизоцим и обратная транскриптаза в составе ряда вирусов) и др.
Первичная структура белковых субъединиц многих вирусов выяснена. К их числу относятся субъединицы трех штаммов вируса табачной мозаики (159 аминокислотных остатков), субъединицы бактериофагов fr и f2 (129 остатков), бактериофага Qβ (131 остаток), бактериофага ZІ (50 остатков), субъединицы вируса желтой мозаики турнепса (190 остатков) и вируса ядерного полиедроза тутового шелкопряда (244 остатка), субъединицы бактериофага fd (50 остатков), а также ряд белков вируса гриппа (гемагглютинин — 566 и PV2 - 759 аминокислотных остатков).
Удивительной особенностью вирусных белков является их способность к агрегации, вследствие чего даже в отсутствие вирусных нуклеиновых кислот они способны к самосборке в соответствующие, характерные для данного вируса морфологические структуры (тени вирусов и фагов). Кроме того, их структура такова, что концевые аминокислоты, как правило, маскированы в глубине молекулы и труднодоступны для определения.
Белки с иными функциями. Несомненно, что и далее из крайне многочисленных конкретных представителей класса белков могут вычленяться новые группы с ясно выраженной функциональной активностью и связанной с нею спецификой структуры и свойств. Так, например, уже сейчас обособляются группа гемоглобинов, группа фибриллярных белков, группа рибосомальных белков и др. Это лишь подтверждает высказанное выше мнение о том, что классификация белков переживает сейчас период становления.