Основы биохимии - Филиппович Ю. Б. 1999
Нуклеиновые кислоты и их обмен
Строение и свойства нуклеиновых кислот
Химия нуклеиновых кислот в последнее время развивается необычайно быстрыми темпами, что связано с коренным пересмотром взглядов на биологическую роль этих соединений. Представление о нуклеиновых кислотах как об инертных структурных элементах ядра и цитоплазмы оставлено навсегда, так как нуклеиновым кислотам принадлежит очень важная роль в обеспечении специфического синтеза биополимеров в организме человека, животных, растений и микробов.
К нуклеиновым кислотам относят высокомолекулярные соединения, характеризующиеся определенным элементарным составом и распадающиеся при гидролизе на пуриновые и пиримидиновые основания, пентозу и фосфорную кислоту. Особенно характерно для нуклеиновых кислот содержание Р (8— 10%) и N (15—16%). Нуклеиновые кислоты содержат также С, Н и О.
Нуклеиновые кислоты были впервые выделены Ф. Мишером более столетия тому назад (1869) из ядер клеток гноя в виде соединения с белком — нуклеира (от лат. nucleus — ядро), а сам термин предложен А. Косселем в 1889 г. К концу прошлого века они были получены Р. Альтманом (1899) в свободном от белка состоянии из животных тканей и дрожжей, а в 1936 г. А. Н. Белозерским с сотр. — из растительного материала.
Выделение нуклеиновых кислот. Большая часть нуклеиновых кислот в растительных, животных и бактериальных клетках находится в соединении с белками. Поэтому, кроме разрушения клеточных оболочек путем гомогенизации биологического материала, для выделения нуклеиновых кислот необходимо разорвать связь между нуклеиновой кислотой и белком. Это достигается обработкой материала крепким раствором соли, например 10%-ным раствором NaCl. Одновременно осуществляется извлечение нуклеиновых кислот. После удаления твердого остатка нуклеиновые кислоты осаждают из охлажденного до 0° С раствора этанолом или раствором трихлоруксусной кислоты. Осадок нуклеиновых кислот отделяют центрифугированием, тщательно промывают и высушивают.
Кроме того, применяют фенольный метод выделения нуклеиновых кислот, при помощи которого можно получать их нативные препараты. Для этого измельченную в гомогенизаторе при охлаждении ткань заливают водонасыщенным раствором фенола, энергично встряхивают смесь в течение 1 ч и центрифугируют ее. При этом содержимое центрифужной пробирки разделяется на четыре четко отграниченных друг от друга разных по консистенции и цвету слоя. В верхнем, водном, слое и подстилающем его вязком слое белого цвета сосредоточена основная масса нуклеиновых кислот. В третьем, желеобразном, прозрачном, желтоватом слое находится фенол с растворенными в нем белками. Четвертый, самый нижний, слой коричневого цвета содержит остатки ткани, денатурированные белки и ничтожную примесь нуклеиновых кислот. Так как в процессе выделения нуклеиновых кислот этим методом удается избавиться от значительной части белков (протеинов), указанную процедуру называют фенольной депротеинизацией.
Освободить препараты нуклеиновых кислот от белка можно также путем обработки их солевого экстракта двойным объемом хлороформа, содержащего немного изоамилового спирта; после тщательного перемешивания в течение 15 мин до получения стойкой эмульсии смесь центрифугируют и отделяют верхнюю водную фазу, содержащую нуклеиновые кислоты (денатурированный белок остается на границе водного и хлороформного слоев); нуклеиновые кислоты из водной фазы осаждают двойным объемом охлажденного этанола.
Полученные так суммарные препараты нуклеиновых кислот фракционируют далее, используя более тонкие методы, такие, как хроматография, в том числе аффинная, фильтрация через гели агарозы и сефарозы, распределение в двухфазных полимерных системах, ультрацентрифугирование, электрофорез и др. Большинство этих методов рассмотрено в гл. II и при работе с нуклеиновыми кислотами отличается лишь в деталях. В итоге получают препараты индивидуальных нуклеиновых кислот.
Выделение из биологических объектов давно уже не является единственным методом получения нуклеиновых кислот. Наряду с ним широкое распространение получил их химический синтез. Разработка химических и инженерных подходов позволила создать автоматические синтезаторы нуклеиновых кислот, отличающиеся высокой производительностью и надежностью. Так, одна из марок синтезаторов фирмы ЛКБ (Швеция) обеспечивает автоматическую сборку молекул нуклеиновых кислот длиной до 160 звеньев при десятиминутной длительности каждого цикла.
Особенно важен химический синтез нуклеиновых кислот для получения генов, их фрагментов, регуляторных участков нуклеиновых кислот и т. п. Первый синтез гена аланиновой транспортной рибонуклеиновой кислоты был осуществлен в 1972 г. Г. Корана. Сейчас число синтезированных генов достигло нескольких десятков. В СССР синтезированы ген человеческого интерферона а2 (М. Н. Колосов и др., 1982), ген валиновой транспортной РНК (М. Н. Колосов и др., 1983), ген кальцитонина человека (А. А. Баев и др., 1985), ряд промоторов и др.
Химический состав. При нагревании нуклеиновых кислот с хлорной кислотой они распадаются на структурные единицы, из которых построены их громадные молекулы. Другие кислоты, как, например, НСl, вызывают очень резкую деструкцию нуклеиновых кислот с выделением NH3, свидетельствующим о разрушении входящих в их состав структурных элементов.
Среди структурных элементов нуклеиновых кислот найдены пиримидиновые основания, пуриновые основания, углеводы и фосфорная кислота.
Пиримидиновые основания являются производными гетероциклического соединения — пиримидина:
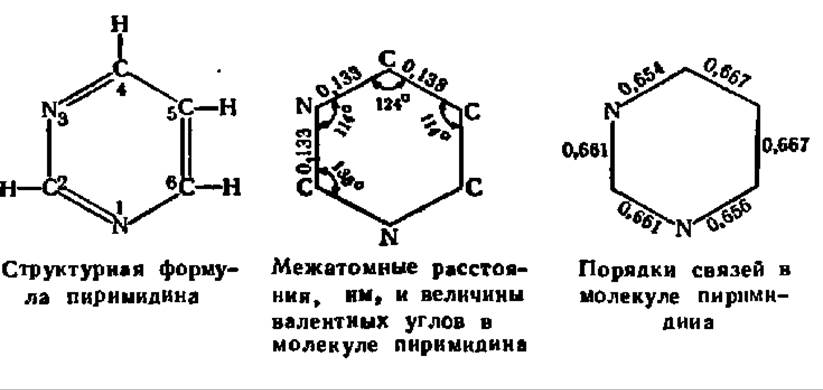
Приведенная здесь структурная формула в виде шестичленного цикла с чередующимися двойными связями является, как и в случае бензола, лишь данью истории. В действительности, как можно заключить из сопоставления межатомных расстояний, в молекуле пиримидина нет ни типичных двойных типичных простых связей, а имеет место взаимодействие 71-электронов всех составляющих цикл атомов. Мерой взаимодействия п-электронов служит так называемый порядок связи, характеризующий силу сопряжения п-электронов двух соседних атомов. В случае типичной двойной связи силу взаимодействия п-электронов, т. е. порядок связи, принимают за единицу. В результате делокализации п-электронов в молекулах с сопряженными двойными связями, как, например, в рассматриваемой молекуле пиримидина, порядки связей принимают дробные значения. Чем больше значение порядка связи, тем сильнее выражена ее способность к реакциям присоединения.
В составе нуклеиновых кислот найдены следующие производные пиримидина (пиримидиновые основания): цитозин, урацил, тимин, 5-метил цитозин и 5-оксиметилцитозин:
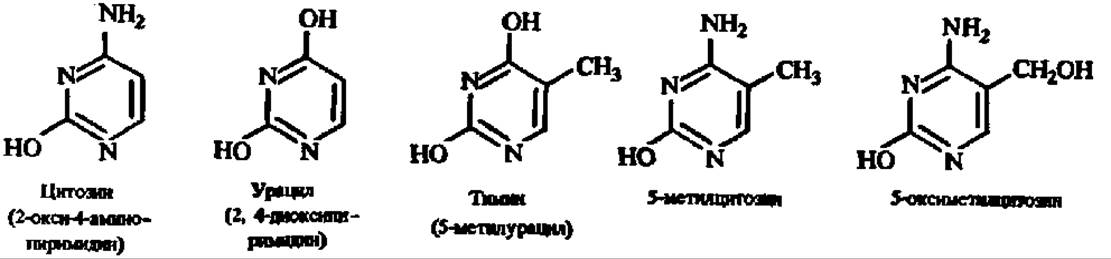
Цитозин, урацил и тимин содержатся в нуклеиновых кислотах в значительных количествах, а 5-метилцитозин и 5-оксиметилцитозин — в ничтожных и далеко не всегда. Поэтому они называются минорными (экзотическими) основаниями. По аналогии с редкими аминокислотами в составе белков их можно было бы назвать иногда встречающимися в составе нуклеиновых кислот основаниями. В последние годы список минорных оснований пиримидинового ряда, обнаруженных в составе нуклеиновых кислот, пополнился (табл. 15).
Пуриновые основания нуклеиновых кислот являются производными бициклического гетероцикла — пурина:
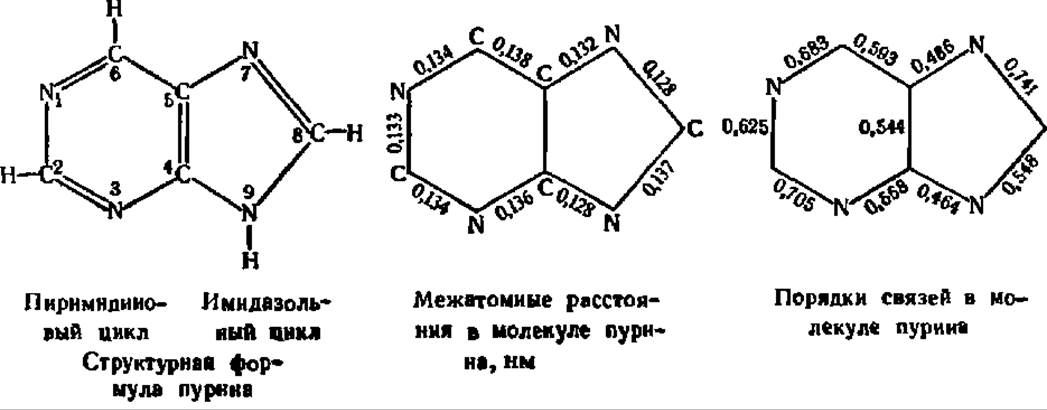
Здесь, как и в случае пиримидинового цикла, расстановка в формуле простых и двойных связей условна. Как межатомные расстояния, так и порядки связей в молекуле пурина указывают на высокую степень сопряжения п-электронов атомов С и N, составляющих пуриновый цикл.
В гидролизатах нуклеиновых кислот всегда обнаруживаются два производных пурина — аденин и гуанин:
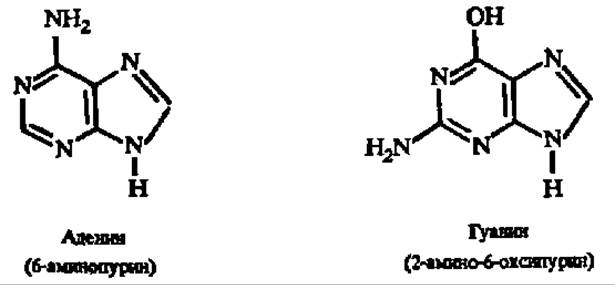
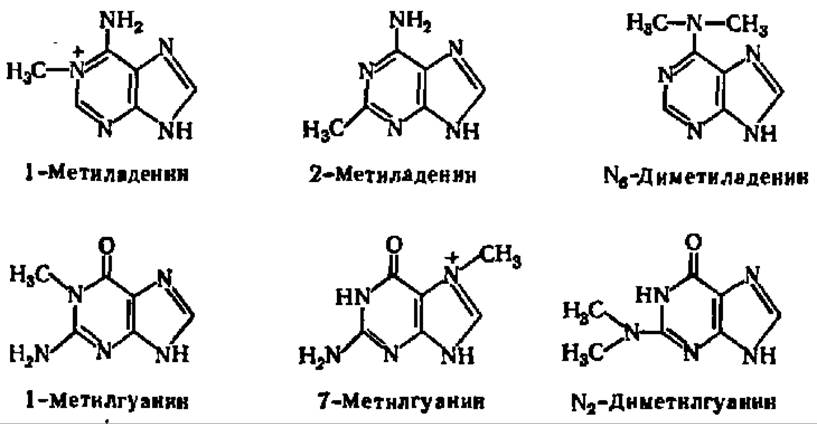
Кроме того, в составе нуклеиновых кислот найдено большое число минорных пуриновых оснований — метилированных производных аденина и гуанина (табл. 15):
Важной особенностью оксипроизводных пиримидина и пурина является возможность их таутомерных (лактам-лактимных) превращений, например:
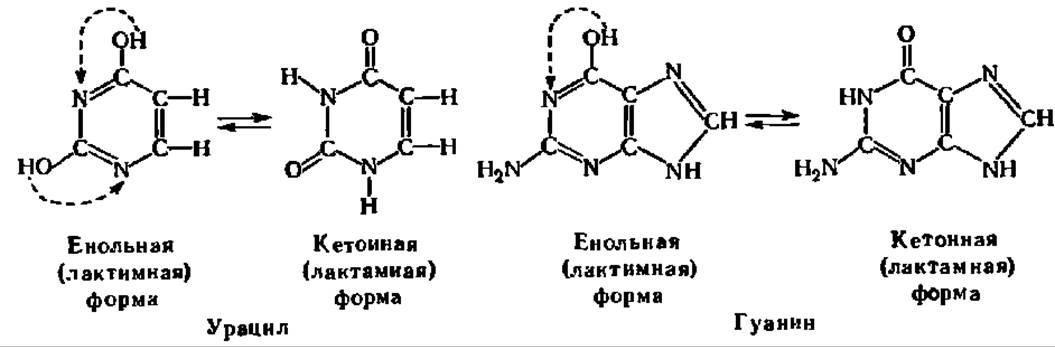
Благодаря этому, в частности, пиримидиновые основания по 1-му атому N лактамной формы вступают во взаимодействие с углеводами, найденными в составе нуклеиновых кислот.
Углеводная составляющая нуклеиновых кислот представлена двумя весьма сходными моносахаридами правого ряда: рибозой и дезоксирибозой. В свободном состоянии эти моносахариды существуют во всех возможных таутомерных формах, возникающих за счет кольчато-цепной таутомерии. В составе
нуклеиновых кислот оба моносахарида находятся в ß-D-рибофуранозной форме:
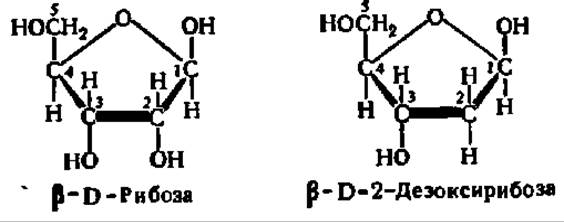
По сравнению с ß-D-рибозой второй моносахарид (ß-D-2-дезоксирибоза) является соединением, восстановленным по 2-му углеродному атому. Так как в процессе восстановления происходит отнятие гидроксильной группы, то полученное производное называют дезоксирибозой, причем цифра 2 указывает номер углеродного атома рибозы, у которого гидроксильная группа заменена на атом Н.
Недавно выяснено, что рибоза и дезоксирибоза не является единственными углеводами, входящими в состав нуклеиновых кислот: в ряде фаговых ДНК и ДНК некоторых видов раковых клеток найдена глюкоза.
Изучение продуктов гидролиза нуклеиновых кислот привело к важному выводу: состав продуктов гидролиза нуклеиновых кислот, выделенных из разных источников, неодинаков. Впервые это было обнаружено при сравнении состава нуклеиновых кислот, выделенных из зобной железы (тимус) теленка (тимонуклеиновая кислота) и дрожжей (дрожжевая нуклеиновая кислота). В дальнейшем было показано, что им соответствует два типа нуклеиновых кислот, отличающихся по составу, строению и функциям. В соответствии с характером углеводной компоненты одна из них была названа дезоксирибонуклеиновой кислотой (ДНК), другая — рибонуклеиновой кислотой (РНК). Между ДНК и РНК существуют и иные черты сходства и различия по составу (табл. 15).
Таблица 15 Состав нуклеиновых кислот
Химическое соединение |
ДНК |
РНК |
|
Пуриновые основания |
Аденин |
Аденин |
Гуанин |
Гуанин |
|
Пиримидиновые основания |
Цитозин |
Цитозин |
Тамин |
Урацил |
|
Углеводы |
Дезоксирибоза Глюкоза (иногда) |
Рибоза |
Неорганическое вещество |
Фосфорная кислота |
Фосфорная кислота |
Минорные основания |
||
Пуриновые |
N6-Метиладенин |
N6-Метиладенин |
1-Метилгуанин |
N6-Диметиладенин |
|
3-Метилгуанин |
1-Метиладенин |
|
7-Метилгуанин |
2-Метиладенин |
|
N2-Meтиглуанин |
2-Метилтио-N6-изопентениладенин |
|
N2-Диметилгуанин |
N2-Метилгуанин |
|
N2-Диметилгуанин |
||
1 -Метилгуанин |
||
7-Метилгуанин |
||
Пиримидиновые |
5-Метилцитозин 5-Оксиметилцитозин Оксиметилурацил Урацил |
5-Метилцитозин 5-Оксиметилцитозин N4-Метилцитозин 3-Мегилцитозин 3-Метилурацил Тимин 5-Метиламиноэтил-2-тиоурацил Дигидроурацил |
Как видно из данных табл. 15, ДНК и РНК отличаются также и по качественному составу пиримидиновых оснований: для первой характерно наличие тимина, для второй —урацила. Особенно разительны различия в минорных пуриновых и пиримидиновых основаниях ДНК и РНК: последняя содержит гораздо более богатый (более 50) их набор.
Наметилась тенденция связывать наличие и распределение в ДНК и РНК минорных метилированных оснований с рядом важнейших функций нуклеиновых кислот: взаимодействием их с белками, в том числе с рядом ферментов, кодированием и передачей информации о биосинтезе макромолекул, участием в механизме памяти и старения организма, регуляцией биосинтеза нуклеиновых кислот и др.
Молекулярная масса, содержание и локализация в клетке ДНК и РНК; виды ДНК и РНК. Молекулярную массу ДНК определяют в основном гидродинамическим и электронно-микроскопическим методами, хотя это можно делать, измеряя светорассеяние растворов ДНК и некоторыми другими способами.
В основе гидродинамического метода лежит линейная зависимость константы седиментации ДНК, определяемой при ультрацентрифугировании растворов ДНК, от ее молекулярной массы, которую можно установить по калибровочной кривой или рассчитать по формуле: 0,4451gM = 1,819 + 1g(s°20,ω - 2,7), где s°20,ω — константа седиментации, приведенная путем экстраполирования к бесконечному разведению (s°), стандартной температуре (20° С) и вязкости воды (ω).
Электронно-микроскопический метод определения молекулярной массы ДНК основан на измерении длины вытянутых молекул ДНК. Известно, что на 0,1 нм протяженности ее молекулы приходится масса, равная 197 Да. Умножая эту величину на экспериментально найденную длину молекулы ДНК, получают значение ее молекулярной массы.
Выделить нативную ДНК из клеток эукариот необыкновенно трудно, так как еще не создано соответствующих методов, позволяющих избежать разрыва выделяемых молекул ДНК. Поэтому надежные цифры получены только для ДНК вирусов и фагов (табл. 16); из них проще извлечь ДНК, осторожно сняв белковую оболочку.
Как видно из табл. 16, молекулярные массы вирусных и фаговых ДНК измеряются десятками и сотнями миллионов дальтон. Можно полагать, что молекулярная масса ДНК эукариот значительно выше. Об этом свидетельствует молекулярная масса ДНК, выделенной с необходимыми предосторожностями из самой большой хромосомы плодовой мушки—дрозофилы. Вся ДНК хромосомы представлена одной молекулой с М = 40 ∙ 109.
Содержание ДНК в клетках организма определенного вида отличается необыкновенным постоянством, тогда как межвидовые различия по этому показателю достаточно велики. Количество ДНК в клетке измеряется пикограммами (10 12 г), колеблется от 0,01 пг у кишечной палочки до нескольких пикограммов в гаплоидных клетках высших организмов.
Таблица 16 Молекулярные массы вирусных н фаговых ДНК
|
Объект |
Молекулярная масса, млн. дали он |
|
Гидродинамический метод |
Электронно-микроскопический метод |
|
Бактериофаг fd |
1,9 |
— |
Вирус полиомы |
— |
3,2 |
Аденовирус |
21 |
24 |
Бактериофаг Т7 |
23—28 |
22—28 |
» Т5 |
66 |
67 |
» Т2 |
123 |
105—119 |
» Т4 |
111—І31 |
116—152 |
В зависимости от места локализации ДНК в клетке различают ядерную, митохондриальную, хлоропластную, центриольную и эписомальную ДНК. Ядерная ДНК у эукариот резко превалирует над ДНК других субклеточных структур. Так, в митохондриях обнаружено от 0,5 ∙ 10-16 до 5 ∙ 10-16 г ДНК, в хлоропластах — от 10-16 до 150 ∙ 1016 г, а в центриолях — 2 ∙ 10-16 г, что составляет несколько процентов от ядерной ДНК. В таком же соотношении находится содержание ДНК в бактериальной хромосоме и эписомах — внехромосомных, самостоятельно реплицирующихся детерминантах наследственности у микроорганизмов, обеспечивающих перенос генетической информации, например, об устойчивости к антибиотикам (иначе их называют 11-факторами, т. е. факторами резистентности). Обсуждается вопрос о существовании экстрахромосомной ДНК, транспортируемой, или коммуникационной, ДНК, цитоплазматической мембранной ДНК, мелкодисперсной сверхскрученной ДНК. По функциональному назначению различают рибосомальную ДНК (рДНК) и сателлитную ДНК (стДНК).
Кроме внутриклеточной ДНК, существует также ДНК, входящая в состав вирусов и фагов. Количество ее в вирусах и фаговых частицах значительно ниже, чем в клетках бактерий (тысячные доли пикограмма и менее).
Молекулярные массы РНК определяют теми же методами, что и ДНК, но, кроме того, используют электрофорез в полиакриламидном геле, так как пробег РНК в геле обратно пропорционален их молекулярным массам. Что касается содержания и локализации РНК в клетках, то оно не отличается ни однообразием, ни стабильностью: в клетках, где идет интенсивный биосинтез белков, содержание РНК в несколько раз превышает таковое ДНК (например, в печени крысы РНК в 4 раза больше, чем ДНК), но там, где синтез белка мал, соотношение ДНК и РНК может быть обратным (например, в легких крысы РНК в 2 раза меньше, чем ДНК).
По функциональному значению и молекулярным массам, равно как и по локализации в клеточном содержимом, РНК делят на следующие виды.
1. Транспортные РНК (тРНК) отличаются сравнительно невысокими значениями молекулярных масс (17 000—35 000), локализованы в гиалоплазме клетки, ядерном соке, бесструктурной части хлоропластов и митохондрий. Они осуществляют кодирование аминокислот и перенос их в рибосомальный аппарат клетки в процессе биосинтеза белков.
2. Рибосомальные РНК (рРНК) характеризуются в основном большими молекулярными массами (550000—700000 у РНК 30—40S субчастиц рибосом, 1,1 ∙ 106 — 1,7 ∙ 106 у РНК 50—60S субчастиц рибосом, но 40000 у 5S РНК и ~ 50 000 у 5,8S РНК из рибосом); локализованы в рибосомах, являясь их структурной основой и выполняя в них разнообразные функции.
3. Информационные, или матричные, РНК (мРНК) обладают молекулярными массами, варьирующими в широких пределах (от 300000 до 4 ∙ 106). Возникая в форме высокомолекулярных предшественников в ядре клетки или на ДНК других субклеточных частиц, мРНК (в виде рибонуклеопротеинов) перемещаются к рибосомам; в составе последних они выполняют матричную функцию в процессе сборки полипептидных цепей.
4. Вирусные РНК отличаются разнообразными и высокими молекулярными массами, лежащими в основном в пределах нескольких миллионов дальтон. Они являются составными частями вирусных и фаговых рибонуклеопротеинов, несут всю информацию, необходимую для размножения вируса в клетках хозяина.
В современной литературе обсуждается вопрос о целесообразности выделения в отдельные категории еще нескольких видов РНК; ядерной, хромосомной, митохондриальных, низкомолекулярных регуляторных, антисмысловых.
Строение структурных элементов нуклеиновых кислот. При осторожной обработке РНК водным раствором щелочи (например, 1 н. NaOH или КОН в течение 18 ч при комнатной температуре) они распадаются на структурные единицы, каждая из которых состоит из пуринового или пиримидинового основания, рибозы и остатка фосфорной кислоты. Еще лучше этот процесс распада осуществляется при действии специфических биокатализаторов, например рибонуклеазы. ДНК, в противоположность РНК, устойчивы к действию разбавленных растворов щелочей при обычной температуре. Поэтому гидролиз ДНК до структурных единиц, каждая из которых составлена из пуринового или пиримидинового основания, дезоксирибозы и фосфорной кислоты, удается осуществить только в присутствии специального катализатора биологического происхождения — дезоксирибонуклеазы. Кислоты, как минеральные (НСl, НСlO4 и др.), так и органические (НСООН и др.) для такого рода гидролиза неприемлемы, так как они деструктируют и РНК, и ДНК до свободных пуриновых и пиримидиновых оснований, углевода и фосфорной кислоты. Из гидролизатов нуклеиновых кислот составляющие их структурные единицы были впервые выделены в 1908 г. П. Левиным и Дж. Манделем, которые назвали их нуклеотидами. При гидролизе РНК образуются рибонуклеотиды, при гидролизе ДНК — дезоксирибонуклеотиды.
Пуриновые или пиримидиновые основания, рибоза или дезоксирибоза и фосфорная кислота связаны в молекулах нуклеотидов совершенно однотипно. Химическое строение нуклеотидов и их полные и сокращенные названия таковы:
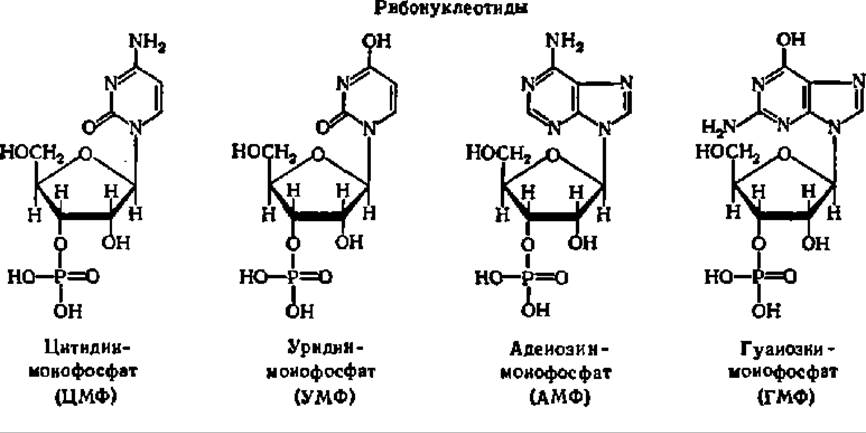
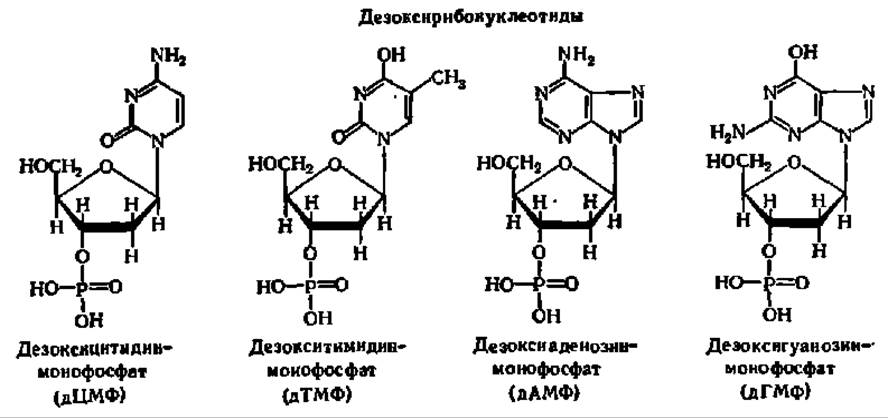
Названия индивидуальных рибо- и дезоксирибонуклеотидов принимаются по характерному пуриновому или пиримидиновому основанию, а наличие дезоксирибозы отмечается приставкой «дезокси». Так как остаток фосфорной кислоты в природных нуклеотидах присоединен к остатку рибозы (или дезоксирибозы) по гидроксильной группе при 3-м или 5-м углеродном атомах, существует два типа нуклеотидов:
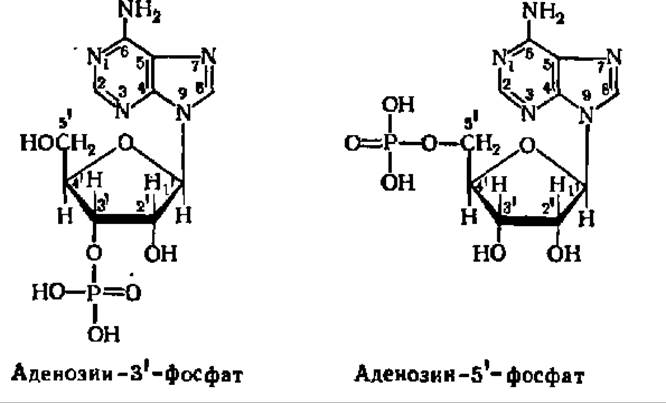
Чтобы указать местонахождение остатка фосфорной кислоты в молекуле нуклеотида, нумеруют углеводные атомы в остатке рибозы. Во избежание путаницы с соответствующей нумерацией атомов в пуриновых или пиримидиновых основаниях эти цифры отмечают знаком «'».
Конфигурация молекулы одного из нуклеотидов представлена на рис. 65. Как можно видеть из рисунка, проекционная формула молекулы цитидин-3'-фосфата (как и других нуклеотидов), выписанная с учетом истинной конфигурации молекулы этого соединения, значительно отличается от общепринятой проекционной формулы. Это необходимо учитывать при рассмотрении строения нуклеиновых кислот.
При отщеплении от нуклеотида остатка фосфорной кислоты получается еще более простое соединение — нуклеозид. Этот термин был впервые предложен П. Левиным и В. Джекобсом в 1909 г. для обозначения углеводных производных пуринов, выделенных из РНК. Впоследствии он был распространен на соединения углеводов с пиримидинами. Наименования нуклеозидов складываются из названий пуриновых или пиримидиновых оснований и соответствующих окончаний. В приведенных выше структурных формулах нуклеотидов легко найти части, соответствующие нуклеозидным остаткам, а в названиях нуклеотидов — отличить ту часть, которой обозначен остаток нуклеозида. Следовательно, нуклеотиды являются фосфорными эфирами нуклеозидов. Все сказанное в полной мере относится к дезоксинуклеотидам и дезоксинуклеозидам.
Так как нуклеозидфосфаты представляют довольно сильные кислоты, их часто называют цитидиловой, уридиловой, адениловой и гуаниловой кислотами.
Характерные для каждого вида нуклеиновых кислот мононуклеотиды, объединяясь в количестве нескольких сотен, а иногда и тысяч в единую молекулу, образуют громадные полинуклеотидные цепи (см. ниже).
Таким образом, по своему химическому строению нуклеиновые кислоты являются полирибонуклеотидами (РНК) и полидезоксирибонуклеотидами (ДНК). Соединение нуклеотидных остатков в молекулах РНК и ДНК осуществляется одним и тем же путем: сложноэфирными мостиками, образуемыми между парами нуклеотидов остатками фосфорной кислоты. Последние связаны всегда с 3-м углеродным атомом рибозы (или дезоксирибозы) одного нуклеотидного остатка и с 5-м углеродным атомом рибозы (или дезоксирибози) другого, как это видно из приведенных выше изображений фрагментов молекул ДНК и РНК. Если мысленно завершить структуру изображенных выше фрагментов ДНК и РНК концевыми нуклеотидами, то при 5'-углеродном атоме остатка дезоксирибозы в случае ДНК (или рибозы в случае РНК) окажется остаток фосфорной кислоты, а на противоположном конце цепи у 3'-углеродного атома остатка дезоксирибозы (или рибозы) — гидроксильная группа. Эти нуклеотидные остатки образуют 5'- и 3'-концы молекул ДНК и РНК. Первый, т. е. 5'-концевой, нуклеотид принято считать началом молекулы нуклеиновой кислоты, а второй, т. е. 3'-концевой, нуклеотид — ее концом.
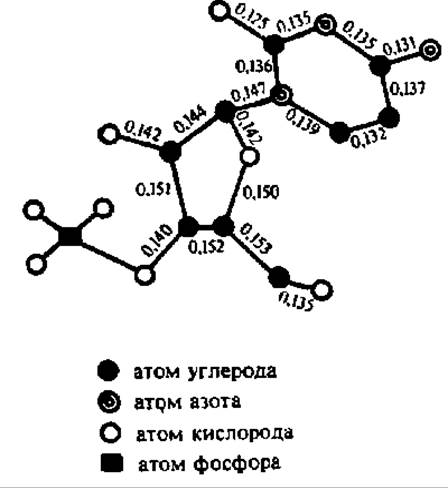
Рис. 65. Проекционная формула молекулы цитидин-3-фосфата:
расстояния между атомами даны н нанометрах; атомы водорода не обозначены
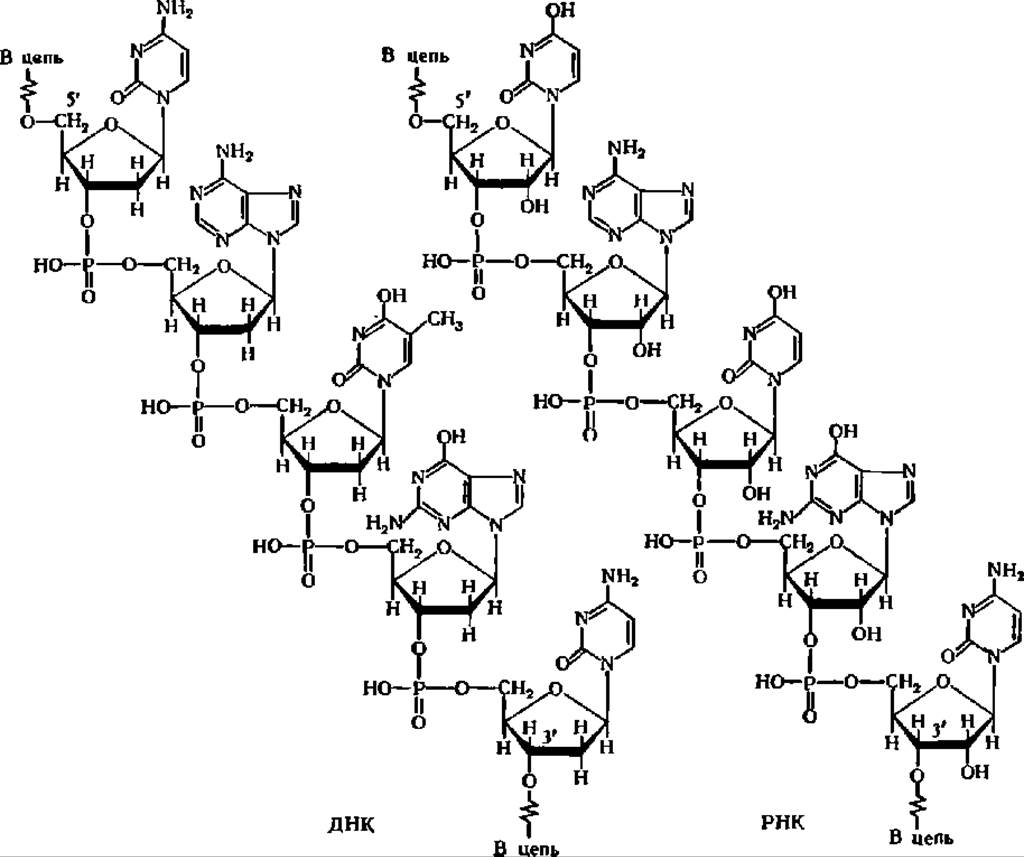
Строение фрагментов молекул ДНК н РНК
Для сочетания нуклеотидных остатков в полинуклеотидные цепи характерно то, что гидроксил у 2-го углеродного атома рибозы никогда не вовлекается в образование эфирного мостика с остатком фосфорной кислоты при синтезе нуклеиновых кислот. Следовательно, и в ДНК, и в РНК существуют связи через остаток фосфорной кислоты только от 3-го к 5-му углеродному атому углевода. Никаких разветвлений цепи ни в ДНК, ни в РНК не обнаружено.
В зависимости от молекулярной массы нуклеиновой кислоты коэффициент поликонденсации, т. е. число нуклеотидных звеньев, связанных в единую полинуклеотидную цепь, варьирует в широких пределах. Если принять среднюю молекулярную массу нуклеотидного остатка равной 330, то для молекул ДНК коэффициент поликонденсации выразится десятками и сотнями тысяч звеньев, а для РНК — всего лишь десятками, сотнями и в некоторых случаях — тысячами звеньев.
Нуклеотидный состав ДНК и РНК. В табл. 17 и 18 приведены отдельные примеры соотношения пуриновых и пиримидиновых оснований в ДНК и РНК некоторых организмов.
Таблица 17 Нуклеотидный состав ДНК
|
Источник нуклеиновой кислоты |
Молярные cooтношения основании. % |
Г+А Ц+Т |
Г+Ц A+T |
|||
Г |
А |
Ц |
Т |
|||
Животные |
||||||
Мышь |
21,9 |
29,7 |
22,8 |
25,6 |
1,07 |
0,81 |
Осьминог |
17,6 |
33,2 |
17,6 |
31,6 |
1,03 |
0,54 |
Растения |
||||||
Пшеница |
23,8 |
25,6 |
24,6 |
26.0 |
0,98 |
0,94 |
Лук |
18,4 |
31,8 |
18,2 |
31,3 |
1,02 |
0,58 |
Микроорганизмы |
||||||
Туберкулёзная палочка |
34,2 |
16,5 |
33,0 |
16.0 |
1,03 |
2,08 |
Стрептококк |
16,6 |
33,4 |
17,0 |
33,0 |
1,00 |
0,51 |
Таблица 18 Нуклеотидный состав суммарной РНК
|
Источник нуклеиновой кислоты |
Молярные соотношения оснований, % |
Г+А |
Г+Ц |
|||
Г |
А |
Ц |
У |
Ц+У |
А+У |
|
Животные Крыса |
32,8 |
18,7 |
29,6 |
18,9 |
1,06 |
1,66 |
Комар |
23,5 |
30,6 |
19,7 |
26,1 |
1,18 |
0,76 |
Растения |
||||||
Пшеница |
30,8 |
25,2 |
25,4 |
18,6 |
1,27 |
1,28 |
Сосна |
27,6 |
25,3 |
23,4 |
23,7 |
1,12 |
1,04 |
Микроорганизмы |
||||||
Туберкулезная палочка |
33,0 |
22,6 |
26,1 |
18,3 |
1,25 |
1,45 |
Стафилококк |
28,7 |
26,9 |
22,4 |
22,0 |
1,25 |
1,05 |
Буквами в них обозначены основания: Г — гуанин, А — аденин, Ц — цитозин, Т — тимин, У — урацил, а цифры выражены в молярных процентах (мол. %), т. е. в процентах от суммы всех найденных в нуклеиновой кислоте азотистых оснований, содержание каждого из которых вычислено в препарате нуклеиновой кислоты в молях или его долях.
Анализ таких данных позволил Е. Чаргаффу сформулировать ряд правил (правила Чаргаффа):
1. У ДНК молярная сумма Г и А (пуриновые основания) равна молярной сумме Ц и Т (пиримидиновые основания). Эта закономерность не свойственна РНК, где отношение пуриновых и пиримидиновых оснований изменяется в широких пределах.
2. В молекулах ДНК число остатков А всегда равно числу остатков Т. В таком же отношении находятся Г и Ц. В молекулах РНК этого нет, хотя во многих случаях молярные соотношения оснований близки (здесь имеется в виду, что Т и У в молекулах ДНК и РНК равноценны).
3. Отношение суммы молярных концентраций Г и Ц к сумме молярных концентраций А и Т у ДНК и А и У у РНК ![]() у обоих видов нуклеиновых кислот сильно варьирует. Особенно широки границы изменчивости этого показателя в ДНК.
у обоих видов нуклеиновых кислот сильно варьирует. Особенно широки границы изменчивости этого показателя в ДНК.
Две первые закономерности в строении ДНК и РНК связывают с особенностями их вторичной структуры. Подобно тому как в стабилизации спиральной формы белковых молекул решающая роль принадлежит водородным связям между —СО- и —NH-группами, так и в создании вторичной структуры полинуклеотидной цепи исключительное значение имеют водородные связи, возникающие между парами оснований: А и Т (в РНК—А и У) и Г и Ц (в обоих видах нуклеиновых кислот). Основания, образующие пары, в которых они сочетаются водородными связями, называются комплементарными.
Характер водородных связей между комплементарными основаниями ясен из рис. 66. С одной стороны, водородные связи замыкаются между аминогруппами и кетогруппами, занимающими определенное положение в молекулах пуриновых и пиримидиновых оснований (6-аминогруппа у А и 4-кетогруппа у Т или У, а также 2-амино- и 6-кетогруппы у Г и 2-кето- и 4-аминогруппы у Ц). В этом и состоит комплементарность, т. е. дополнительность в химическом строении пуриновых и пиримидиновых оснований: там, где у пуринового основания расположена аминогруппа, у пиримидинового находится кетогруппа, и наоборот. С другой стороны, водородные связи образуются за счет взаимодействия по атомам N и NH-группам, занимающим в пуриновых и пиримидиновых циклах 1-е и 3-е положения соответственно, где они опять дополняют друг друга. Именно поэтому в ДНК число молей А равно числу молей Т, а число молей Г равно таковому Ц. Естественно, что суммарное содержание пуринов и пиримидинов одинаково.
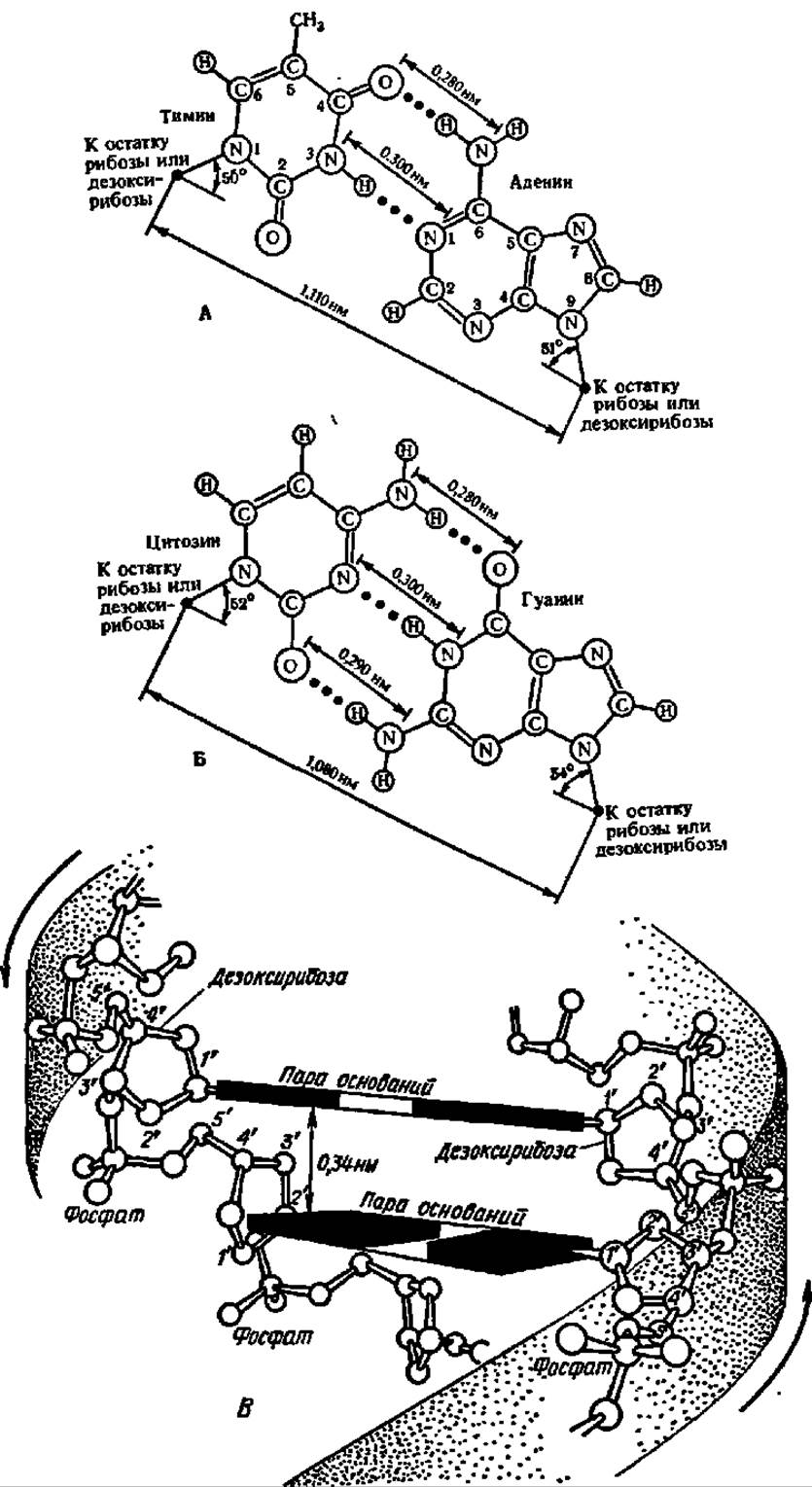
Рис. 66. Водородные связи между парами оснований в нуклеиновых кислотах:
А — между аденином и тимином; Б — между гуанином и цитозином; В — между парами комплементарных оснований в биспиральном фрагменте молекулы ДНК; стрелками указан анти параллельный ход спиралей в виде заштрихованных лент
Третья закономерность в соотношении пуриновых и пиримидиновых оснований связана со специфичностью ДНК и РНК. Поэтому отношение ![]() называется коэффициентом специфичности нуклеиновых кислот.
называется коэффициентом специфичности нуклеиновых кислот.
Установлено, что ДНК обладает ясно выраженной видовой специфичностью. Особенно резкие видовые различия характерны для ДНК, выделенных из
микроорганизмов. У РНК видовая специфичность отношением ![]() выражена слабее. В табл. 17 и 18 приведены значения коэффициентов специфичности для ряда тотальных ДНК и РНК. Несмотря на небольшое число произвольно выбранных объектов, эти таблицы наглядно иллюстрируют сформулированные выше закономерности. В общем, коэффициент специфичности у ДНК варьирует от 0,45 до 2,57 у микроорганизмов, от 0,58 до 0,94 у высших растений и от 0,54. до 0,81 у животных. У тотальной РНК коэффициент специфичности, как правило, выше единицы.
выражена слабее. В табл. 17 и 18 приведены значения коэффициентов специфичности для ряда тотальных ДНК и РНК. Несмотря на небольшое число произвольно выбранных объектов, эти таблицы наглядно иллюстрируют сформулированные выше закономерности. В общем, коэффициент специфичности у ДНК варьирует от 0,45 до 2,57 у микроорганизмов, от 0,58 до 0,94 у высших растений и от 0,54. до 0,81 у животных. У тотальной РНК коэффициент специфичности, как правило, выше единицы.
Долгое время для определения нуклеотидного состава ДНК и РНК использовали разделение нуклеотидов, нуклеозидов или свободных азотистых оснований, полученных в результате деструкции исследуемых нуклеиновых кислот, при помощи хроматографических методов с последующим спектрофотометрическим анализом природы и содержания каждого из оснований. Однако в последнее время классические методы анализа нуклеотидного состава нуклеиновых кислот заменены физическими методами. Так, содержание ГЦ- пар в составе ДНК сейчас находят по температуре плавления ДНК и по ее плавучей плотности. В первом случае содержание ГЦ-пар связано с температурой плавления (tпл) ДНК следующей зависимостью: ГЦ (мол. %) = (tпл—69,3) ∙ 2,44. Эта зависимость справедлива, если ДНК растворена в стандартном солевом растворе (0,15 моль NaCl и 0,015 моль цитрата натрия в 1 л, pH 7,0). Во втором случае содержание ГЦ-пар прямо пропорционально значению плавучей плотности ДНК, определяемой при ее ультрацентрифугировании в градиенте плотности CsCl.
Физические методы ускорили процесс накопления фактического материала по нуклеотидному составу ДНК разных биологических видов и позволили добавить к правилам Чаргаффа новые закономерности, выявленные А. Н. Белозерским и его учениками.
Оказалось, что вариабельность нуклеотидного, состава ДНК очень высока у эволюционно древних таксонов и сравнительно мала у молодых, т. е. на основании нуклеотидного состава можно судить об эволюционном возрасте таксона. Кроме того, в природе распространены два типа ДНК: у хордовых и беспозвоночных животных, высших растений, дрожжевидных организмов, синезеленых водорослей, ряда бактерий и вирусов преимущественно АТ-тип ДНК, а у недрожжевидных грибов, актиномицетов, водорослей и ряда бактерий и вирусов в основном ГЦ-тип. Наконец, распределение метилированных оснований у представителей животного и растительного царства тоже не случайно. Так, 5-МЦ в значительном количестве присутствует в ДНК высших растений (2—10 мол. %) и ряда животных (до 3 мол. %), тогда как в ДНК бактерий его очень мало (менее 0,5 мол. %). N6-MA, напротив, найден у бактерий и водорослей, обнаруживается в малых количествах у растений и отсутствует у многих животных. Все это заложило основы для дальнейшей разработки проблем химической таксономии.
Выявленные закономерности в соотношении пуриновых и пиримидиновых оснований в молекулах ДНК и РНК свидетельствовали о том, что чередование нуклеотидных остатков в нуклеиновых кислотах носит специфический характер. Однако указанные данные не дали и не могли дать представлений об истинной последовательности расположения структурных элементов, составляющих молекулы нуклеиновых кислот, т. е. об их первичной структуре.
Первичная структура ДНК. Даже в простейшем случае бактериофага fd (см. табл. 16), ДНК которого представлена одноцепочечным полидезоксирибонуклеотидом с М = 1,9 ∙ 10 6. Да, в ней должно содержаться примерно 5760 нуклеотидных остатков (1900000:330, где 330 — средняя молекулярная масса нуклеотидного звена), выстроенных в строго определенной последовательности.
Определить первичную структуру такого огромного полидезоксирибонуклеотида крайне трудно, так как он состоит всего из четырех видов нуклеотидных остатков, содержащих в качестве азотистых оснований А, Г, Ц и Т, сравнительно редко метилированных. В случае ДНК большей молекулярной массы положение еще сложнее. Тем не менее благодаря разработке в период между 1975 и 1977 гг. двух весьма перспективных методов определения первичной структуры ДНК удалось достичь решающих успехов в этом отношении.
Первый из них, предложенный Ф. Сангером и Р. Коулсоном, состоит в получении полного набора убывающих по числу нуклеотидных остатков копий одноцепочечной ДНК при помощи ДНК-полимеразной реакции (см. с. 249), разделении их электрофорезом в полиакриламидном геле (по числу наблюдаемых полос устанавливают число нуклеотидных остатков в ДНК или ее фрагменте) и выявлении положения дезоксиадениловых, дезоксигуаниловых, дезоксицитидиловых и дезокситимидиловых остатков на 3'-конце каждого из фрагментов при помощи особых приемов.
Второй, разработанный А. Максамом и В. Гильбертом, сводится к химической модификации пуриновых и пиримидиновых оснований в ДНК или ее фрагментах, избирательном расщеплении фосфодиэфирных связей по месту модифицированных оснований, разделении продуктов расщепления электрофорезом в полиакриламидном геле и прямому считыванию структуры фрагмента ДНК с полученных электрофореграмм (число полос на электрофореграмме продуктов расщепления фрагмента ДНК с модифицированным азотистым основанием равно числу нуклеотидных остатков, содержащих этот пурин или пиримидин, а их положение на электрофореграмме указывает место этого нуклеотидного остатка в анализируемом фрагменте ДНК).
В результате применения указанных методов в их оригинальном или модифицированном виде определение первичной структуры ДНК в последние несколько лет приняло массовый характер (табл. 19).
В табл. 19 приведена лишь небольшая часть известных в настоящее врeмя первичных структур ДНК. На 1.1.1985 г. были получены данные о первичной структуре 4175 соединений полинуклеотидной природы, составленных из 3 млн. н. о. Всего за 2,5 года, к августу 1987 г., число расшифрованных первичных структур нуклеиновых кислот возросло до 14 020 при 14855147 н. о. в их составе. На апрель 1993 г. Gen Bank содержал информацию о последовательности нуклеотидных остатков в 111911 полинуклеотидах, собранных из 129968 355 н. о., в том числе о расположении 2353 635 н. о. в геноме кишечной палочки (50% генома). Все это позволило поставить в настоящее время фантастическую задачу — определить полную первичную структуру генома человека, включающего 3 млрд, нуклеотидных пар (н. п.). По расчетам эта программа обойдется в 3 млрд, долларов и займет несколько лет. Она уже осуществляется у нас (правительственная научноисследовательская программа «Геном человека»), в США и Японии. Цель ее — не только выявить локализацию генов (они составляют 5—10% генома), но и понять механизмы регуляции их деятельности, а также наметить пути устранения дефектов в них, приводящих к наследственным болезням. При уже достигнутой скорости секвенирования ДНК до 280 000 н. п. в сутки и планируемой до 1 млн. н. п. в сутки (имеется в виду использование флуоресцентно-меченной ДНК и суперкомпьютерной техники, а также применение октадезоксинуклеотидов заданного строения) решение этой задачи приобретает реальные очертания, тем более что стоимость чтения одного нуклеотида уже упала с 1 доллара до нескольких центов. Реальные результаты уже налицо: если к 1975 г. была выяснена первичная структура всего 25 генов человека, то к 1985 г. их число составило 900, а к 1992 г. достигло 3618. На четвертой научной конференции, посвященной оценке хода работ по программе «Геном человека» (Черноголовка, 9—11 марта 1994 г.) был дан анализ вклада российских ученых в ее выполнение.
Таблица 19 Число нуклеотидных пар (п.п.) в ДНК некоторых геномов и генов с полностью установленной первичной структурой
Геном |
Число н.п. |
Ген |
Число н.п. |
Грам-положительной бактерии Bacillus subtilis |
4214810 |
Эмбрионального глобина человека |
11376 |
Спирохеты Borrelia burgdorferi, штамм В31 |
910725 |
Яичного альбумина |
7564 |
Вируса Эпштейна-Барра |
172282 |
Гормона роста |
2600 |
Хлоропласта табака |
155844 |
ß-субъединицы ДНК-полимеразы сальмонеллы1 |
1986 |
Хлоропласта печеночного мха |
121024 |
ДНК-лигазы фага Т41 |
1469 |
Аденовируса |
35937 |
Инсулина человека |
1430 |
Митохондрий человека и быка |
16659 |
Токсина шигеллы1 |
1380 |
Вируса мозаики капусты |
8031 |
Глицинина сои1 |
944 |
Бактерифага М13 |
6407 |
ß-субъединицы Na+, К+ - АТФазы1 |
912 |
Вируса ⊘Х-174 |
5386 |
у-субъединицы фосфодиэстеразы цГМФ1 |
779 |
Обезьяньего вируса SV-40 |
5243 |
Лейкоцитарного интерферона человека1 |
520 |
1 Первичные структуры расшифрованные российскими учеными.
Примечание: только что опубликованы данные о первичной структуре ДНК генома кишечной палочки (4700000 н.п.) и всех 16-ти хромосом пекарских дрожжей (12000000 н. п.).
Ясно, что первичная структура большинства ДНК представлена двухцепочечными дезоксиполирибонуклеотидами с уникальным чередованием десятков и сотен тысяч составляющих их дезоксирибонуклеотидных остатков. В качестве примера ниже приведена структура гена человеческого лейкоцитарного интерферона:

Каждый из 520 дезоксирибонуклеотидных остатков, входящих в состав гена (показана одна его цепь), обозначен прописными буквами (А — дезоксиадениловая, Г — дезоксигуанйловая, Т — дезокситимидиловая, Ц — дезоксицитидиловая, Ц* — 5-метил-дезоксицитидиловая кислота). Именно на этой цепи синтезируется мРНК (см. с. 220), являющаяся матрицей для биосинтеза в лейкоцитах человека белка-интерферона, оказывающего мощное воздействие на метаболические процессы и обладающего поэтому огромным терапевтическим эффектом. Будучи встроен в ДНК кишечной палочки, ген интерферона обеспечивает биосинтез интерферона в бактериальной культуре, что открывает возможность для практического получения последнего в фармацевтической промышленности. Это осуществлено, в частности, в Институте биоорганической химии им. М. М. Шемякина и Ю. А. Овчинникова РАН, где создан соответствующий штамм кишечной палочки, продуцирующий интерферон.
Вторичная структура ДНК. Молекулы природной ДНК в подавляющем большинстве случаев (лишь ДНК некоторых фагов одноцепочечны) составлены парами (см. табл. 19) взаимозакрученных полидезоксирибонуклеотидных цепей, каждой из которых свойственно специфическое, но противоположное чередование нуклеотидных остатков (пунктиром показаны водородные связи между комплементарными основаниями):
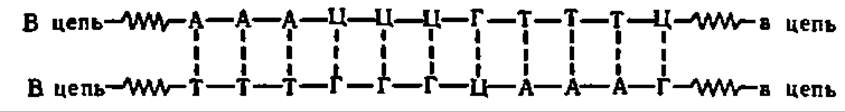
Фотография объемной модели молекул ДНК, построенной по этому типу, представлена на рис. 67, А. Здесь же приведена схема расположения полинуклеотидных цепей и характерные параметры их (рис. 67, А), а также схема расположения комплементарных оснований, связывающих водородными связями полидезоксирибонуклеотидные цепи друг с другом (рис. 67, В). Впервые указанная модель молекулы ДНК была предложена Дж. Уотсоном и Ф. Криком в 1953 г. на основании рентгеноструктурного анализа строения ДНК. Данные, полученные в течение последующих 45 лет, полностью ее подтвердили, а ее авторы стали Нобелевскими лауреатами.
На рис. 67 представлены модели так называемой В-формы ДНК. Дело в том, что в зависимости от ряда условий ДНК существует в виде разнообразных упорядоченных волокнисто-кристаллических структур. Их получено более десяти, четыре из них: А-, В-, С- и Т-формы ДНК — изучены методом рентгеноструктурного анализа. При соблюдении общего плана строения молекулы ДНК в виде биспирального полидезоксирибонуклеотида они отличаются по ряду параметров, присущих каждой из названных конформационных модификаций ДНК (табл. 20).
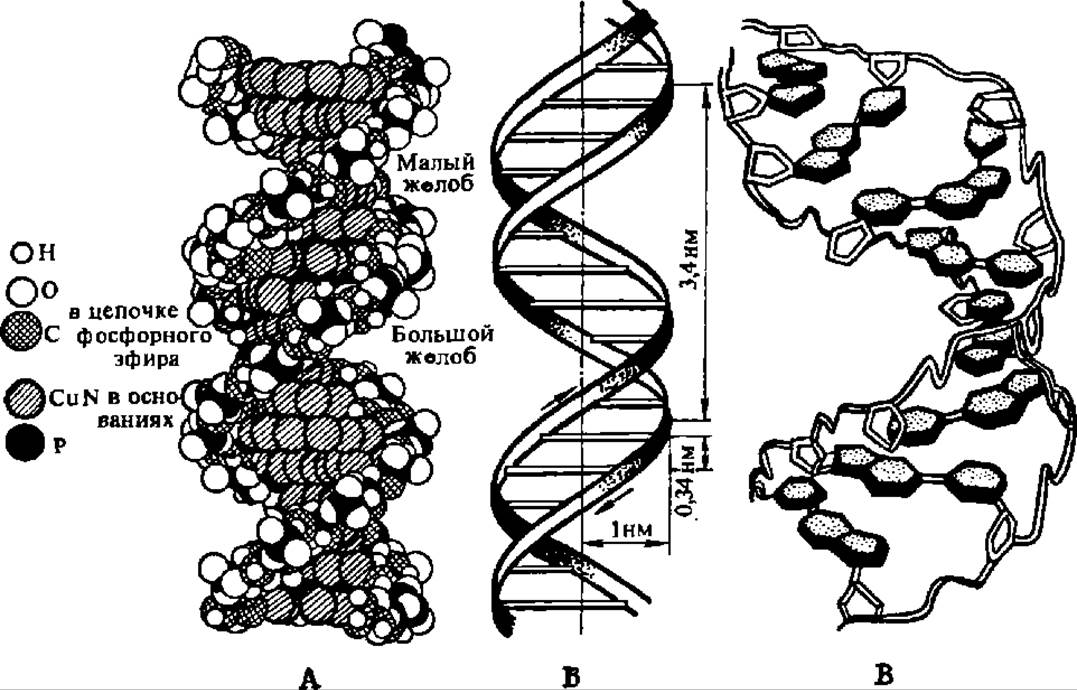
Рис. 67. Строение молекулы ДНК:
А —модель молекулы ДНК: темные и светлые цепочки атомов, выделяющиеся на рисунке, — обращенная наружу пентозофосфатная цепь. Внутрь модели, перпендикулярно ее длинной оси, направлены пуриновые и пиримидиновые оспования, соединяющиеся водородными связями: атомы, принадлежащие основаниям (заштриховано косо), плотно заполняют центральную часть модели; Б — пространственное расположение полидезоксирибонуклеотидных цепей в молекуле ДНК; поперечные линии на схеме обозначают плоскости, в которых располагаются пары оснований, связывающие цепи друг с другом: 0,34 нм — расстояние между остатками соседних дезоксирибонуклеотидов; 1 нм — радиус молекулы; 3,4 нм — шаг двойной спирали; В — расположение комплементарных пуриновых и пиримидиновых оснований в молекуле ДНК: молекулы дезоксирибозы представлены белыми пятиугольниками, обведенными двойной линией; фосфатные группы — изгибом двойной линии, связывающей остатки дезоксирибози; от каждого остатка углевода отходят основания в виде покрытых точечной штриховкой шестиугольников и пятиугольников; короткие двойные линии, соединяющие заштрихованные пуриновые и пиримидиновые основания, предеставляют водородные связи. Все спирали — правозакрученные
Наиболее сильное изменение конформации происходит при превращении A-формы ДНК в В-форму. В частности, при этом резко смещается пространственная структура ß-D-2-дезоксирибозы в ее составе, вследствие чего угол наклона плоскости оснований к оси спирали изменяется более чем на 20° (рис. 68).
В примечании к табл. 20 приведены условия получения кристаллических волокон ДНК. Однако и в клетке та или иная степень обводненности ее компартментов или мембран, как и различия в ионной силе окружающей среды, создает условия для существования ДНК в различных конформациях, между которыми осуществляются взаимные переходы. В биологическом смысле В-форма наиболее адекватна для репликационных процессов, А-форма — для процесса транскрипции, С-форма — для упаковки ДНК в составе надмолекулярных структур хроматина и некоторых вирусов. Таким образом, вторичная структура молекул ДНК, видимо, связана с осуществлением информационных процессов в живой природе, а именно: A-форма ДНК — с передачей информации от ДНК к РНК, В-форма — с умножением количества информации и С-форма — с хранением информации.
Таблица 20 Характеристика некоторых конформационных состояний ДНК
Показатель |
А-форма |
В-форма |
С-форма |
Т-форма |
Число пар нуклеотидных остатков на виток |
11 |
10 |
9,3 |
8,0 |
Угол наклона плоскостей оснований к оси спирали, ° |
20 |
-2 |
-6 |
-6 |
Угол поворота оснований вокруг оси спирали, ° |
32,7 |
36 |
38,6 |
45,0 |
Расстояние комплементарных пар от оси спирали, нм |
0,425 |
0,063 |
0,213 |
0,143 |
Расстояние между нуклеотидными остатками по высоте спирали, нм |
0,256 |
0,338 |
0,332 |
0,304 |
Угол между плоскостями комплементарных оснований, ° |
8 |
5 |
5 |
— |
Примечание. A-форма получена из водно-солевых растворов, содержащих ионы щелочных металлов, кроме Li+; рентгеноструктурный анализ — при относительной влажности 75%. В-форма получена из водно-солевых растворов, содержащих Li+; рентгеноструктурный анализ — при относительной влажности 66%. С-форма получена в тех же условиях, что В-форма, но в растворах с иным соотношением катионов; рентгеноструктурный анализ — при относительной влажности менее 66%. Т-форма (D-форма) выделена из фага Т2; содержит остатки глюкозилированного оксиметилцитозина.
В последние годы появились данные о возможности существования двух принципиально новых форм ДНК: Z-формы и SBS-формы. Z-форма ДНК, открытая в 1979 г. в лаборатории А, Рича, представлена левозакрученными полидезоксирибонуклеотидными цепями (рис. 69) в составе биспиральной молекулы, причем фосфатные группы в ней располагаются зигзагообразно (отсюда — Z-форма). Диаметр молекулы ДНК в Z-форме равен 1,8 нм (против 2,0 в В-форме ДНК), число оснований в витке — 12, расстояние между витками — 0,34 нм, наклон оснований к оси спирали — 7°; в Z-форме ДНК лишь один желоб (вместо двух в А- и В-формах ДНК, см. рис. 67 и 68). Предполагают, что в природной ДНК могут чередоваться правые (А-, В- и С-формы) и левые (Z-форма) участки, причем последние могут быть «горячими точками», где реализуется участие ДНК в ряде метаболических процессов.
SBS-форма ДНК характеризуется отсутствием взаимозакручивания полидезоксирибонуклеотидных цепей в биспиральную молекулу; они располагаются при тех же параметрах молекулы ДНК бок о бок (англ. side by side, отсюда—SBS-форма).
Такая форма ДНК обеспечивает необыкновенно легкое распаривание и расхождение цепей ДНК, что крайне существенно при биосинтезе ДНК.
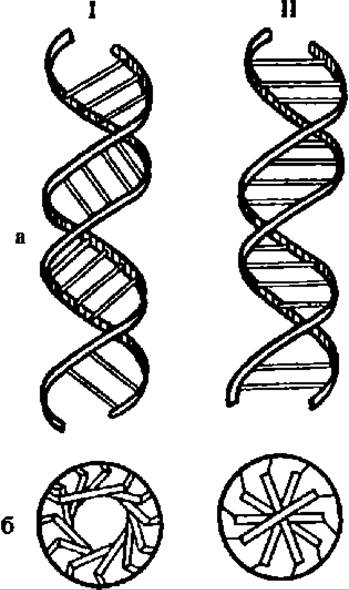
Рис. 68. Полиморфизм вторичной структуры ДНК:
I — А-форма; ІІ — В-форма; а — вид сбоку; б — вид сверху, В А-форме ДНК комплементарно связанные азотистые основания нуклеотидных пар отстоят от оси спирали на 0,425 нм, а в В-форме — очень близки к оси спирали (см. табл. 20). вследствие чего в первом случае внутри молекулы возникает полость, а во втором осуществляется почти полное заполнение внутренней части биспиральното дезоксиполирибонуклеотида азотистыми основаниями
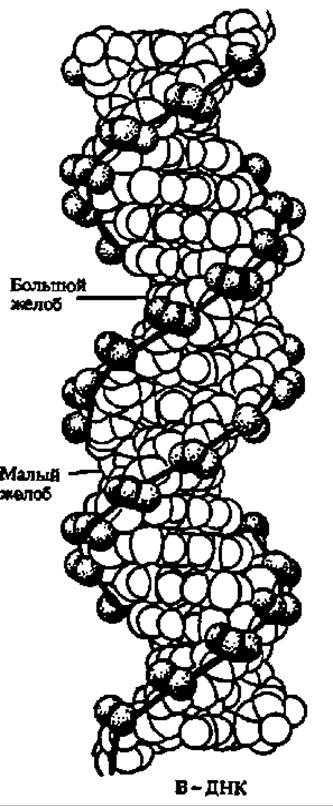
Рис. 69. Сопоставление В- и Z-форм ДНК:
тёмными шарами обозначены межнуклеотидные фосфаты, а соединяющими их толстыми линиями — ход пентозофосфатной цели. Отчетливо прослеживаются Z-образные изломы в левозакрученных пентозофосфатных цепях Z-ДНК и отсутствие таких изломов в правозакрученных цепях В-ДНК. Ясно выступают различия в числе и глубине большого и малого желобов в той и другой форме ДНК
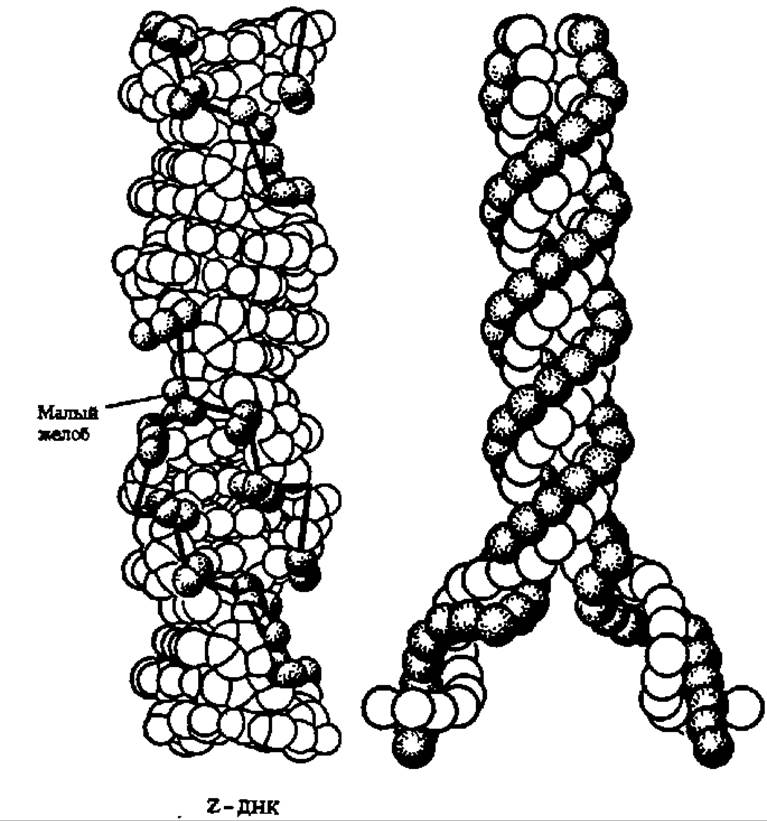
Рис. 70. Образование четырехцепочечной шпильки из полинуклеотида с олигопурин-олигопиримиди новой последовательностью: четвертичная спираль возникает за счет комплементарных взаимодействий в ней полипуриновых (тёмные) и полипиримидиновых (белые) участков в составе двойных спиралей (нижняя часть рисунка)
Недавно получена информация о существовании фрагментов молекул ДНК в виде тройных и четверных спиралей. Первая из них получила название Н-ДНК, так как образуется при pH 4,0, стабилизуясь Н+; при этом тройной комплекс возникает на пурин-пиримидиновых блоках путем присоединения к ним полипиримидиновых нитей. Биологический смысл формирования Н- ДНК пока не ясен. Что касается четверных спиралей ДНК (рис. 70), то их можно расценивать как один из вариантов перехода к третичной структуре дезоксирибонуклеиновых кислот, в первичной структуре которых ярко представлены олигопиримидиновые и олигопуриновые последовательности.
Два вида сил удерживают две полидезоксирибонуклеотидные цепи в биспиральной молекуле ДНК. Во-первых, это водородные связи между комплементарными азотистыми основаниями, обращенными внутрь двойной спирали ДНК (см. рис. 66). Образуя водородные связи, основания находятся в плоскости, перпендикулярной продольной оси В-формы ДНК, так что эти связи действуют в поперечном направлении. Во-вторых, это силы гидрофобных взаимодействий между азотистыми основаниями, собранными в «стопку» вдоль молекулы ДНК; при такой упаковке оснований в водной среде возникают силы, препятствующие контактам неполярных (гидрофобных) оснований с молекулами воды, вследствие чего основания сближаются, а стопкообразная упаковка упрочняется вследствие межплоскостных взаимодействий их друг с другом. Их называют поэтому стэкинг-взаимодействиями (т. е. взаимодействиями, направленными вдоль стопки оснований и, в итоге, вдоль молекулы ДНК).
В последнее время силам стэкинг-взаимодействия придают более существенное, чем ранее, значение в поддержании вторичной структуры ДНК, а водородным связям между комплементарными парами оснований приписывают в большей мере направляющую роль во взаимной ориентации оснований в процессе стэкинг-взаимодействия. Действительно, вклад гидрофобных взаимодействий в поддержание вторичной структуры биспиральных полинуклеотидов возрастает при замене У на Т, т. е. за счет добавочно вводимого гидрофобного метального радикала.
В связи с этим в ином свете представляется и устойчивость биспиральных структур в молекулах ДНК, равно как и механизмов ее нарушения при воздействии физических и химических агентов в тех или иных условиях. В частности, молекулы воды и ионы металлов связываются в основном с пентозофосфатным остовом ДНК, причем катионы располагаются преимущественно в малом желобе двойной спирали В-формы ДНК. Стабилизирующее действие молекул воды направлено непосредственно на усиление стэкинг-взаимодействия, что приводит к стабилизации водородных связей между основаниями. Вместе с тем при ослаблении стэкинг-взаимодействия молекулы воды конкурентно взаимодействуют с протондонорными и протон-акцепторными центрами оснований, способствуя дестабилизации и инициируя дальнейший распад двойной спирали. АТ-пары оснований гидратируются в 2 раза сильнее, чем ГЦ-пары, причем нативность сохраняется при содержании воды не менее 0,6 г на 1 г ДНК. Все это подчеркивает динамичность вторичной структуры ДНК и возможность конформационных и иных переходов в ней под воздействием агентов окружающей среды.
Биспиральные структуры в молекулах ДНК возникают не только при взаимодействии двух комплементарных полидезоксирибонуклеотидных цепей, но и в пределах одной и той же цепи. Это происходит в тех случаях, когда в комплементарных цепях ДНК присутствуют палиндромы — «обратно бегущие» последовательности нуклеотидных звеньев (от греч. палин — обратно, дроме — бегу). Палиндромные структуры характерны для тех участков молекулы ДНК, где расположены зоны «узнавания» структур ДНК ферментами и регуляторными белками. Так, благодаря наличию палиндромов, спирализуются сами на себя, образуя шпильки, цепи ДНК кишечной палочки в зоне лактозного оперона — структуры, где сосредоточена информация о биосинтезе ß-галактозидазы, обеспечивающей распад лактозы при наличии ее в культуральной среде (рис. 71). Высказывают предположение, что палиндромы являются источником четверных спиралей ДНК, которые могут служить для формирования элементов третичной структуры ДНК.

Рис. 71. Палиндромы ДНК кишечной палочки (зона лактозного оперона) в линейном (I) и шпилечном (II) состоянии:
в линейной структуре жирной точкой отмечено место начала формирования шпильки: пунктирными прямоугольниками — зоны палиндромов; стрелками различной толщины и формы — одноименные палиндромы и их направление
Третичная структура ДНК. Молекулы. ДНК существуют в виде линейных и кольцевых форм (рис. 72). В линейной форме находится, видимо, большинство природных ДНК, но ДНК ряда вирусов и фагов, а также ДНК хлоропластов, митохондрий, центриолей и бактериальных плазмид обладают кольцевой структурой. Третичная структура и линейных и кольцевых форм ДНК характеризуется спирализацией и суперспирализацией. Между кольцевыми и линейными формами ДНК, равно как и между ее обычным и суперспирализованным состоянием, предполагается существование динамических переходов. В ДНК ряда вирусов (например, вируса полиомы) и митохондриальной ДНК такие превращения детально изучены (рис. 72).
Сложнее обстоит дело с ДНК из хромосом эукариот. Применяемые методы выделения сопровождаются в большей или меньшей мере ее деградацией и, самое главное, отделением от дезоксирибонуклеопротеина, в виде которого она существует в ядерном аппарате клеток, его белковой части, абсолютно необходимой для поддержания третичной структуры ДНК. Поэтому проблема третичной структуры ядерной ДНК может быть решена только путем изучения структуры хроматина ядра и хромосом.
ДНК в хроматине и хромосомах также находится в суперспирализованном состоянии, причем здесь реализуется несколько уровней суперспирдлизации. Первый уровень сверхскрученного состояния ДНК в хроматине поддерживается гистонами, оккупирующими отрезки ДНК протяженностью около 200 н. п. и образующими элементарную единицу структуры хроматина — нуклеосому (рис. 73). Цепочка нуклеосом образует, в свою очередь, спираль второго и последующих порядков, вплоть до конденсации в хромосому (рис. 74, А). При этом (рис. 74, Б) на один оборот спирали в нуклеосоме приходится уже 80 н. п. (уплотнение ДНК в 6—7 раз), в солениде (6 нуклеосом на виток) — 1200 н. п. (уплотнение в 40 раз), в каждой петле хроматина — 60000 н. п. (уплотнение в 680 раз) и в хромосоме — 1,1 ∙ 106 н. п. (уплотнение в 1,2 ∙ 104).
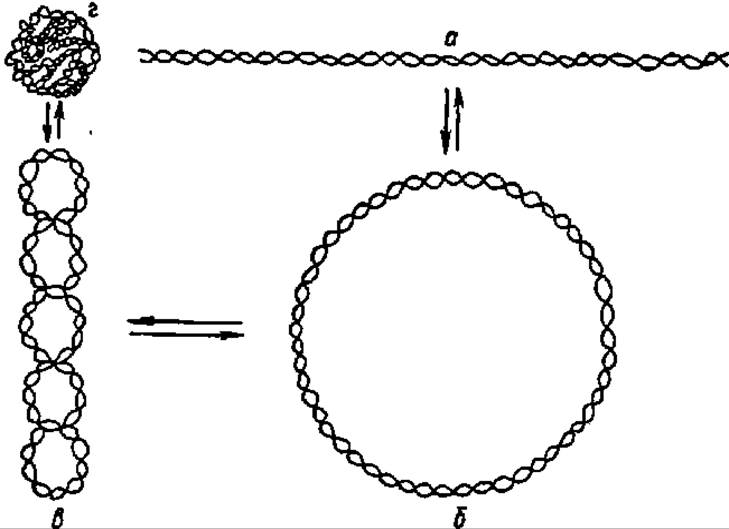
Рис. 72. Третичная структура молекулы ДНК:
а — линейная; б — кольцевая; в — сверхскрученная кольцевая: г — структура компактного клубка
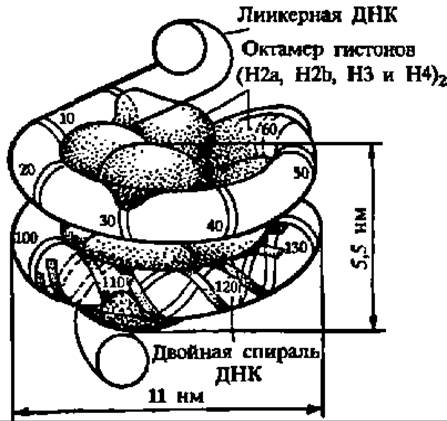
Рис. 73. Строение нуклеосомы
Основу нуклеосомы составляет белковое ядро (белковый кор), вокруг которого навита биспиральная ДНК (1,8 левых сверхвитка, 146 +- 2 н. п., шаг — 2,75 нм); тетрамер гистонов (Н3)2 ∙ (Н4)2 определяет укладку центрального витка суперспирали ДНК в желобе белкового кора, а два гетеродимера (Н2а ∙ Н2в) участвуют в упаковке остальной части суперспирали ДНК по ~0,5 витка каждый; эти гистоны называют коровыми гистонами; гистон H1 стабилизирует области входа и выхода ДНК в нуклеосому, взаимодействуя с линкерной ДНК (от 10 до 80 и. п.), соединяющей нуклеосомы друг с другом
Существенно, что переход ДНК в суперспиральное состояние и обратно осуществляется при посредстве особой группы ферментов — топоизомераз, т. е. ферментов, изменяющих пространственную структуру.
Свойства ДНК. ДНК — вещества белого цвета, волокнистого строения, плохо растворимые в воде в свободном состоянии, но хорошо растворимые в виде солей щелочных металлов. Они также хорошо растворяются в крепких солевых растворах.
Так как молекулы ДНК резко асимметричны, их растворы обладают высокой вязкостью и двойным лучепреломлением. Имея большой отрицательный заряд, молекулы ДНК подвижны в электрическом поле. Все ДНК оптически активны.
При нагревании растворов ДНК в интервале температур от 80 до 90° С происходит «плавление» нуклеиновых кислот, сопровождающееся изменением вязкости раствора и возрастанием поглощения в ультрафиолетовой части спектра (при 260 нм). Последнее получило наименование гиперхромного эффекта.
В химическом отношении ДНК довольно инертны, благодаря чему их долгое время считали индифферентными структурными элементами клеточного содержимого. Однако постепенно накопились данные о ряде химических реакций, свойственных нуклеиновым кислотам: они прочно связывают многовалентные ионы металлов, причем Сu2+ и Ме4+ дают с ДНК нерастворимые комплексы. В первую очередь поливалентные катионы вступают в реакцию с N и О гуанина. Возможно, ионы металлов принимают участие в поддержании третичной структуры нуклеиновых кислот.
Нуклеиновые кислоты легко вступают во взаимодействие с полиаминами, например со спермидином [H2N—(CH2)3—NH—(СН2)4—NН2] и спермином [H2N—(СН2)3—NH—(СН2)4—NH—(СН2)3—NH2], которые участвуют в поддержании третичной структуры нуклеиновых кислот. Одной из важных реакций ДНК является алкилирование аминогрупп А, Ц и Г. Не меньшее значение имеет дезаминирование перечисленных азотистых оснований: в первую очередь дезаминируются Г и Ц. И алкилирование, и дезаминирование ДНК лежат в основе работ по химическому мутагенезу, т. е. по изменению наследственности при помощи химических средств.
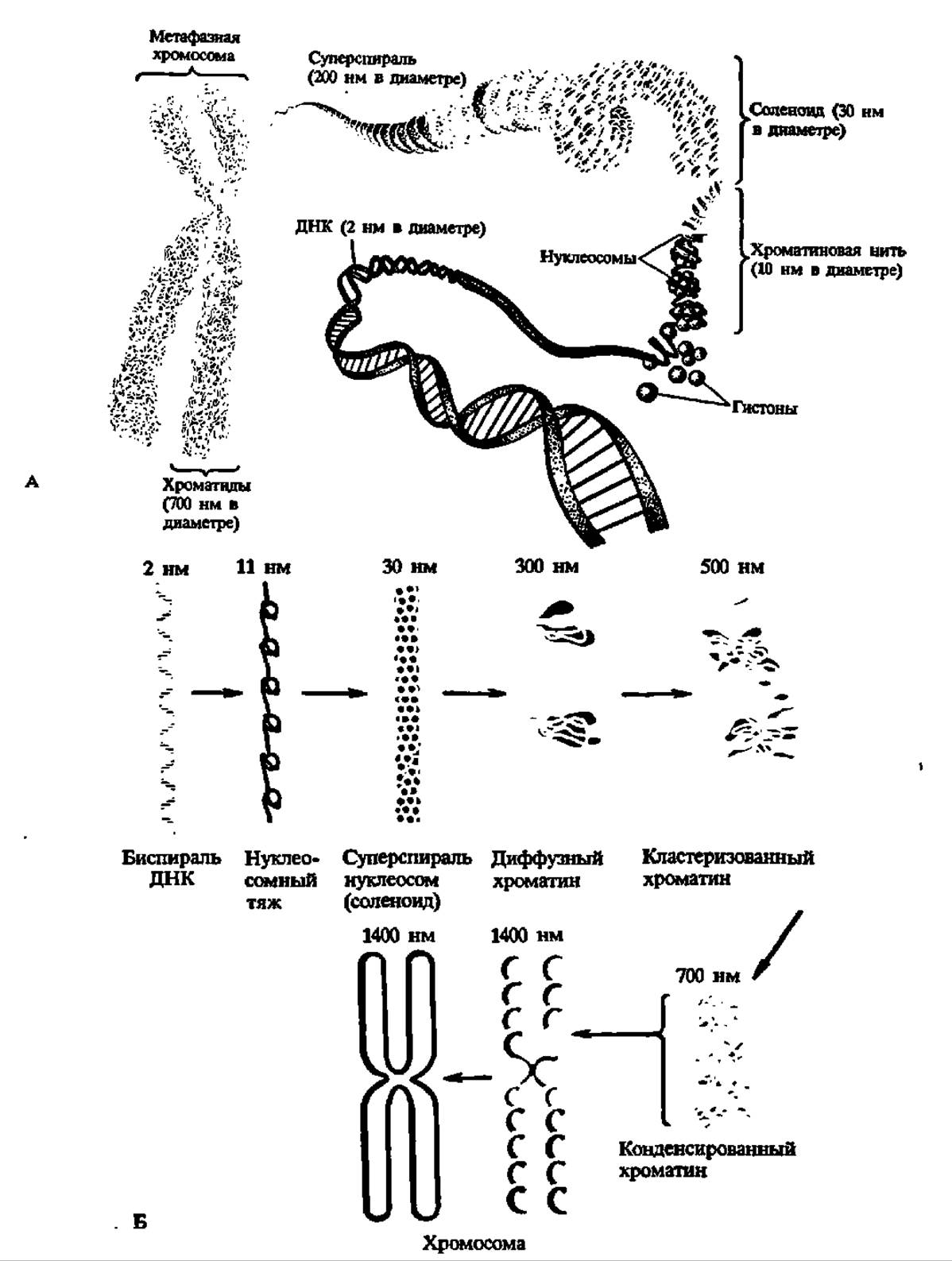
Рис. 74. Уровни суперспирализации ДНК в хроматине:
А — динамика суперспирализации ДНК — белкового комплекса; Б — степень уплотнения ДНК в процессе суперспирализации (см. текст на с. 211).
Структура и функции транспортных РНК. Транспортные РНК были впервые выделены из так называемой «растворимой» части клетки, т. е. из надосадочной жидкости клеточного гомогената. Главной функцией этого вида рибонуклеиновых кислот оказалась способность акцептировать аминокислоты и переносить их в белоксинтезирующий аппарат клетки — рибосому. В связи с этим их называют транспортными рибонуклеиновыми кислотами (тРНК).
Фракция растворимых РНК, составляющая 1 % от сухого вещества клетки или 10% от суммарной клеточной РНК, очень сложна по составу. Она включает несколько десятков индивидуальных тРНК, каждая из которых получена в гомогенном состоянии.
Так как каждая из индивидуальных тРНК способна переносить единственную аминокислоту в процессе белкового синтеза, конкретные тРНК называют по имени той протеиногенной аминокислоты, которую она акцептирует (например, глициновая тРНК, аланиновая тРНК, лизиновая тРНК и т. д., или сокращенно тРНКгли, тРНКала, тРНКлиp и т. п.). Если одна и та же аминокислота акцептируется несколькими индивидуальными тРНК, то последние называют изоакцепторными и нумеруют (например, тРНКвал1, тРНКвал2 и т. п.). Так, обнаружено 4 изоакцепторных тРНКлей, 3 тРНКпро, по 2 у тРНКсер, тРНКмет, тРНКала, тРНКлиз, тРНКтир, тРНКгли и тРНКтре.
Химический состав тРНК оказался своеобразным лишь в одном отношении: по сравнению с другими видами РНК они богаты минорными нуклеотидными остатками. Именно в составе тРНК найдены минорные азотистые основания, перечисленные в табл. 15. Более того, тРНК содержат нуклеозиды и нуклеотиды своеобразного строения, как, например, псевдоуридин и неогуаниловая кислота:
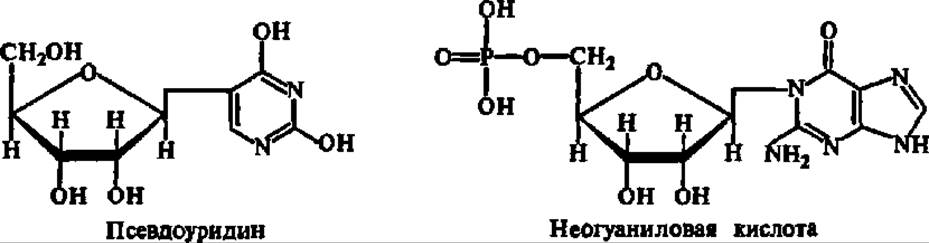
Список минорных компонентов тРНК непрерывно расширяется и в настоящее время насчитывает около 50. Минорные нуклеотидные остатки составляют примерно 10% всех нуклеотидных звеньев тРНК, причем значительная часть их (4—5%) представлена псевдоуридиловой кислотой. Предполагают, что минорные нуклеотидные остатки защищают тРНК от атаки рибонуклеазами, что имеет существенное значение, так как тРНК функционируют в растворимой части клетки. Кроме того, есть мнение, что некоторые из них принимают участие, в кодировании аминокислот и важны для «узнавания» ферментом (аминоацил-тРНК-синтетазой) той тРНК, которая взаимодействует с определенной аминокислотой в процессе активирования последней. Что касается соотношения обычных азотистых оснований в составе тРНК, то оно характеризуется отчетливо выраженным преобладанием суммы Г и Ц над таковой А и У. Таким образом, тРНК относится к ГЦ-типу РНК.
Как отмечено выше, молекулярные массы тРНК лежат в пределах 17000— 35 000. В большинстве случаев они сосредоточены в более узком диапазоне, от 22000 до 27000, т. е. тРНК содержит от 70 до 80 н. о.
Благодаря тому, что в процессе работы по исследованию первичной структуры тРНК Р. Холли с сотр. удачно применили рибонуклеазу, отличающуюся специфичностью к гуаниловым нуклеотидным остаткам, к деструкции дрожжевой тРНКала (при 0° С, pH 7, в присутствии Mg2+), им удалось получить несколько крупных блоков, содержавших от 10 до 39 н. о., и далее расшифровать первичную структуру каждого из них. В результате была впервые (1965) установлена полная первичная структура аланиновой тРНК из пекарских дрожжей (рис. 75). За последующие 5 лет была расшифрована первичная структура 16 тРНК, за следующие пять — 47, еще за пять — 115 тРНК и ряда предшественников тРНК, причем первичные структуры тРНКвал1 и тРНКвал2 из дрожжей выяснены в нашей стране академиком А. А. Баевым с сотр. в 1967 и 1971 гг. соответственно. Эти данные охватывают тРНК, выделенные в основном из бактерий и дрожжей, но в ряде случаев касаются тРНК, полученных из высших организмов (млекопитающих, растений, насекомых и др.). Всего на апрель 1993 г. выяснена последовательность нуклеотидных остатков в 2011 тРНК, изолированных из представителей животного и растительного царства, а также из микроорганизмов.
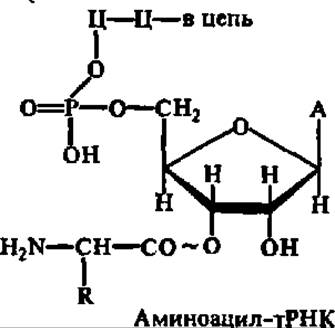
Массовые данные, полученные в результате исследования первичной структуры тРНК, позволили выявить ее некоторые общие закономерности. В 75% случаев молекулы тРНК открываются остатком гуанозип-3', 5'-дифосфата и во всех случаях завершаются ЦЦА-триплетом, причем остаток концевого аденозина служит для связывания (акцептирования) аминокислоты:
В первичной структуре изученных тРНК представлены гомологичные блоки, крайне близкие по чередованию нуклеотидных остатков. Особенно ярко это выявляется в дигидроуридиловон и псевдоуридиловой петлях (рис. 75). Так, в псевдоуридиловой петле у всех без исключения исследованных тРНК присутствует тетрануклеотидный фрагмент — ГТΨЦ—; дигидроуридиловая петля является сосредоточием остатков не только дигидроуридиловой кислоты, но и АГ-последовательностей, а также минорных оснований.
Закономерно распределены в первичной структуре тРНК также минорные нуклеотидные остатки. Это объясняют тем, что только некоторые позиции в молекулах тРНК доступны действию метилирующих ферментов, с помощью которых осуществляется модифицирование обычных оснований в метилированные производные на уровне уже полностью сформированной молекулы.
Вторичная структура тРНК ясна из рассмотрения рис. 75. Ее характерной особенностью является спирализация полинуклеотидной цепочки самой на себя в строго фиксированных комплементарных зонах.
Таких зон насчитывают 4 или 5 в зависимости от наличия или отсутствия добавочной петли, которая всегда располагается, если она есть, между антикодоновым отростком и псевдоуридиловой петлей. В результате ограниченной биспирализации возникает однотипная для всех тРНК вторичная структура в виде клеверного листа (см. рис. 75).
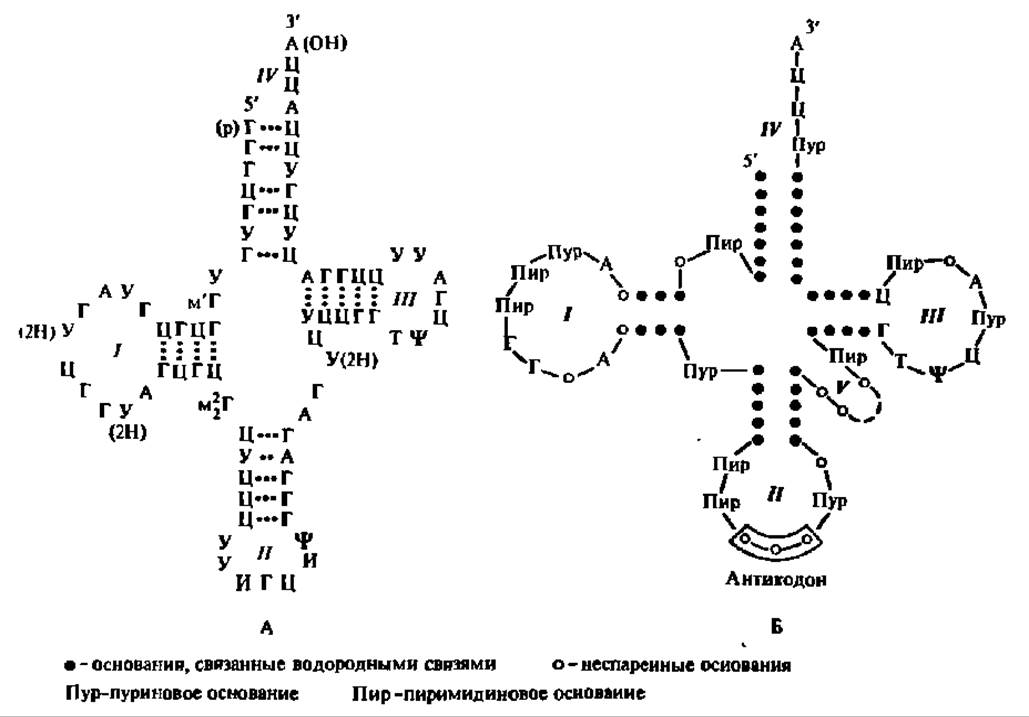
Рис. 75. Структура тРНК:
А — первичная а вторичная структуры аланиновой тРНК; Б — обобщенная структура тРНК в виде клеверного листа; Ψ — остаток псевдоуридиловой кислоты; м1Г — остаток N1-метилгуаннловой кислоты; м22Г — остаток N2- диметилгуаниловой кислоты; м1И-остаток N1-метилинозиновой кислоты; И — остаток инозиновой кислоты, У(2Н) — остаток дигидроуридиловой кислоты; I — дигидроурндиловая петля; II — анти кодоновая петля; III — псевдоуридиловая петля; IV — акцептирующий конец; V — добавочная петля; • — основания, связанные водородными связями; О — неспаренные основания; Пур — пуриновое основание; Пир — пиримидиновое основание
В период наивысшего расцвета модели тРНК типа клеверного листа каждой ее отграниченной части приписывали строго определенное функциональное значение. Особенно большую роль в выяснении функций тех или иных полинуклеотидных последовательностей в молекуле тРНК сыграл метод разрезанных молекул, предложенный в лаборатории акад. А. А. Баева и образно названный акад. В. А. Энгельгардтом методом хирургии молекул. Сущность его сводится к расщеплению в молекуле тРНК ферментативным или химическим путем ограниченного числа межнуклеотидных связей, разделении полученных фрагментов и реассоциации из них молекул тРНК, дефицитных по одному из фрагментов. Реассоциация молекул тРНК из того или иного набора ее фрагментов идет при участии сил слабых взаимодействий и осуществляется по принципу самосборки. Испытание биологической активности таких молекул показало, что представления об однозначной роли дигидроуридиловой, псевдоуридиловой и других петель и частей молекулы тРНК не вполне справедливы. Например, за связывание аминоацил-тРНК-синтетазы отвечает не только дигидроуридиловая петля, но и другие участки молекулы тРНК.
Решение проблемы функциональной активности как фрагментов, так и целой молекулы тРНК, безусловно, связано с прогрессом в изучении ее третичной структуры. На основании расшифровки рентгенограмм, выполненных при разрешении от 0,6 до 0,25 нм, построены модели молекул ряда тРНК, в частности тРНКфен дрожжей, кишечной палочки и термофильных бактерий, тРНКасп, тРНКтрн, формилметиониновой тРНК кишечной палочки и многих других тРНК. Наиболее детально отработана А. Ричем третичная структура дрожжевой тРНКфен (рис. 76).
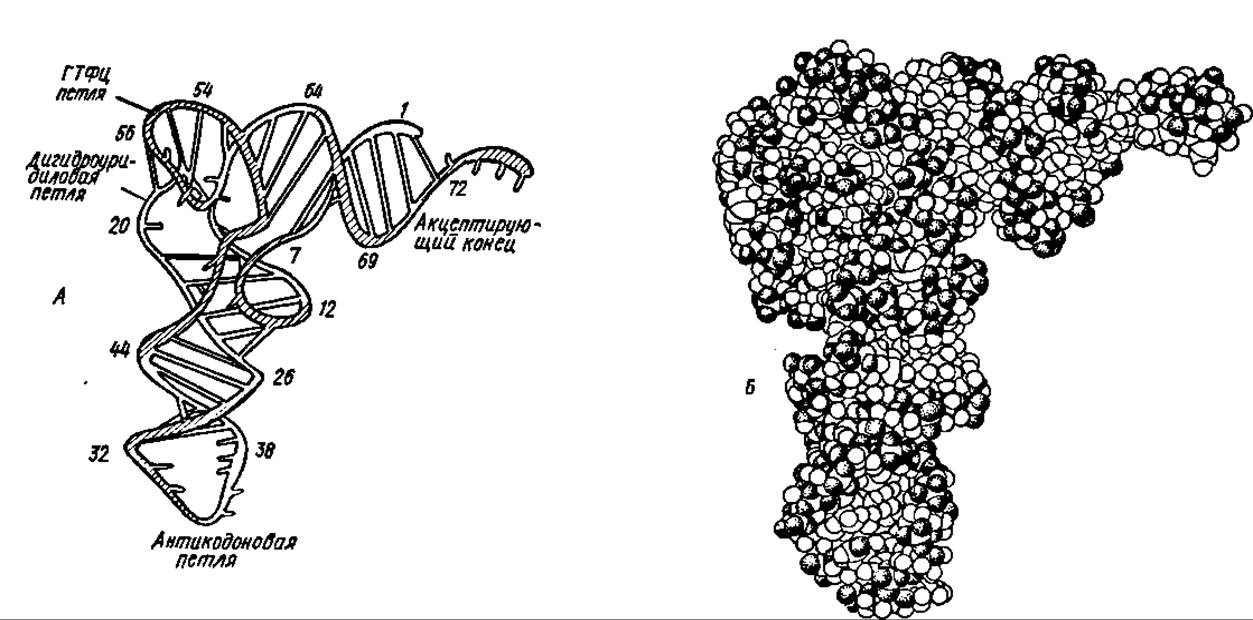
Рис. 76. Третичная структура дрожжевой фенилаланиновой тРНК:
А — Схематическое изображение. Арабскими цифрами указаны номера нуклеотидных остатков. Молекула имеет Г-образную форму, причем антикодовая петля и акцептирующий конец находятся, как и в плоскостной модели типа клеверного листа, на противоположных концах молекулы. Дигидроуридиловая и псевдоуридиловая петли вследствие их взаимодействия друг с другом и образования водородных связей между комплементарными азотистыми основаниями сближены и находятся на сравнительно небольшом расстоянии от продольной оси молекулы. Биспиральные структуры остаются прекрасно выраженными в антикодоновой н акцептирующих частях молекулы. В функциональные взаимодействия тРНК с ферментом, рибосомой н субстратами вовлекаются нуклеотидные остатки, расположенные в различных частях нуклеотидной цепи, но сближенные в процессе формирования пространственной структуры молекулы. В какой-то мере это напоминает механизм возникновения активных центров в молекулах белков. Б — пространственная модель
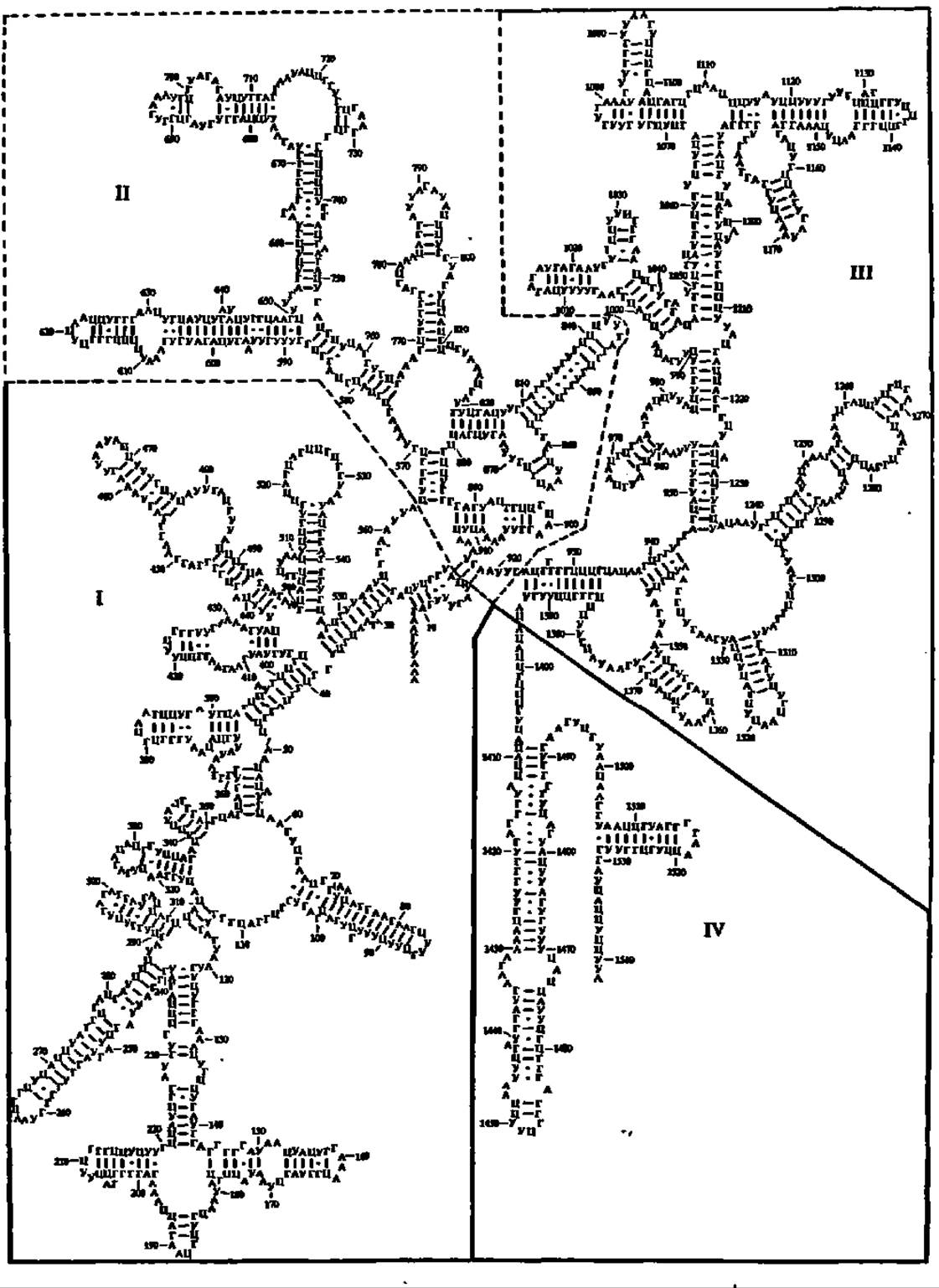
Рис. 77. Предполагаемая вторичная структура 16S рРНК кишечной палочки, выведенная на основании максимального спаривания комплементарных оснований:
I—IV — домены, существенные для понимания закономерностей становления ее третичной структуры (их границы указаны сплошными и пунктирными линиями)
Для тРНК характерны неканонические функции, которым в последнее время уделяют все большее внимание: сигнальная в геноме вирусов; нематричного (внерибосомального) переноса аминокислотных остатков на растущие при биосинтезе пептидогликанов клеточной стенки бактерий или существующие полипептиды при участии аминоацил-тРНК-протеинтрансфераз; затравочная для обеспечения действия обратной транскриптазы (см. ниже) и др.
Структура и функции рибосомальных РНК. На долю рибосомальных РНК (рРНК) приходится основная масса клеточной РНК (80—85% от тотальной РНК клетки). У всех организмов найдено три вида рРНК, различающихся по молекулярным массам и локализации в рибосомах (см. гл. VII), обязательной составной частью которых они являются. Две рРНК высокомолекулярны, а третья сравнительно низкополимерна. Кроме того, в рибосомах эукариот присутствует еще одна низкомолекулярная рРНК.
В зависимости от класса рибосом (70S или 80S) константы седиментации и молекулярные массы двух (большой и малой) высокополимерных рРНК несколько различаются. Малая молекула высокополимерной рРНК (константа седиментации 16,0—18,0S, М = 0,55 ∙ 106 — 0,79 ∙ 106) локализована в 30—40S, а большая (константа седиментации 23—29S, М = 1,07 ∙ 106 —1,6 ∙ 106) — в 50—60S субчастицах рибосом.
Во всех без исключения рибосомах присутствует низкополимерная 5S рРНК с молекулярной массой 40 тыс. Да. Она локализована в 50—60S субчастицах рибосом. Низкополимерная рРНК с константой седиментации 5,8S (M~50 000) характерна только для эукариотических рибосом.
Нуклеотидный состав высокополимерных рРНК варьирует в довольно широких пределах и по мере усложнения организма все более смещается в сторону преобладания ГЦ-пар. РНК, выделенные из рибосом митохондрий, отличаются резким преобладанием АУ-пар, что является одним из аргументов в пользу выделения митохондриальных РНК в особую группу. Высокомолекулярные рРНК содержат в 2—5 раз меньше минорных оснований, чем тРНК, и список их гораздо короче.
Нуклеотидный состав 5S рРНК своеобразен — в нем совершенно не представлены метилированные основания и лишь в некоторых случаях (например, у дрожжевых грибков) обнаружена псевдоуридиловая кислота (около 1,3 мол. %). Соотношение главных нуклеотидов у 5S рРНК характеризуется отчетливым ГЦ-типом.
В последние годы наметились большие успехи в познании первичной и вторичной структур рРНК. Прежде всего это касается 5S рРНК. Их первичная структура выяснена уже более чем в 500 случаях. Во всех исследованных до сих пор 5S рРНК, за единичными исключениями, найдено ровно 120 н. о., чередование которых в определенной, но небольшой мере варьирует у 5S рРНК из разных источников, что используется в химической таксономии. Ниже представлена первичная структура 5S рРНК кишечной палочки:
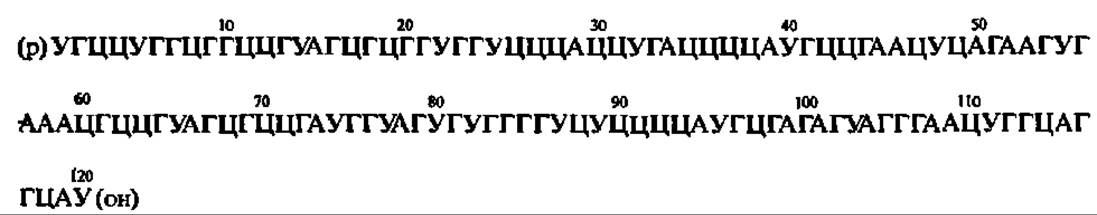
Расшифрована также первичная структура нескольких десятков 5,8S рРНК и их предшественников. В подавляющем числе они содержат 158 н. о.
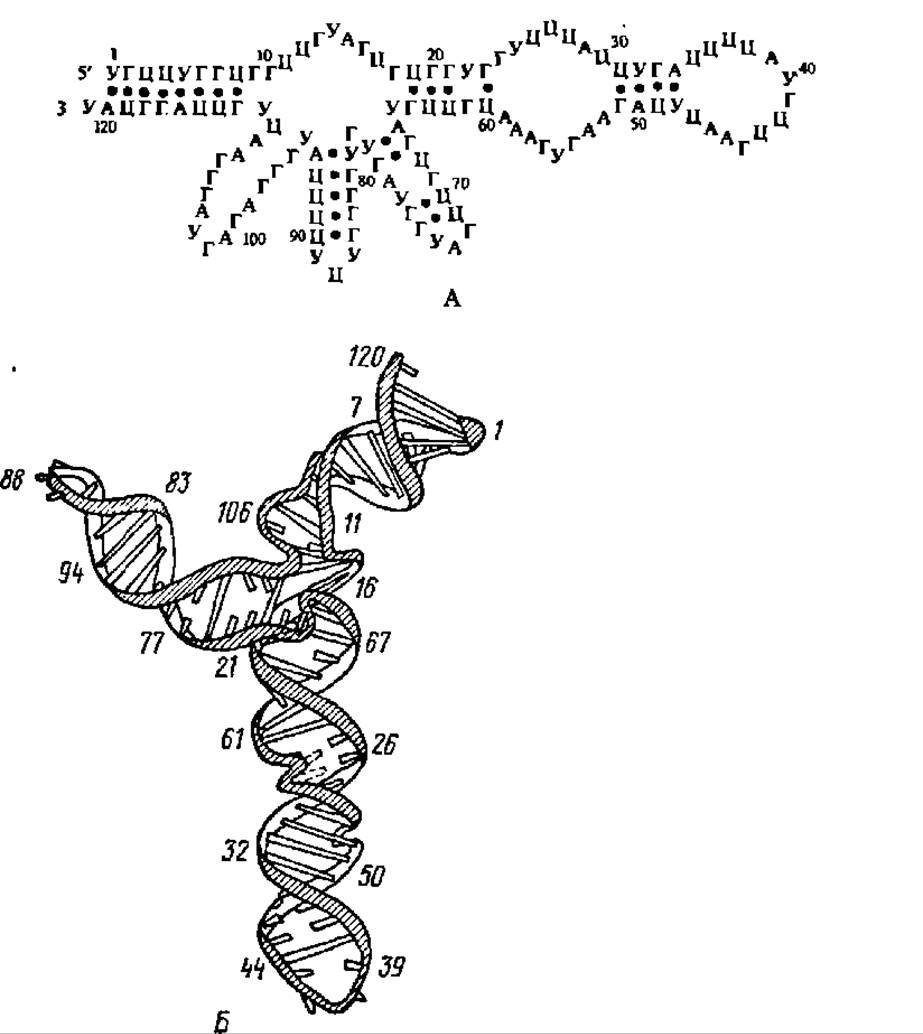
Рис. 78. Модели вторичной ((A) и третичной (Б) структуры 5SpPHK
Большие успехи достигнуты в установлении первичной структуры 16—18S рРНК. Впервые в 1974 г. Ж. Эбель (Франция) сообщил данные о первичной структуре 16S рРНК кишечной палочки. Вслед за этим была выяснена первичная структура более ста 16—18S рРНК. Число нуклеотидных звеньев в 16S рРНК кишечной палочки (рис. 77) — 1542, в 18S рРНК печени крысы —1874. Завершены аналогичные исследования 23S рРНК кишечной палочки, 25S рРНК пекарских дрожжей и ряда других. 23S рРНК кишечной палочки включает 2904 н. о., 28S рРНК печени крысы — 4718 н. о. Всего на апрель 1993 г. выяснено расположение рибонуклеотидных звеньев у 1850 16—18S рРНК (у 100 — из археобактерий, у 1400 — из эубактерий и хлоропластов, у 350 — из эукариот), а также у 23—28S рРНК, выделенных из 150 представителей про- и эукариот.
Вторичная структура рРНК характеризуется спирализацией самой на себя полирибонуклеотидной цепи как у низко-, так и у высокополимерных рРНК.
Спирализация идет за счет взаимодействия комплементарных (Г—Ц и А—У) оснований, в результате чего в молекулах рРНК возникает то или иное количество биспиральных участков. Оно достаточно существенно в молекулах 5S и 5,8S рРНК и несколько менее выражено в молекулах 16—18S рРНК. Вторичную структуру 5S рРНК иллюстрирует рис. 78, А.
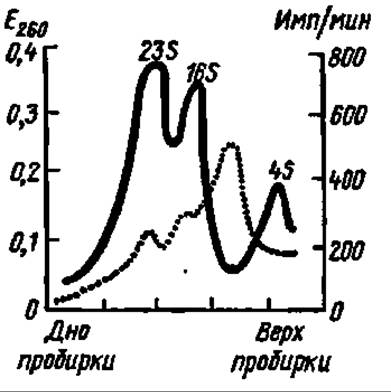
Рис. 79. Доказательство существования быстрометящейся РНК (мРНК):
сплошная черная линия — поглощение при 260 нм в пробах после разделения 23S, 16S и 4S РНК ультраиентрифугированием в градиенте плотности сахарозы: пунктирная линия — включение 14С-урацила в РНК. Ход пунктирной кривой показывает, что максимальное включение предшественника осуществляется в РНК с коэффициентом седиментации около 8S, которая и представляет собой мРНК
Плоскостные биспирализованные и линейные участки молекул 5S и 16S) рРНК, в свою очередь, укладываются в более компактные структуры высшего порядка, т. е. образуют пространственную, третичную структуру этих молекул. Она детально охарактеризована у 5S рРНК (рис. 78, Б) и пока еще далека от окончательного выяснения у 16—18S рРНК. Тем не менее и у последних нет уже сомнения в том, что осуществляется мощная компактизация постоянных и вариабельных доменов.
Функциональная роль всех видов рРНК постепенно проясняется: 16—18S и 23—29S рРНК являются структурной основой для формирования рибонуклео- протеинового тяжа, который, складываясь в пространстве, дает начало 30— 40S и 50—60S субчастицам рибосомы. Однако этим, конечно, не исчерпывается роль высокополимерных рибосомальных РНК: они могут взаимодействовать с мРНК и аминоацил-тРНК; их участки, видимо, распознаются белковыми факторами (см. гл. VII), принимающими участие в сборке полипептидной цепи в рибосоме; не исключено непосредственное взаимодействие друг с другом или контакт через посредство специфических белков 16—18S рРНК и 23—29S рРНК, локализованных в разных субчастицах, в процессе образования 70—80S рибосом при ассоциации субчастиц или в транслирующей рибосоме. Что касается 5S и 5,8S рРНК, то их функции в должной мере пока еще не изучены. Определенно установлено лишь, что 5S рРНК в рибосомах бактерий связана с тремя белками — L5, L18 и L-25 (о рибосомных белках см. ниже, гл. VII), у аpхеобактерий — с одним-двумя, у эукариот—только с одним (L8); эти комплексы рассматривают как третью субчастицу рибосомы, в составе которой 5S рРНК выполняет роль посредника между пептидилтрансферазным центром и EF—G—связывающими доменами (об этом тоже см. гл. VII).
Структура и функции информационных РНК. Существование информационных рибонуклеиновых кислот (иРНК), или РНК-посредников, в передаче информации от ДНК в белоксинтезирующий аппарат клетки (мессенджер-РНК, от англ. messenger — посыльный, курьер, мРНК) было предсказано А. Н. Белозерским и А. С. Спириным в 1958 г., исходя из наличия корреляции между нуклеотидным составом ДНК и РНК.
Двумя годами позже образование мРНК у бактерий было доказано Ф. Гро и сотр. в прямых опытах с включением импульсной метки в различные виды РНК (рис. 79). Это позволило в новом свете истолковать более ранние эксперименты Е. Волкина и Л. Астрахана (1956), наблюдавших появление быстрометящейся фракции ДНК-подобной РНК у бактерий после заражения их фагом.
Прямое выделение мРНК было осуществлено в 1962 г. — Е. Баутц и Б. Холл для этого применили остроумный метод сорбции мРНК, возникающей при заражении кишечной палочки фагом Т4, на ДНК, выделенной из этого фага и ковалентно связанной с фосфоцеллюлозой. В дальнейшем метод аффинной хроматографии стал ведущим при выделении и очистке мРНК, особенно после того, как в составе большинства мРНК эукариот был обнаружен полиадениловый фрагмент значительной протяженности, а в качестве носителя в колонках применена сефароза, ковалентно связанная с полиуридиловой кислотой цианбромидным методом. Взаимодействие полиадениловых последовательностей мРНК с полиуридиловыми фрагментами носителя в силу комплементарности первых и вторых приводит к связыванию на такой колонке только мРНК.
Благодаря применению разнообразных методов и приемов многие мРНК получены в высокоочищенном состоянии. К их числу принадлежат мРНК, обеспечивающие матричный биосинтез субъединиц гемоглобина, яичного альбумина, легких и тяжелых цепей иммуноглобулинов, гистонов, кристаллинов (белки хрусталика глаза), миозина, фиброина шелка, авидина, протаминов, а-казеина и др. Суммарное содержание мРНК в клетках составляет 2—3% от тотальной клеточной РНК.
Молекулярные массы мРНК варьируют в широких пределах: от нескольких сотен тысяч до нескольких миллионов дальтон. Так, молекулярная масса моноцистронной глобиновой мРНК, служащей матрицей для биосинтеза субъединиц гемоглобина, составляет 150000 (константа ее седиментации равна 9S). Молекулярные массы многих моноцистронных, т. е. кодирующих биосинтез одного белка, мРНК близки к этой величине. Однако у полицистронных мРНК, кодирующих биосинтез не одного, а нескольких функционально взаимосвязанных белков, молекулярные массы гораздо выше и достигают нескольких миллионов дальтон. Примером может служить полицистронная мРНК гистидинового оперона, выделенная из салмонеллы. Ее молекулярная масса равна 4 ∙ 106. Впрочем, некоторые моноцистронные мРНК могут обладать молекулярной массой такого же порядка, что характерно, например, для мРНК фиброина шелка (М = 5 ∙ 106).
Нуклеотидный состав мРНК крайне разнообразен. Для бактериальных мРНК характерно ДНК-подобие нуклеотидного состава, тогда как у мРНК эукариот этого не наблюдается. В ряде случаев содержание нуклеотидов в мРНК крайне специфично. Так бывает, в частности, при кодировании ими биосинтеза резко асимметричных по аминокислотному составу белков. Ярким примером может служить фиброиновая мРНК. В ее составе содержится 40 мол. % гуанина и 19 мол. % цитозина, что вполне соответствует наличию в фиброине шелка 42% глицина.
Первичная структура ряда мРНК выяснена. Так, в составе глобиновой мРНК человека установлено чередование 576 н. о. (не считая полиаденилового фрагмента), овальбумина цыпленка — 1859, липопротеина внешней мембраны кишечной палочки — 332; известны первичные структуры глобиновых мРНК кролика и африканской шпорцевой лягушки, ряда вителлогениновых (кодируют биосинтез запасного белка яиц) мРНК, нескольких десятков мРНК, кодирующих биосинтез белков хориона яиц насекомых, и т. п.
Строение мРНК специфично: в их составе есть информативные, т. е. работающие как матрицы в процессе биосинтеза белка, зоны и неинформативные участки. Из неинформативных участков изучены уже упоминавшиеся ранее полиадениловые фрагменты, находящиеся на 3'-конце молекулы мРНК. Длина полиадениловых фрагментов у разных мРНК колеблется от 50 до 400 н. о. Эти фрагменты отсутствуют в молекулах гистоновых мРНК. Неподалеку от полиаденилового фрагмента в молекулах мРНК располагаются небольшие повторяющиеся последовательности длиной примерно по 30 н. о., тоже не несущие кодирующей функции, но, возможно, являющиеся акцепторными участками при взаимодействии мРНК с рибосомой или отдельными белковыми факторами. Кроме того, на 5'-конце мРНК присутствует нуклеотидная последовательность, азотистые основания в которой метилированы, а один из нуклеозидных остатков — 7-метилгуанозин, присоединен через трифосфатную группировку. Эта часть молекулы мРНК также неинформативна и называется шапочка или кэп (от англ. cap — кепка, шапка):
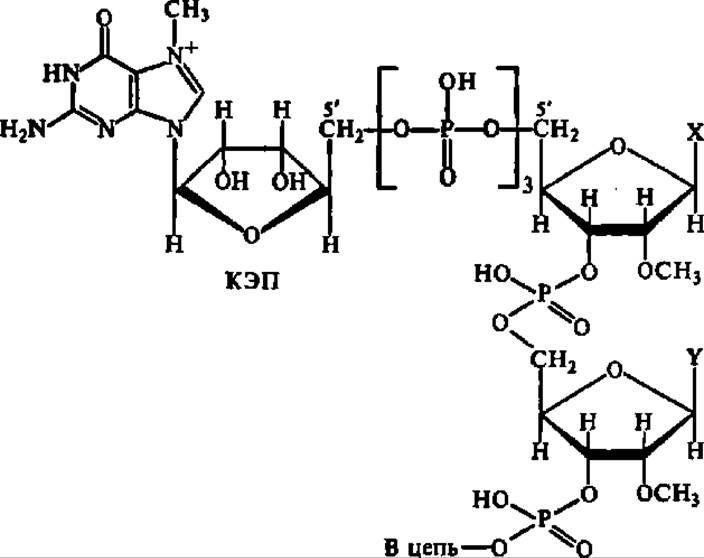
Отмеченное своеобразие в строении РНК выражается в виде такой обобщенной структуры:

Полагают, что полиадениловая часть молекулы мРНК участвует в процессе созревания мРНК (см. ниже), предопределяет время жизни мРНК, способствует переносу мРНК из ядра в цитоплазму и принимает участие в трансляции (см. гл. VII) мРНК. Кэп нужен для защиты мРНК от экзонуклеаз, для связывания белковых факторов при взаимодействии с рРНК в рибосоме, он играет сигнальную роль при присоединении мРНК к рибосоме и участвует в трансляции.
Вопрос о вторичной структуре мРНК находится в стадии разработки. Как и у других видов РНК, полинуклеотидная цепь в молекуле мРНК спирализована сама на себя. Данные о возможных спариваниях в молекуле мРНК комплементарных оснований (А—У и Г—Ц), заложенные в компьютер, послужили основанием для разработки модели глобиновой мРНК кролика (рис. 80). Что касается третичной структуры мРНК, то о ней пока ничего не известно и можно лишь констатировать, что она упакована менее компактно, чем рРНК.
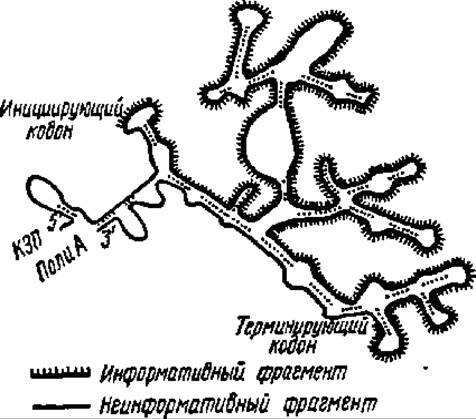
Рис. 80. Компьютерная модель вторичной структуры ß-глобиновой мРНК кролика.
Информативный фрагмент (см. рис.) включает 441 н. о.; неинформативная зона со стороны кэпа — 56 н. о. (от кэпа до инициирующего кодона, с которого начинается сборка полипептидной цепи ß-глобина), со стороны полиаденилового фрагмента, не считая его, — 94 н. о. (от терминирующего кодона, при посредстве которого завершается сборка полипептидной цепи ß-глобина до начала полиадениловой части мРНК). Примерно 40% комплементарных нуклеотидов в составе ß-глобиновой мРНК кролика, как и в других мРНК. спарено, что показано точками; в этих зонах мРНК спирализована сама на себя
На заре изучения мРНК, когда исследовали преимущественно бактериальные мРНК, характерным для этого вида РНК считали быструю обмениваемость, т. е. короткое время жизни, исчисляемое секундами или минутами, ДНК-подобие нуклеотидного состава, а также значения молекулярных масс, которым соответствуют константы седиментации в промежуточной зоне между константами седиментации транспортных (4S) и малой рибосомальной (16S) РНК. Исследования мРНК эукариот решительно изменили эти критерии отнесения РНК к классу информационных. Дело в том, что мРНК эукариот оказались достаточно долгоживущими молекулами (от нескольких часов до нескольких дней и даже недель), их нуклеотидный состав был далек от соотношения нуклеотидных остатков в валовой ДНК, а коэффициенты седиментации варьировали от 9S до 65S. Поэтому в настоящее время перечисленные критерии отпали ввиду их неадекватности свойствам всех мРНК и остался единственный критерий, сводящийся к следующему: информационной следует считать ту РНК, которая в последовательности нуклеотидных остатков в молекуле несет информацию, обеспечивающую синтез специфического белка непосредственно на ней самой. Таким образом, матричные свойства данной РНК оказались единственным признаком, который имеет всеобщее значение.