Основы биохимии - Филиппович Ю. Б. 1999
Гормоны и их роль в обмене веществ
Пептидные гормоны
Структура и функции пептидных гормонов. Сейчас известно несколько десятков природных пептидных гормонов, и список их постепенно пополняется.
Благодаря широкому использованию методов бурно развивающейся белковой химии в последние годы ряд пептидных гормонов получен в гомогенном состоянии, изучен их аминокислотный состав, выяснена первичная (а в случае белковых гормонов — вторичная, третичная и четвертичная) структура и некоторые из них приготовлены синтетическим путем. Более того, большие успехи, достигнутые в области химического синтеза пептидов, позволили искусственно получить множество пептидов, являющихся изомерами или аналогами-натуральных пептидов. Изучение гормональной активности последних принесло исключительно важную информацию о взаимосвязи структуры пептидных гормонов с их функцией. Примеры этого будут приведены ниже.
Важнейшими пептидными гормонами являются окситоцин, вазопрессин, гастрин, глюкагон, инсулин, адренокортикотропин, меланоцитостимулирующий гормон, паратгормон, тиреотропин и гормон роста. В последние годы открыто и изучено большое семейство нейрогормонов, опиоидных пептидов и рилизинг-факторов. Рассмотрим строение и функции перечисленных гормонов.
Окситоцин — 9-членный пептид, выделенный В. дю-Виньо с сотр. из задней доли гипофиза. Этот же ученый в 1953 г. (одновременно с Г. Туппи) предложил полную структурную формулу окситоцина:
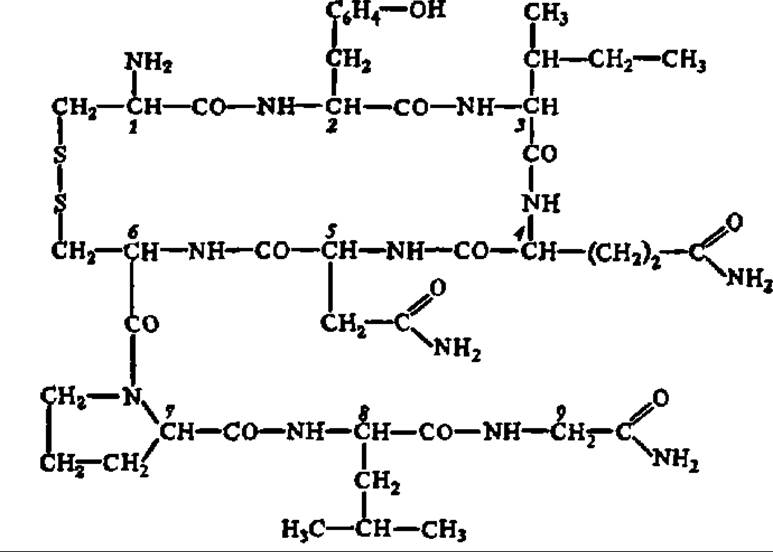
Как видно из приведенной выше формулы, окситоцин содержит цикл, замыкающийся в результате возникновения дисульфидной связи между 1-м и 6-м остатками цистеина в его молекуле.
Окситоцин уже через 20—30 с после внутривенного введения в количестве всего лишь 1 мкг вызывает у рожениц сокращение мышечных волокон, расположенных вокруг альвеол молочных желез. Это приводит к выделению молока. Кроме того, по мере приближения родов усиливается чувствительность к окситоцину мышц матки, сокращающихся под его воздействием. Поэтому данный гормон способствует нормальному протеканию родов.
Окситоцин синтезирован; создано также много его изомеров и аналогов. Это дало возможность детально выяснить значение каждого аминокислотного остатка и их сочетаний для функциональной активности гормона. Оказалось, что размыкание дисульфидного мостика в молекуле окситоцина сопровождается полной его инактивацией. Важнейшее значение для биологического действия окситоцина имеет остаток амидированной аспарагиновой кислоты (положение 5). Ацилирование амидных групп (в 4-м, 5-м и 9-м положениях) ведет к понижению активности окситоцина. Наличие свободной ОН-группы у остатка тирозина способствует проявлению полной физиологической активности. Устранение боковой цепи тирозина из состава окситоцина приводит к появлению у него способности ингибировать действие других гипофизарных гормонов. Замена изолейцина (положение 3) на лейцин, норлейцин, валин или аллоизолейцин убеждает в том, что боковая цепь изолейцина служит для специфической связи гормона с рецептором. Присоединение по свободной NH2-гpyппe остатка цистеина (положение 1) других аминокислот или коротких пептидов приводит к удлинению срока действия гормона в организме по сравнению с контролем.
Вазопрессин — 9-членный пептид, выделенный тоже из задней доли гипофиза. Заслуга в выяснении его структуры и разработке метода его синтеза принадлежит В. дю-Виньо (1953—1956). Строение вазопрессина весьма напоминает структуру окситоцина (см. рис. 22 на с. 50).
Как можно легко заметить, за исключением позиций 3 и 8, структура вазопрессина полностью повторяет структуру окситоцина. Так построен вазопрессин, выделенный из гипофиза человека, обезьяны, крупного рогатого скота, лошади, верблюда, овцы и собаки. В молекуле вазопрессина, получен' ного из гипофиза свиньи, вместо остатка аргинина (8-е положение) располагается остаток лизина. Это свидетельствует о наличии видовой специфичности в строении вазопрессина.
Будучи сходен с окситоцином по структуре, вазопрессин, в известной мере, похож на него и по функциональной активности: он стимулирует сокращение гладких мышц сосудов. Однако указанная функция не является для вазопрессина главной. Основное действие его направлено на регуляцию водного обмена. Вазопрессин обеспечивает должный уровень ресорбции воды в дистальных канальцах почек у высших позвоночных, регулируя водный баланс организма и осмотическое давление плазмы крови. Естественно, что он способен повышать кровяное давление, и это отражено в его названии.
Гастрин — 17-членный пептид, выделяемый слизистой входной части желудка. Его первичная структура расшифрована, и он получен синтетически:
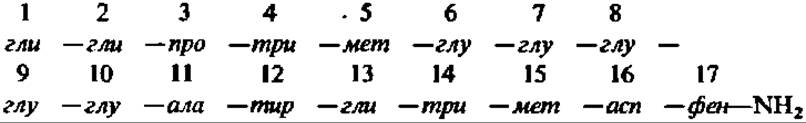
Гастрин стимулирует секрецию желудочного сока. Его активность в 500 раз превышает в этом отношении активность ранее известного стимулятора сокоотделения — гистамина. Гастрин действует возбуждающим образом почти исключительно на образование соляной кислоты и лишь в небольшой мере повышает выработку пепсина. Он способствует выделению секрета поджелудочной железы и усиливает тонус и сокращение мышц желудка и тонкого кишечника. Указанная специфическая гормональная активность гастрина почти исключительно связана с наличием в его молекуле С-концевого тетрапептида (14—17-й остатки).
Поскольку аналогичная ситуация воспроизводится у многих пептидных гормонов, а также белков с иной биологической активностью, огромный интерес представляет выяснение назначения остальной части полипептида, не участвующей непосредственно в осуществлении гормональной, биокаталитической или иной функции.
Глюкагон — 29-членный пептид, синтезирующийся в а-клетках островковой части поджелудочной железы. Первое упоминание об этом гормоне восходит к 1923 г., когда И. Мурлин с сотр. обнаружил его присутствие в препаратах инсулина. В 1953 г. Ф. Штрауб полупил глюкагон в виде гомогенного кристаллического препарата, а несколько позже была выяснена его первичная структура. Она такова:

Избыточное выделение глюкагона поджелудочной железой или искусственное введение его в организм животных и человека приводит к кратковременному повышению содержания глюкозы в крови — гипергликемии. Это действие глюкагона объясняется тем, что он способствует превращению менее активной формы фосфорилазы печени в более активную (см. с. 334). В результате под действием фосфорилазы а усиливается распад гликогена в печени и возрастает содержание глюкозы (в виде глюкозо-1-фосфата) в крови. Естественно, что запасы гликогена в печени при этом сокращаются, а процесс гликогенолиза в организме усиливается. Таким образом, глюкагон способствует деструкции углеводов.
Инсулин — белок, вырабатываемый в ß-клетках поджелудочной железы. Его строение детально изучено. Инсулин был первым белком, у которого Ф. Сангером (см. с. 61) была выяснена первичная структура. Он же явился первым белком, полученным путем химического синтеза.
Впервые наличие в железе гормона, влияющего на углеводный обмен, было отмечено Мерингом и О. Миньковским (1889). Позднее Л. В. Соболев (1901) установил, что источником инсулина в поджелудочной железе служит островковая часть ее, в связи с чем в 1909 г. этот гормон, не будучи еще индивидуализирован, получил наименование — инсулин (от лат. insula — остров). В 1922 г. Ф. Бантинг и Г. Бест впервые приготовили активный препарат инсулина, а к 1926 г. были разработаны способы его выделения в высокоочищенном состоянии, в том числе в виде кристаллических препаратов, содержащих 0,36% Zn.
Молекулярная масса кристаллического инсулина равна 36 000. Его молекула представляет собой мультимер, составленный из шести протомеров и двух атомов Zn. Протомеры образуют димеры, которые взаимодействуют с имидазольными ядрами радикалов гис10 цепи В и способствуют их агрегации в гексамер (рис. 136). Распадаясь, мультимер дает три субчастицы с молекулярной массой 12000 каждая. В свою очередь, каждая субчастица расщепляется на две равные части с М = 6000. Все перечисленные модификации инсулина — протомер, димер и гексамер — обладают полной гормональной активностью. Поэтому часто молекулу инсулина отождествляют с протомером, обладающим полной биологической активностью (М = 6000), тем более, что в физиологических условиях инсулин существует в мономерной форме. Дальнейшее фрагментирование молекулы инсулина (с М = 6000) на цепь А (из 21 аминокислотного остатка) и цепь В (из 30 аминокислотных остатков) ведет к утрате гормональных свойств.

Рис. 136. Структура инсулина и его рецептора:
I — третичная структура протомера; А1—А21 — цепь А; В1—В30 — цепь В; пунктиром показана зона связывания с рецептором; II — четвертичная структура гексамерной молекулы; каждый блок соответствует протомеру; один блок отсутствует, чтобы показать взаимодействие ионов цинка (пунктирные линии) с тремя радикалами гистидина и иона кальция — с тремя радикалами глутаминовой кислоты (оба радикала в цепи В, в положениях 10 и 13 соответственно); и тот и другой ион связаны также с тремя молекулами воды каждый (на рисунке не показано); III — транспортные системы, чувствительные к регуляторному действию инсулина на клетки-мишени: I — стимуляция переноса глюкозы; 2 — стимуляция Na+, К+-насоса; 3 — повышение интенсивности Na+/Н+-обмена; 4 — ингибирование Са2+-насоса; 5 — стимуляция транспорта аминокислот; 6 — повышение активности системы Na+/Ca2+-oбмeнa; Р — рецептор; Г — гормон; IV — гипотетическая структура рецептора инсулина (а2β2-цепи, связанные дисульфидными мостиками; а — 93 000, ß — 135 000 Да). Это гликопротеин (М = 460 кДа), встроенный в плазматическую мембрану клетки; наружу экспонированы а-субъединицы, а ß-субъединицы пронизывают мембрану; фрагмент полипептидной цепи ß-субъединицы, локализованный в цитозоле, обладает тирозинкиназной активностью, в частности по отношению к фосфатазе; последняя, будучи активирована, дефосфорилирует рад ферментов углеводного обмена и изменяет их активность
Инсулины, выделенные из поджелудочной железы различных животных, почти идентичны по первичной структуре (см. табл. 8). При недостаточном уровне биосинтеза инсулина в поджелудочной железе человека (в норме ежесуточно синтезируется 2 мг инсулина) развивается характерное заболевание — диабет, или сахарное мочеизнурение. При этом повышается содержание глюкозы в крови (гипергликемия) и растет выведение глюкозы с мочой (глюкозурия). Одновременно развиваются различные вторичные явления—падает содержание гликогена в мышцах, замедляется биосинтез пептидов, белков и жиров, нарушается минеральный обмен и т. п.
Введение инсулина путем инъекции или per os в виде препарата, инкапсулированного в липосомы, вызывает противоположный эффект: понижение содержания глюкозы в крови, повышение запасов гликогена в мышцах, усиление анаболических процессов, нормализацию минерального обмена и т. д. Все перечисленные выше явления представляют результат изменения под воздействием инсулина проницаемости для глюкозы клеточных мембран, на поверхности которых выявлены высоко- и низкоаффинные Са2+-зависимые инсулиновые рецепторы. Повышая уровень проникновения глюкозы внутрь клетки и субклеточных частиц, инсулин усиливает возможности ее использования в тех или иных тканях, будь то биосинтез из нее гликогена или дихотомический или апотомический ее распад (рис. 136).
При взаимодействии инсулина с рецептором клеточной мембраны возбуждается активность протеинкиназного домена инсулинового рецептора (рис. 136, IV), что сказывается на внутриклеточном метаболизе углеводов, липидов и белков. Сущность этого ясна из рассмотрения рис. 136, III. Для инсулина не типичен аденилатциклазный механизм действия.
Адренокортикотропный гормон (АКТГ) — 39-членный пептид, продуцируемый передней долей гипофиза. Он открыт в 1928 г., но лишь немногим менее чем через три десятилетия удалось расшифровать первичную структуру сначала АКТГ овцы (Ч. Ли и сотр., 1955), а затем свиньи (П. Белл и сотр., 1956). В настоящее время известна также первичная структура АКТГ быка, человека и акулы. Приведем в качестве примера строение АКТГ человека:

Как показал К. Гофман, видовая специфичность АКТГ обусловлена чередованием аминокислотных остатков в позициях 25—33. Участок молекулы АКТГ между 1-ми 13-м аминокислотными остатками абсолютно необходим для обеспечения активности гормона. Между 14—20-м аминокислотными остатками располагается якорная площадка гормона (15—18-й остатки, т. е.— лиз—лиз—арг—арг—). Пептидная группировка из 19 аминокислотных остатков (позиция 21—39) может быть удалена без каких-либо последствий для активности гормона, но она определяет его иммунологическую специфичность.
АКТГ оказывает разностороннее действие: повышает активность фосфорилазы, липазы и глюкозо-6-фосфатдегидрогеназы, усиливает синтез белков и рибонуклеиновых кислот и др. Однако главная его функция в организме сводится к регуляции интенсивности и объема биосинтеза кортикостероидов надпочечными железами. В свою очередь, падение в крови концентрации кортикостероидов ниже определенного уровня стимулирует выработку АКТГ в передней доле гипофиза. Известно также, что АКТГ стимулирует главным образом биосинтез глюкокортикостероидов, изменяя, таким образом, соотношение между различными кортикостероидами, продуцируемыми надпочечными железами.
Есть основания полагать, что АКТГ, с одной стороны, повышает биосинтез кортикостероидов, обеспечивая более высокий уровень в организме НАДФН, необходимого для их новообразования из холестерола. С другой стороны, АКТГ активирует мембранно-связанную аденилатциклазу, т. е. биосинтез цАМФ (см. ниже), сказывающийся на интенсивности протеинкиназных реакций при стероидогенезе.
Меланоцитостимулирующий гормон (МСГ) — 18-членный пептид, образуемый средним (а у ряда видов, например у свиньи, задним) отделом гипофиза животных. МСГ человека представлен 22-членным пептидом, очень похожим на МСГ животных.
Хотя сведения о существовании в среднем отделе гипофиза МСГ относятся к 1932 г., впервые он был получен в 1955 г. из задней доли гипофиза свиньи Дж. Поратом, разработавшим детальный метод выделения гипофизарных пептидов. Он был назван а-МСГ. В том же году был выделен также из задней доли гипофиза сходный с ним МСГ, обозначенный ß-МСГ.
Строение молекулы а-МСГ свиньи, выясненное Дж. Гаррисом и П. Россом (1956), таково:
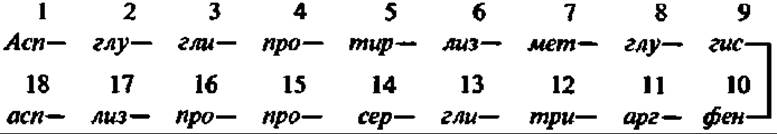
Сейчас известна также первичная структура а- и ß-МСГ человека, обезьяны, быка, лошади, верблюда и акулы, а- и ß-МСГ свиньи синтезированы. Кроме того, получено около двух десятков аналогов МСГ.
Механизм действия ß-МСГ на меланоциты у низших позвоночных в настоящее время рассматривают с точки зрения влияния ß-МСГ на переход гранул, содержащих меланин, из состояния геля в состояние золя. Это сопровождается распределением пигмента в клетке и ее потемнением. Смысл изменения степени потемнения покровов у низших позвоночных сводится к адаптации их к окружающим условиям. Роль МСГ у высших позвоночных неясна.
Паратгормон — белок, синтезируемый паращитовидными железами. Впервые на гормональные свойства кислого экстракта из паращитовидных желез указал Дж. Коллип (1925). Однако в индивидуальном состоянии паратгормон получен значительно позже благодаря усилиям Г. Аурбаха и X. Расмуссена (1959—1964). Он оказался белком с М = 9500, состоящим из 84 аминокислотных остатков. Первичная структура паратгормона быка была окончательно выяснена в 1970 г. Дж. Поттсом с сотр.:

Аналогично, с небольшими отличиями (всего несколько аминокислотных замен) построены паратгормоны человека и свиньи.
Паратгормон регулирует содержание катионов кальция и анионов фосфорной и лимонной кислот в крови. При длительном дефиците солей кальция в пище или при нарушении всасывания солей кальция в кишечнике содержание их в крови понижается. Это ведет к повышению синтеза и выделения паращитовидными железами гормона, который мобилизует соли кальция (в виде цитратов и фосфатов) из костной ткани. Поддержание нормального уровня Са2+ в крови достигается усилением под влиянием паратгормона экскреции фосфатов почками, в результате чего замедляется отложение фосфата кальция в костях.
Биологическая активность паратироидного гормона обеспечивается N-концевым фрагментом длиной не менее 28 аминокислотных остатков, причем особо важны первые две N-концевые аминокислоты.
Точкой приложения действия паратгормона являются рецепторные белки плазматической мембраны клеток-мишеней и зависимая от них активация аденилатциклазы, в результате чего в клетках повышается содержание цАМФ (см. ниже). Это сопровождается усилением протеинкиназных реакций, активированием мембранно-связанной Са2+-зависимой АТФазы, что приводит к перераспределению кальция в компартментах клетки и, в конечном счете, между тканями и органами.
Тиреотропин — белок, выделяемый передней долей гипофиза. Он представляет собой гликопротеин с М = 28 300, составленный из двух неравных субъединиц (М = 13600 и 14700), исключительно богатых дисульфидными мостиками (5 и 6 соответственно). Первичная структура тиреотропина быка и свиньи выяснена. При недостатке тиреотропина (гипофункция гипофиза) ослабляется деятельность щитовидной железы, она уменьшается в размерах, а содержание в крови выделяемого ею гормона — тироксина (см. ниже) — сокращается вдвое.
Таким образом, тиреотропин стимулирует деятельность щитовидной железы. В свою очередь, выделение тиреотропина регулируется по принципу обратной связи гормонами щитовидной железы. Следовательно, деятельность двух упомянутых желез внутренней секреции тонко координирована.
Введение тиреотропина вызывает множественные сдвиги в обмене веществ: через 15—20 мин повышается секреция гормонов щитовидной железы и усиливается поглощение ею иода, необходимого для синтеза этих гормонов (см. ниже); повышается поглощение кислорода щитовидной железой, возрастает окисление глюкозы, активируются обмен фосфолипидов и новообразование РНК. Сейчас выяснено, что механизм действия тиреотропина, как и многих других пептидных гормонов, сводится к активированию аденилатциклазы, расположенной в непосредственной близости от рецепторного белка, с которым связывается тиреотропин. Как следствие этого, в щитовидной железе ускоряется ряд процессов, в том числе и биосинтез тиреоидных гормонов.
Гормон роста (соматотропний гормон, СТГ) — белок, секретируемый передней долей гипофиза позвоночных животных. Наличие его в экстрактах из гипозифа было отмечено еще в 1921 г. Г. Эвансом и Дж. Лонгом, однако лишь через два десятилетия (1944) он был получен в виде очищенного препарата, а через несколько лет после этого (1948) — в кристаллическом состоянии.
В зависимости от вида животного (бык, овца, свинья, крыса и др.) молекулярная масса кристаллического препарата гормона роста колеблется от 20 000 до 22000.
В гипофизе человека содержится от 3,7 до 6,0 мг СТГ. Обладая М = 21000, он представлен одной полипептидной цепочкой из 191 аминокислотного остатка. Первичная структура ее выяснена Ч. Ли и сотр. (1969) и уточнена Г. Наилом с сотр. (1973). Известна также первичная структура СТГ быка и овцы (по 191 аминокислотному остатку). Изучена последовательность аминокислотных остатков в гормоне роста многих рыб (байкальского омуля, кеты, форели, угря, трески, лосося, щуки и др.) и выявлена множественность генов, кодирующих слегка различающиеся варианты полипептидных цепей СТГ даже у одного и того же вида рыб. Эти данные открывают новое направление в химии гормонов пептидной природы, раскрывающее причину множественности не только у СТГ, но и во многих других случаях.
Третичная структура СТГ человека характеризуется сближенностью Сu N-концевых аминокислот, наличием четырех мощных спиралей, охватывающих половину его полипептидной цепи и присутствием неорганизованной последовательности, составляющей вторую половину молекулы. В узнавании рецептора СТГ участвуют его 1-ая и 2-ая а-спирали и часть неупорядоченной петли, соединяющей 1-ую и 2-ую спирали; вслед за этим по 1-ой и 3-ей спиралям присоединяется вторая молекула рецептора, что обеспечивает его димеризацию и передачу гормонального сигнала. Содержание СТГ в крови человека в норме колеблется в широких пределах — от 0—3 мкг/мл после ночного голодания до 100 мкг/мл после приема сахара.
Гормон роста обладает ярко выраженным анаболическим действием и влияет на все клетки организма, повышая в них уровень биосинтетических процессов. Он усиливает биосинтез белков, ДНК, РНК и гликогена, но способствует мобилизации жиров из жировых депо и ускоряет распад высших жирных кислот и глюкозы. СТГ улучшает функции почечных канальцев и нормализует минеральный и водный обмен организма. Все это способствует росту организма, но в конечном счете действие СТГ гораздо шире, нежели только регуляция роста.
Исследования на молекулярном уровне показали, что СТГ стимулирует деятельность РНК-полимераз и полирибосомного аппарата клетки. Как свидетельствуют опыты с меченым фосфором, самым ранним эффектом действия гормона роста является синтез в ядрах клеток предшественников мРНК и рРНК. Вместе с тем велико его влияние и на проницаемость клеточных стенок, так как фонд внутриклеточных аминокислот в присутствии СТГ значительно возрастает, что способствует новообразованию белков. Возможно, первопричиной всех этих явлений служит все же активирование мембранно-связанной аденилатциклазы. Вместе с тем показано, что СТГ повышает содержание в крови особых стимулирующих рост факторов — соматомединов — белков с M ≈ 7000. Механизм их действия активно изучают.
Гормон ожирения — лептин (от греч. leptos — тонкий) открыт группой исследователей во главе с Дж. Фридманом в 1992 г., хотя первые сведения о мутациях гена «ob» (obese — ожирение), вызывающих ожирение у мышей, были получены в начале 50-ых гг. Этот белковый гормон, экспрессирующийся в адипоцитах в виде 167-членного предшественника, экспретируется в кровь в качестве активного пептидного гормона, составленного из 145 аминокислотных остатков, последовательность которых выяснена. При парэнтеральном и внутривенном введении его в количестве нескольких микрограммов на животное в день происходит повышение энергетического обмена, снижение потребления пищи, увеличение двигательной активности и снижение веса мышей вследствие уменьшения запасов жира в организме. После прекращения введения лептина все исследованные параметры достаточно быстро возвращаются к исходному уровню. Предполагают, что гормон ожирения секретируется адипоцитами в кровь в изменяющихся количествах в зависимости от потребностей организма. Какие клетки или ткани играют роль «липостата» и каков механизм взаимодействия гормона с рецептором и метаболических изменений, происходящих в ответ на рецепцию, остается неизвестным. Заметим, что вопрос об использовании лептина для лечения ожирения у человека потребует специального исследования.
Механизм действия пептидных гормонов. Пептидные гормоны не проникают внутрь клеток-мишеней и взаимодействуют с белковыми рецепторами, расположенными на их поверхности, в плазматической мембране. Поэтому их механизм действия принципиально отличается от такового стероидных гормонов.
Подавляющее большинство гормонов пептидной природы в результате связывания с рецепторным комплексом клеточной мембраны возбуждает активность аденилатциклазы, встроенной в эту же мембрану:
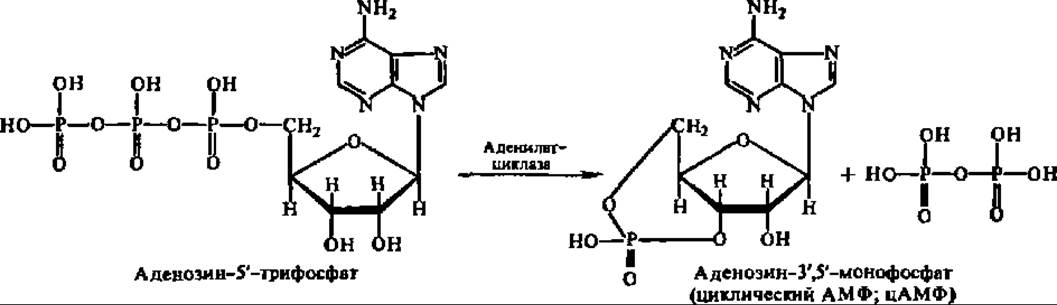
Возникающее при этом соединение — циклический аденозинмонофосфат, открытое в 1957 г. одновременно двумя группами исследователей — Е. Сатерлэндом с сотр. и Д. Маркхэмом с сотр., оказалось тем веществом, которое передает гормональный сигнал метаболическим системам клетки, т. е. является, по существу, вторичным посредником в передаче этого сигнала (первичный посредник — рецепторный белок, воспринимающий гормональный сигнал). Дело в том, что цАМФ является аллостерическим регулятором протеинкиназ, при участии которых фосфорилируются гистоны и негистоновые белки хроматина (это сказывается на метаболической активности генома клетки и, в частности, на уровне биосинтеза мРНК), рибосомальные белки и белковые факторы трансляции (это отражается на интенсивности новообразования белков в рибосомальном аппарате клетки), многие ферменты (что предопределяет степень их активности) и т. п. Поскольку это затрагивает фундаментальные стороны обмена веществ, то вполне объяснимы биохимические и физиологические явления, наблюдаемые при недостатке или избытке пептидных гормонов. Ряд конкретных примеров такого механизма действия пептидных гормонов был рассмотрен ранее при изучении реакции фосфоролиза гликогена, липолитических процессов и др.
Передача гормонального сигнала аденилатциклазе осуществляется в результате работы гормон-рецепторного комплекса, структура которого представлена на рис. 137. Ключевыми в системах сопряжения гормонального и иных сигналов с образованием вторичных посредников являются G-белки. Они могут стимулировать (Gs = белки) и ингибировать (Gі-белки) передачу сигналов. Многие из них выделены в гомогенном состоянии, расшифрован их субъединичный состав: содержать всегда а (М = 39—52 тыс. Да), ß (35 тыс. Да) и у (8—10 тыс. Да). Выяснена первичная структура ряда субъединиц и их функциональная активность (рис. 138). Что касается рецепторов, обеспечивающих сопряжение действия сигнала с гетеротримерными G-белками, то сейчас их уже известно более сотни. Они не только обеспечивают передачу сигнала к G-белкам, но и способны умножать этот сигнал до тех пор, пока на них действует лиганд, так как каждый рецептор может активировать множество G-белков, пока с ним продолжает оставаться связанной сигнальная молекула. Таким образом G-белок-сопряженные. взаимодействия образуют многовекторную и многоуровневую сеть передачи и обработки сигнальной информации. Рецепторы, несмотря на функциональные различия, обладают высокой степенью структурной гомологии, так как каждый из них включает 7 трансмембранных доменов, представленных а-спиральными конформациями полипептидной цепи.
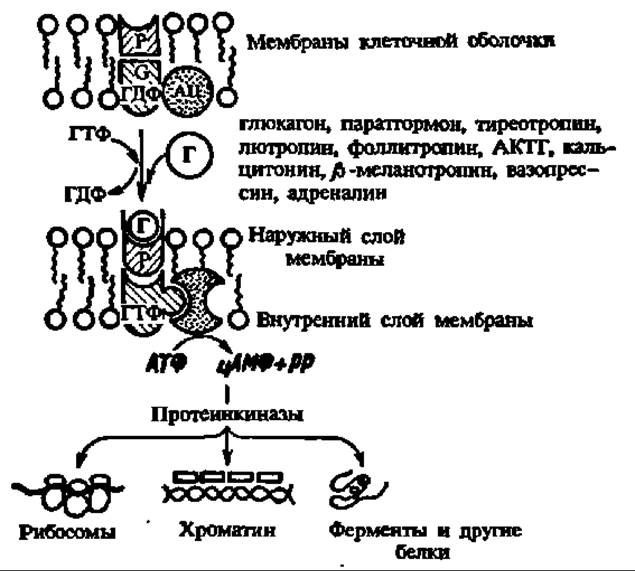
Рис. 137. Механизм действия гормонов пептидной природы:
Р — рецептор гормона; G — регулярный белок, способный связывать гуаниловые нуклеотиды (отсюда название — G-белок), сопрягающий мембранный рецептор с системой вторичных посредников; АЦ — аденилатциклаза, Г — гормон. При взаимодействии рецептора с гормоном сигнал передается регуляторному G-белку, в котором связанная с ним ГДФ заменяется на ГТФ. Это приводит к активированию аденилатциклазы и синтезу цАМФ
Концентрация цАМФ, а также другого вторичного посредника (цГМФ) контролируется фосфодиэстеразами циклических нуклеотидов, которые ускоряют гидролиз цАМФ и цГМФ и прекращают их регуляторное действие. Активность же фосфодиэстеразы цАМФ ингибируется 2', 5'-олигоаденилатом. Так создается многозвенная система регуляции протеинкиназных реакций в клетке:
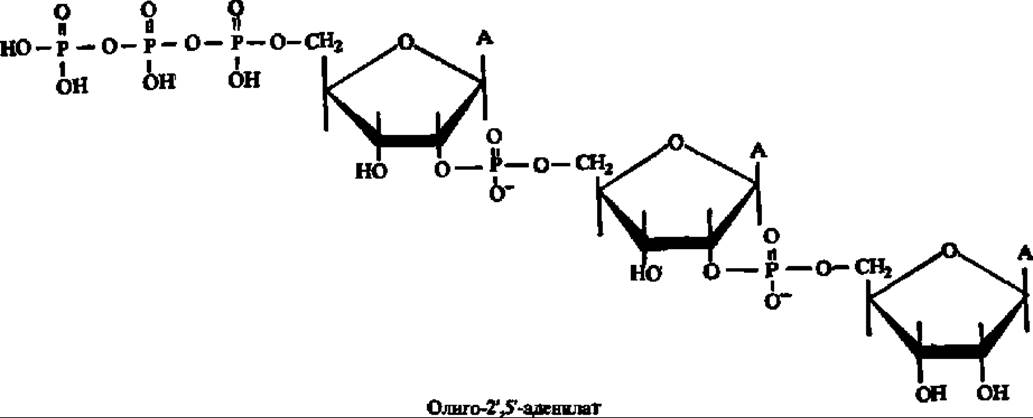
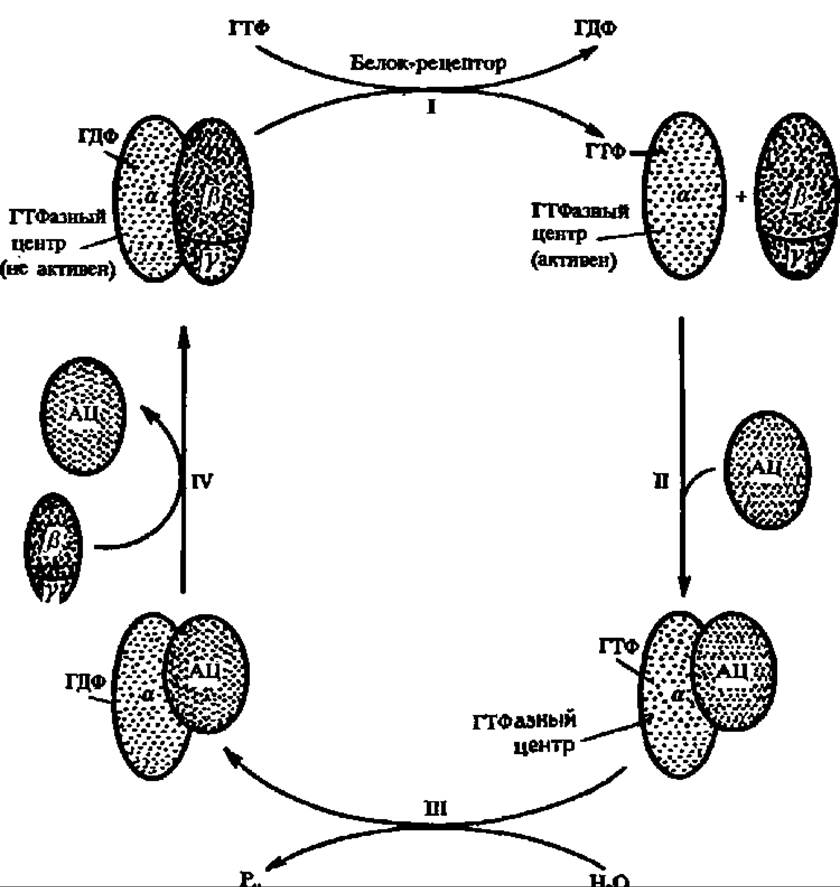
Рис. 138. Структура и механизм действия G-белка:
І — под воздействием рецептора гормона ГДФ отделяется от G-белка и заменяется на ГТФ, а сам G-белок диссоциирует на а-субъединицу и комплекс ß- и у-субъединиц; II — а-субъединица сближается с аденилатциклазой и активирует ее, что обеспечивает образование цАМФ; III — медленно работающий ГТФазный центр гидролизует ГТФ, что приводит к утрате а-субъединицей ее активирующего воздействия на аденилатциклазу и инактивации последней; синтез цАМФ прекращается; IV — а-субъединица высвобождает аденилатциклазу и ассоциируется с комплексом ß- и у-субъединиц; система приходит а исходное состояние и готова снова принять и реализовать гормональный сигнал
Однако некоторые из гормонов пептидной природы действуют не по аденилатциклазному механизму. Например, инсулин, связываясь с белковым рецептором (М = 460 000, гликопротеин, состоящий из 4 субъединиц) плазматической мембраны клетки-мишени, изменяет ее проницаемость (см. рис. 136). В результате этого усиливается проникновение в клетку субстратов (глюкоза, аминокислоты и др.) и в ней на полную мощность включаются в работу соответствующие ферменты. Аналогичным образом действует окситоцин: образование гормон-рецепторного комплекса сопровождается усилением переноса Са2+, что инициирует сокращение мышечных волокон альвеол молочных желез.
Биосинтез пептидных гормонов. Биосинтез всех пептидных гормонов, за исключением рилизинг-факторов (см. ниже в этом разделе), протекает в соответствии со схемами, известными для биосинтеза белковых тел. Однако есть, по крайней мере, три особенности в биосинтезе пептидных гормонов, которые следует отметить.
Первая из них состоит в том, что, как правило, пептидные гормоны возникают путем протеолитической фрагментации высокомолекулярных предшественников — препрогормонов. При этом от них сначала отщепляются сигнальные пептиды (см. с. 300), способствовавшие выведению предшественников гормонов из железистых клеток, а потом — пептидные фрагменты прогормонов.
Вторая особенность касается биосинтеза пептидных гормонов, молекулы которых состоят из нескольких пептидных цепочек, как, например, у инсулина. Выяснено, что соединение пептидных цепочек друг с другом идет при участии инсулин: глутатионтрансгидрогеназы:
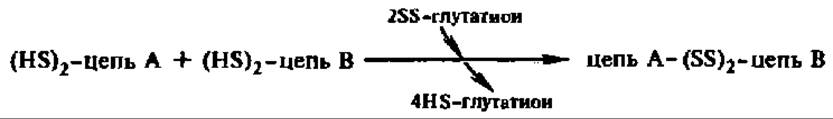
Впрочем, в последнее время выявлено, что вообще замыкание SS-мостиков в биологически активных белках осуществляется ферментативным путем. Поэтому, возможно, эта реакция не столь специфична для пептидных гормонов.
Третья особенность заключается в том, что биосинтез пептидных гормонов регулируется в ряде случаев нейрогормонами, продуцируемыми особым участком головного мозга — гипоталамусом. Они представлены олигопептидами, и их насчитывается около десяти. Структура 4 из них выяснена. Так как они либо усиливают синтез пептидных гормонов гипофиза, попадая в него по капиллярной системе прямо из гипоталамической области, либо ослабляют его, их называют либеринами и статинами соответственно (сохраняется и первоначальное название, а именно — рилизинг-факторы, т. е. облегчающие высвобождение тройных пептидных гормонов). Так, благодаря титанической работе, проведенной двумя группами ученых (Р. Гиллемин с сотр. и Э. Шелли с сотр.; половина Нобелевской премии 1977 г. по физиологии и медицине), в конце 70-х годов была установлена структура тиролиберина — трипептида, резко повышающего выделение гипофизом тиреотропина:
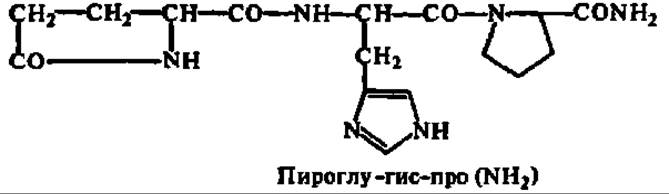
Не следует забывать также, что пептидные гормоны с тройными функциями подчиняются регуляции по принципу обратной связи теми конкретными гормонами, биосинтез которых они ускоряют.
Открытие рилизинг-факторов послужило толчком для мощного всплеска работ по изучению регуляторных функций пептидов. Наиболее выдающимся их результатом оказалось обнаружение семейства опиоидных, эндогенных пептидов (эндорфины и энкефалины), являющихся индукторами ощущений удовольствия, приятного настроения, состояния эйфории в результате их прямого морфиноподобного воздействия на опиатные рецепторы центральной нервной системы. Они же оказывают болеутоляющее действие, влияют на кровяное давление, двигательную и дыхательную функцию, температуру тела и т. п. Будучи пептидами протяженностью от 5 до 31 аминокислотного остатка, опиоидные пептиды возникают из проопиокортина (М = 29 к Да, 265 аминокислотных остатков, синтезируется в мозге) путем его селективного гидролиза. Так как характерная для них последовательность с N-конца молекулы — тир-гли-гли-феп-довольно распространена в пищевых белках, они могут возникать при деструкции последних.
Открытие опиоидных пептидов и ряда других нейропептидов поставило проблему возможных социальных последствий развития этой области эндокринологии; его расценивают сейчас как «нейропептидную революцию».