Основы биохимии - Филиппович Ю. Б. 1999
Белки
Выделение белков
Хотя около двух десятков белков (инсулин, рибонуклеаза, лизоцим, цитохром с, соматотропный гормон, ß-липотрогаш, ацилпереносящий белок, а-бунгаротоксин, кобротоксин, кардиотоксин, ингибитор гастрина, ингибитор трипсина, аполипопротеин, ферредоксин др.) удалось синтезировать и, таким образом, сделать первый шаг на очень трудном пути их искусственного создания, синтезы эти очень сложны, трудоемки, длительны и дороги. Поэтому единственно реальным методом получения белков служит выделение их из природных источников. Но и это нелегкая задача, так как белки обладают особой чувствительностью к действию большинства химических реагентов (кислот, щелочей, органических растворителей и др.) и разрушаются от обычных процедур, применяемых при очистке веществ (нагревание, перегонка, возгонка, экстракция и т. п.). Возможен также автолиз (самопереваривание) выделяемых белков. Белок очень легко теряет свои природные, присущие ему в естественном состоянии нативные свойства (растворимость, биологическую активность и т. п.), и переходит в денатурированное состояние. Чтобы избежать денатурации белка в процессе его выделения, все операции проводят в мягких условиях: при низкой (не выше + 5° С) температуре, избегая действия резких химических реагентов.
Впервые белок (клейковина) был выделен Я. Беккари из пшеничной муки в 1728 г. Эту дату принято считать годом зарождения химии белка. В 1762 г. началась работа по изучению белка молока — казеина (А. Халлер), затем с 1789 г. — белков крови (А. Фуркруа). За два с половиной столетия из природных источников получены сотни различных белков и изучены их свойства.
Для успешного выделения белка из биологического объекта необходимо тончайшее измельчение тканей вплоть до разрушения клеточных стенок. Для этого используют (рис. 6) специальные валковые (А) или шаровые (Б) мельницы, в которых исходный материал многократно продавливается между тесно сближенными валками или расплющивается непрерывно сталкивающимися шарами. С этой же целью широко применяют гомогенизаторы (В и Г), в которых материал либо измельчается острыми ножами, вращающимися с огромной скоростью (12000 об/мин и более), либо растирается между пришлифованными стенками стеклянных пробирки и пестика, либо в замороженном состоянии продавливается через фильеры специального пресса (Д).
Хорошие результаты дает метод разрушения клеточных оболочек путем попеременного замораживания и оттаивания ткани. Роль «рабочего инструмента» выполняют здесь кристаллики льда, разрывающие стенки клеток и освобождающие клеточное содержимое. Применяют также метод «азотной бомбы», заключающийся в насыщении суспендированных клеток газообразным азотом под высоким давлением, которое затем резко сбрасывают, — азот, проникший внутрь клеток, выделяется в виде газа и «взрывает» их.
Классификация методов разрушения (дезинтеграции) биологического материала, отражающая разнообразие подходов, используемых с этой целью при выделении белков и других соединений из природных объектов, приведена в табл. 2.
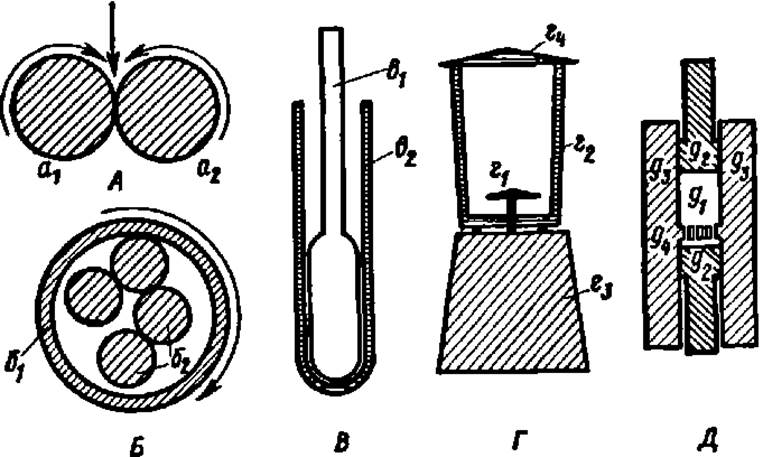
Рис. 6. Устройство приборов для измельчения биологического материала при выделении белков;
А—валковая мельница (а1 и а2 — валки, вращающиеся навстречу друг другу; прямая стрелка указывает направление поступления измельчаемого материала); Б — шаровая мельница (б1— корпус; б2 — шары; стрелка указывает направление вращения корпуса); В — ручной гомогенизатор (в1 — пестик; в2 — корпус); Г — механический гомогенизатор (г1 — нож; г2 — камера для измельчения материала; г3 — корпус с электродвигателем и пусковым устройством; г4 — крышка); Д — рабочая камера прибора для измельчения пресс-методом (д1 — пространство, заполненное биологическим материалом; д2 — плунжеры для продавливания материала; д3 — стенки камеры; д4 — перегородка с тончайшими отверстиями)
Когда достигнуто тонкое измельчение материала, переходят к следующему этапу—извлечению белков. Белки извлекают чаще всего солевыми растворами, взятыми в концентрации 8—10%. Подавляющая часть белков хорошо растворима в таких солевых растворах. Различные соли обладают разным растворяющим действием по отношению к белку. Ниже приведен ряд катионов и анионов, расположенных в порядке убывания их растворяющего действия:
![]()
Таблица 2 Классификация дезинтегрирующих воздействий по их природе (по Б. А. Фихте и Г. А. Гуревичу, 1988)
|
Физические |
Химические |
Энзиматические |
Биологические |
|
механические |
немеханические |
|||
Баллистические; экструзионные; ультразвуковые; газодекомпрессорные; гидроударные; электрогидроударные; комбинированные |
Осмотический, тепловой или холодовый шок; замораживание — оттаивание; замораживание — высушивание; дегидратация — регидратация; медленная газовая декомпрессия; фазовые переходы при высоких давлениях |
Действие щелочей, кислот, солей, детергентов, антибиотиков, хелатных агентов, органических растворителей |
Действие бактериологических, дрожжелитических, миколитических ферментов и иммобилизованных литических ферментов |
Действие фагов, бактериоцинов и других киллеров (убийц), внутриклеточных паразитов, плазмидоподобных факторов. Ингибирование синтеза клеточной оболочки. Автолиз |
Таким образом, максимальным растворяющим действием должен обладать пирофосфат лития, минимальным — хлорид натрия.
Так как на растворение белков сильное влияние оказывает pH среды, большинство солей применяют в виде буферных смесей (фосфатных, ацетатных, боратных, цитратных и т. п.). В последнее время широко используют буферные смеси, составленные с применением органических соединений — трис-(оксиметил)-аминометана (HOCH2)3CNH2 и его соли с НСl (трис-буфер); диэтилбарбитуровой кислоты и ее натриевой соли (веронал-мединаловый буфер); N,N-бис-(2-оксиэтил)-глицина (HOCH2CH2)2NCH2COOH (бициновый буфер); N- [трис-(оксиметил)-метил]-глицина (HOCH2)3CNHCH2COOH (трициновый буфер) и т. п.
Хорошие результаты дает извлечение белков спирто-солевыми смесями. Металлопротеины, образующиеся при этом, обладают разной растворимостью в спирте, что позволяет извлекать индивидуальные белки при различной концентрации спирта. Весьма широко применяют для экстракции белков глицерин, предохраняющий их от денатурации.
Извлечению белков из биологического материала способствует его обработка детергентами: додецилсульфатом натрия, дезоксихолатом натрия, тритоном X-100, алкилгликозидами и триалкиламмониопропансульфонатами:
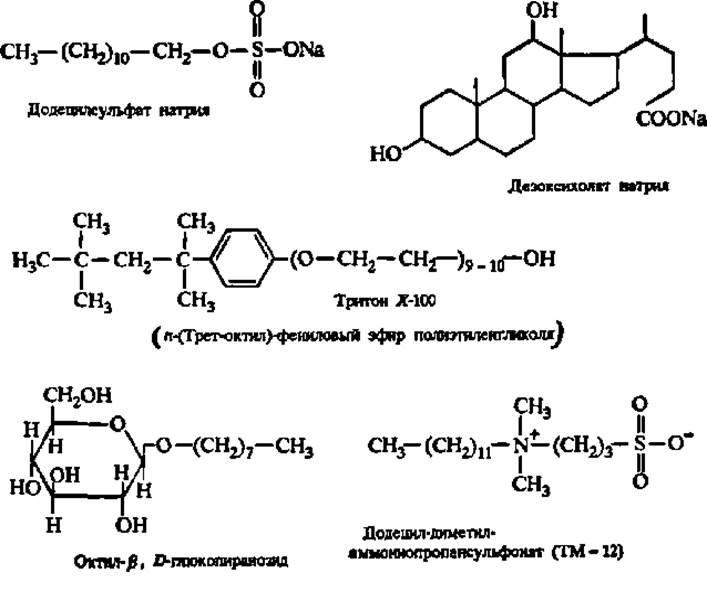
Перечисленные детергенты ослабляют гидрофобные белково-липидные и белок-белковые взаимодействия, результатом чего являются деструкция биологических мембран и высвобождение из них структурных и функциональных белковых компонентов.
Сказанное выше о выделении белков в основном относится к животным тканям Выделение белков из растительного материала неизмеримо труднее: здесь сложнее разрушить стенку клеток, более вероятна денатурация белков за счет их взаимодействия с дубильными веществами и т. п. Поэтому при выделении белков из вегетативных органов растений используют специфические приемы: обработку тканей водно-эфирной смесью, резко повышающей проницаемость оболочки растительной клетки (метод Чибнелла), экстракцию белков смесью фенола, уксусной кислоты и воды (метод Синджа) и др.
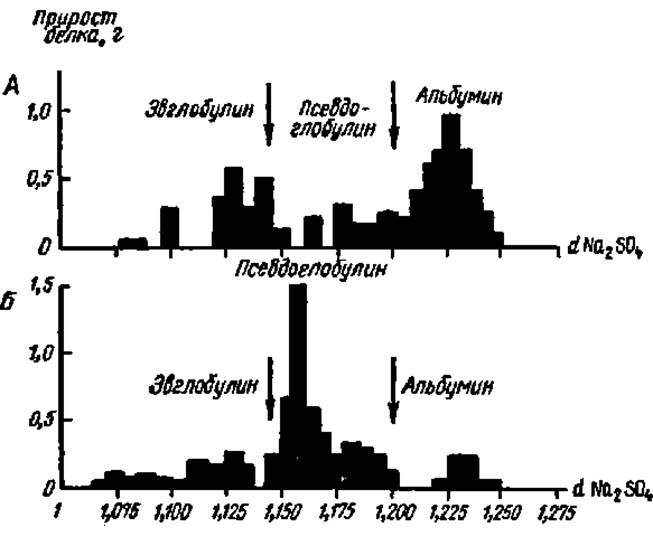
Рис. 7. Разностные диаграммы высаливания белков:
А — белки сыворотки крови человеки: Б — белки гемолимфы шелкопряда. Каждый столбик ни диаграмме соответствует тому количеству белка, которое выпало в осадок при изменении концентрации Na2SО4 на 0,005 (в единицах плотности раствора). Стрелки указывают на концентрации Na2SО4, являющиеся пограничными для отделения фракций друг от друга
После экстракции смеси белков из биологического материала проводят разделение полученной смеси на индивидуальные белки, поскольку в состав растительных и животных тканей входит множество различных белков, экстрагирующихся в той или иной пропорции в процессе выделения. Фракционирование белков ведут разными способами: солями, органическими растворителями, электрофоретически, хроматографически, методом молекулярных сит и т. п.
Метод фракционирования белков солевыми растворами основан на том, что каждый индивидуальный белок разделяемой смеси осаждается из нее при определенной концентрации той или иной соли, в то время как другие белки при данной концентрации соли остаются в растворе. Процесс осаждения белка из раствора под действием соли называется высаливанием. При дальнейшем насыщении солью выпадает следующий индивидуальный белок и, таким образом, последовательно наращивая содержание соли в реакционной среде, можно один за другим выделить относительно чистые индивидуальные белки. Чтобы определить те границы концентрации соли, в которых происходит осаждение определенного белка, строят разностные диаграммы (рис. 7).
Из органических растворителей для фракционирования белков широко применяют метиловый и этиловый спирты (во избежание денатурации белка процесс ведут при температуре около 5° С). В этих случаях также предварительно строят разностные диаграммы. На рис. 8 приведены данные о концентрациях этилового спирта при осаждении разных фракций белков сыворотки крови человека. Этот метод нашел широкое применение при выработке заменителей крови, так как позволяет извлекать из нее необходимые ингредиенты и длительно сохранять их. При фракционировании белков иногда сочетают высаливание и осаждение спиртом, применяя спиртосолевые растворы.
Метод осаждения ионами тяжелых металлов находит ограниченное применение при фракционировании белков и осуществляется в большинстве случаев в сочетании с другими методами фракционирования (высаливание, осаждение органическими растворителями). Метод основан на взаимодействии ионов Hg, Zn, Ca, Ba, Pb, Fe, Cu, U и других тяжелых металлов с реакционноспособными аминокислотными радикалами белковой молекулы (Hg2+ — с сульфгидрильными группами, Zn2+ — с имидазольными, Са2+ и Ва2+ — с радикалами фосфосерина и т. п.).
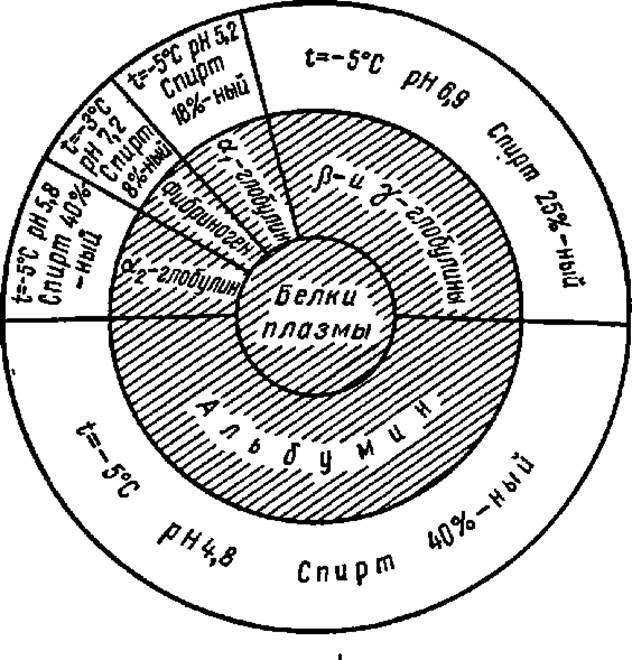
Рис. 8. Диаграмма фракционирования белков плазмы крови человека этиловым спиртом
Метод электрофореза основан на способности различных белков перемещаться под Действием электрического поля с неодинаковой скоростью (а иногда и в противоположных направлениях) в растворе, на влажной фильтровальной бумаге или в другой твердой опорной среде. Напряжение при этом устанавливают от нескольких сотен до нескольких тысяч вольт, силу тока — в несколько десятков миллиампер. Скорость передвижения белковых молекул определенного вида к аноду или катоду является функцией электрического заряда, молекулярной массы и формы молекул, ионной силы, pH и состава буферного раствора, а также приложенных потенциалов. Сочетание перечисленных факторов всегда специфично для каждого индивидуального белка, и естественно, что разные белки обладают различной электрофоретической подвижностью.
Наибольшее распространение получил электрофорез в твердых поддерживающих средах: целлюлозе, ацетилцеллюлозе, геле агар-агара, крахмальном и полиакриламидном гелях. На электрофореграммах белки выявляют с помощью красителей: амидового черного (амидошварц 10В), бромфенолового синего, кумасси бриллиантового голубого и др.:
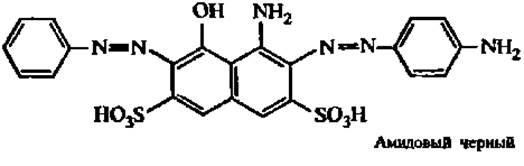
Однако в 100—200 раз чувствительнее реакция обнаружения белков посредством окрашивания их в гелях аммиачными комплексами серебра.
Особенно перспективен метод электрофореза в твердых средах, приготовленных из сополимера акриламида и метиленбисакриламида, имеющего трехмерную структуру:
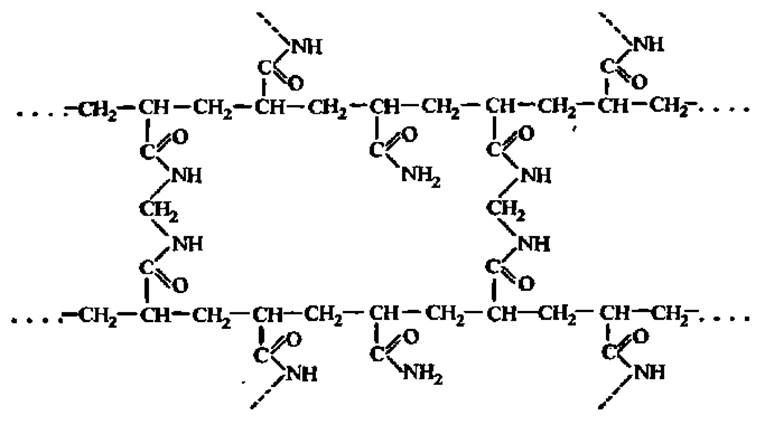
В зависимости от соотношения в реакционной среде акриламида и N, N-метиленбисакриламидз трехмерная структура в процессе сополимеризации получается мелко-, средне- или крупноячеистой. При электрофорезе белковые молекулы с разной степенью легкости проходят через указанные ячейки, что и обеспечивает фракционирование белков. Так, при фракционировании белков сыворотки крови человека посредством электрофореза на бумаге наблюдают 6 фракций, в крахмальном геле — 10, а в полиакриламидном геле — 16 фракций (рис. 9).
Еще большая дробность фракционирования белковых смесей вплоть до выделения индивидуальных белков обеспечивается при проведении электрофореза в поддерживающих средах с градиентом pH. Поскольку в этом случае положение белка на том или ином уровне в колонке или тонком слое носителя определяется значением его изоэлектрической точки, метод получил название изоэлектрического фокусирования (синонимы — электрофокусирование, изотахофорез). Градиент pH создается при посредстве специально синтезированных для этой цели О. Вестербергом полиаминополикарбоновых кислот — амфолинов, состав которых выражается следующей формулой:
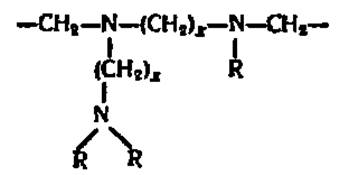
где х = 2—3, a R—Н или —(СН2)х—СООН. Молекулярная масса амфолинов колеблется от 300 до 1000, причем в зависимости от соотношения в их молекулах третичных атомов азота и карбоксильных групп в водных растворах амфолинов обеспечивается диапазон pH от 3 до 10.

Рис. 9. Разрешающая способность твердых поддерживающих сред при фракционировании белков сыворотки крови человека методом электрофореза:
(А — целлюлоза; Б. В — крахмальный и полиакриламидный гели). На алектрофореграммах А, Б, В — левая мощная белковая фракция — альбумин; правая — комплекс у-глобулиноа, между ними — фракции остальных глобулинов. Во всех случаях исследован один и тот же препарат, нанесенный на зону старта в количестве 100, 80 и 5 мкл соответственно
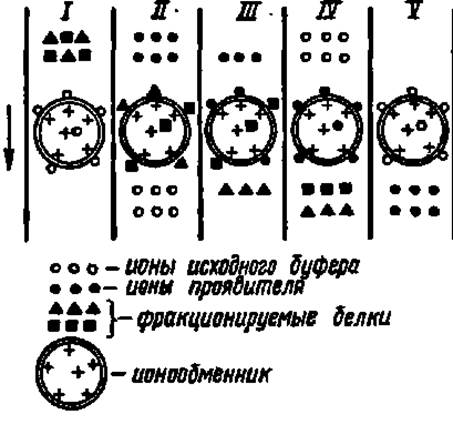
Рис. 10. Механизм ионообменной хроматографии белков
Механизм ионообменной хроматографии сводится к вытеснению противоионов, связанных с анионными и катионными центрами ионообменника (І) ионогенными группировками белковых молекул (II) и связыванием последних с ионообменвиком за счет электростатического взаимодействия. В зависимости от вида белка и особенно от соотношения в его составе радикалов главным образом дикарбоновых аминокислот и диаминокнслот суммарный эффект этих связей варьирует, вследствие него разные белки С неодинаковой скоростью вытесняются С ионообменника ионами проявителя (III и IV) и выходят из колонки раздельно. Затем ионообменник регенируют (10 полненную адсорбентом. В качестве адсорбента применяют производные целлюлозы и сефадекса (см. с. 325), несущие ионообменные группировки (аминоэтильные, сульфоэтильные, карбоксиметильные и др.), гель фосфата кальция, силикагель и другие носители. В тех случаях, когда носители избирательно связывают строго определенные белки, фракционирование белковых смесей идет очень эффективно. Такой вид хроматографии называют хроматографией сродства или аффинной хроматографией. За последние 5 лет широкое распространение получила металлохелат аффинная хроматография белков, основанная на их способности обратимо сорбироваться на иммобилизованных ионах переходных металлов, используя свободные координационные связи последних.
Одной из ее модификаций является хроматография, основанная на гидрофобном взаимодействии носителя (фенил- или октилсефароза) с соответствующими неполярными аминокислотными радикалами белковых молекул. - Применение эффективных сорбентов (различные производные силикагеля) и высокого давления при элюировании с них белков привело к возникновению ряда вариантов жидкостной хроматографии высокого разрешения.
Механизм ионообменной хроматографии белков представлен на рис. 10.
Для элюции адсорбированных белков с колонки используют солевые растворы, имеющие различные концентрации и значения pH. Если изменение концентрации солевого раствора осуществляется в процессе снятия белков с одной и той же колонки, такую элюцию называют градиентной. Элюат собирают небольшими порциями (по несколько миллилитров) в отдельные пробирки при помощи специальной установки — коллектора (сборщика) фракций. Таких проб в процессе фракционирования белков на колонке хроматографическим методом получают обычно несколько сотен. В результате проведения цветной реакции на белок или путем измерения поглощения каждого раствора в ультрафиолетовой области спектра устанавливают содержание белка в каждой пробе. По этим данным строят кривую, из рассмотрения которой становится ясным, сколько фракций белка содержится в элюате и в какой серии пробирок находится каждая фракция. Одноименные пробы объединяют и из полученного раствора выделяют чистый белок.
Фракционирование белков методом молекулярных сит основано на различной скорости перемещения белковых молекул (в зависимости от молекулярной массы) через колонку, заполненную специальным материалом — сефадексом1. Сефадекс получают путем обработки эпихлоргидрином полисахаридадекстрана, в результате чего между молекулами последнего возникает то или иное число поперечных связей:
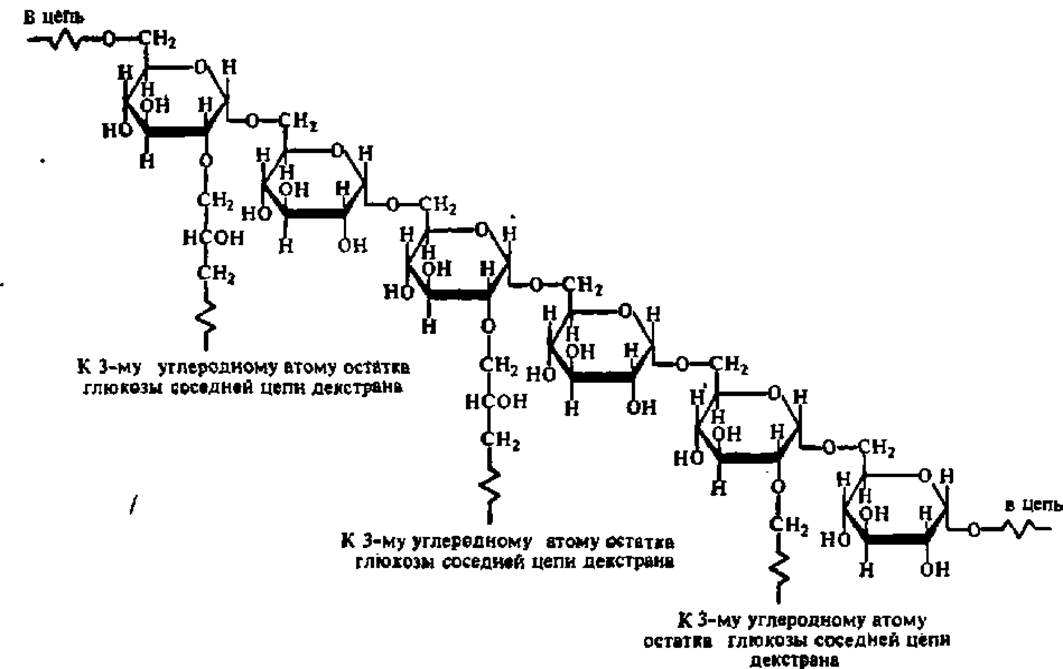
1 Его название образовано из начальных слогов трех слов; separation (разделение), pharmacia (название шведской фирмы, выпускающей реактивы) и dextran (декстран). Применяют также используя простейшую аппаратуру. Распределение белков между фазами определяется различиями в физико-химических свойствах фракционируемых белков и полимеров, входящих в состав верхней и нижней фаз: на основе комплекса свойств тех и других происходят взаимодействия (образование ионных и водородных связей, гидрофобные взаимодействия и др.), приводящие к накоплению определенного белка или группы белков в одной из полимерных фаз.
Аналогично этому обработка другого полисахарида — агарозы 2,3-дибром-пропанолом в резко щелочных условиях приводит к возникновению сетчатого полимера сефарозы, дающего гели, пригодные для фракционирования белков с молекулярными массами в сотни тысяч дальтон.
В зависимости от числа поперечных связей в сефадексе и размера белковых молекул осуществляется та или иная степень проникновения последних внутрь гранул сефадекса, заполняющих колонку. Большие белковые молекулы, не способные пройти через сито из ячеек в гранулу, быстро выносятся из колонки с током элюента; мелкие молекулы белка, проникшие внутрь зерна сефадекса, удерживаются некоторое время последним и выходят из колонки с последующими порциями элюата. Таким образом, колонка с сефадексом как бы просеивает через себя молекулы белка по их размерам, выпуская, как это ни парадоксально, первыми самые крупные молекулы (рис. 11). Так как гранулы сефадекса сильно разбухают в растворителе и образуют гель, этот метод называют также методом гельфильтрации.
Интересен предложенный П. А. Альбертсоном метод фракционирования белков с помощью двухфазных систем, составленных из водных растворов полимеров. При этом способе фракционирование осуществляется в мягких условиях (физиологические значения ионной силы и pH среды), а водные растворы полимеров оказывают стабилизирующее действие на разделяемые белки. Метод позволяет работать с любыми количествами вещества, аналогичные сефадексу материалы — молселект (сефадекс фирмы «Реанал», Венгрия), акрилекс и биогель Р (на базе полиакриламида), сефакрил (получают из аллилдекстрана и N, N'-метиленбисакриламила), сефарозу (получают из агарозы) и др. Перечисленные материалы нашли широкое применение не только для фракционирования белков, но и для разделения нуклеиновых кислот, высших углеводов и других биополимеров (см. также с. 325).
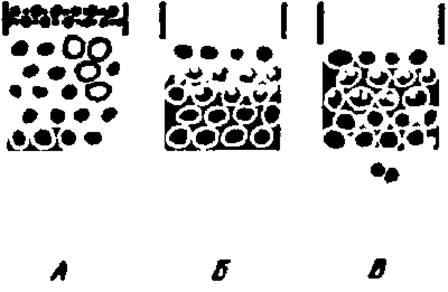
Рис. 11. Механизм разделения веществ по молекулярной массе на колонке с сефадексом:
А — колонка в начале работы: светлые кружки — зерна сефадекса: темные точки — молекулы белков разной молекулярной массы, только что внесенные в верхнюю часть колонки; Б — по мере продвижения проявителя по колонке (сверху вниз) осуществляется перенос молекул белков, однако только меньшие молекулы белков проникают внутрь зерен сефадекса; В — мелкие молекулы белков резко отстают от крупных его молекул, задерживаясь в зернах сефадекса. Первыми из колонки выйдут большие молекулы