БИОХИМИЯ ЧЕЛОВЕКА - Л. В. Капилевич - 2016
ЧАСТЬ 1. СПОРТИВНАЯ БИОХИМИЯ
БИОХИМИЯ МЫШЦ, МЫШЕЧНОГО СОКРАЩЕНИЯ И РАССЛАБЛЕНИЯ
Общая характеристика мышц
У животных и человека имеются два основных типа мышц:
✵ поперечнополосатые (прикрепляются к костям, т. е. к скелету, и поэтому еще называются скелетными, выделяют также сердечную мышцу, имеющую свои особенности);
✵ гладкие (мускулатура стенок полых органов и кожи).
Строение мышечных клеток
Поперечнополосатая мышца состоит из многочисленных удлиненных мышечных клеток. Двигательные нервы входят в различных точках в мышечное волокно и передают ему электрический импульс, вызывающий сокращение. Мышечное волокно обычно рассматривают как многоядерную клетку гигантских размеров, покрытую эластичной оболочкой - сарколеммой. Диаметр функционально зрелого поперечнополосатого мышечного волокна обычно составляет от 10 до 100 мкм, а длина волокна часто соответствует длине мышцы.
В саркоплазме мышечных волокон обнаруживается ряд структур: митохондрии, микросомы, рибосомы, трубочки и цистерны саркоплазматической сети, различные вакуоли, глыбки гликогена и включения липидов, играющие роль запасных энергетических материалов, и т. д.
В каждом мышечном волокне в полужидкой саркоплазме по длине волокна расположено, нередко в форме пучков, множество нитевидных образований - миофибрилл (толщина их обычно менее 1 мкм), обладающих, как и все волокно в целом, поперечной исчерченностью. Поперечная исчерченность волокна, зависящая от оптической неоднородности белковых веществ, локализованных во всех миофибриллах на одном уровне, легко выявляется при исследовании волокон скелетных мышц в поляризационном или фазово-контрастном микроскопе.
Повторяющимся элементом поперечнополосатой миофибриллы является саркомер - участок миофибриллы, границами которого служат узкие Z-линии. Каждая миофибрилла состоит из нескольких сот саркомеров. Средняя длина саркомера 2,5-3,0 мкм. В середине саркомера находится зона протяженностью 1,5-1,6 мкм, темная в фазово-контрастном микроскопе. В поляризованном свете она дает сильное двойное лучепреломление. Эту зону принято называть диском А (анизотропный диск). В центре диска А расположена линия М, которую можно наблюдать только в электронном микроскопе. Среднюю часть диска А занимает зона Н более слабого двойного лучепреломления. Наконец, существуют изотропные диски, или диски I, с очень слабым двойным лучепреломлением. В фазовоконтрастном микроскопе они кажутся более светлыми, чем диски А. Длина дисков I около 1 мкм. Каждый из них разделен на две равные половины Z-мембраной, или Z-линией. Согласно современным представлениям, в дисках А расположены толстые нити, состоящие главным образом из белка миозина, и тонкие нити, состоящие, как правило, из второго компонента актомиозиновой системы- белка актина. Тонкие (актиновые) нити начинаются в пределах каждого саркомера у Z-линии, тянутся через диск I, проникают в диск А и прерываются в области зоны Н.
При исследовании тонких срезов мышц под электронным микроскопом было обнаружено, что белковые нити расположены строго упорядоченно. Толстые нити диаметром 12-16 нм и длиной примерно 1,5 мкм уложены в форме шестиугольника диаметром 40-50 нм и проходят через весь диск А. Между этими толстыми нитями располагаются тонкие нити диаметром 8 нм, простираясь от 2-линии на расстояние около 1 мкм (рис. 3). Изучение мышцы в состоянии сокращения показало, что диски I в ней почти исчезают, а область перекрывания толстых и тонких нитей увеличивается (в скелетной мышце в состоянии сокращения саркомер укорачивается до 1,7-1,8 мкм).
Рис. 3. Схема строения саркомера
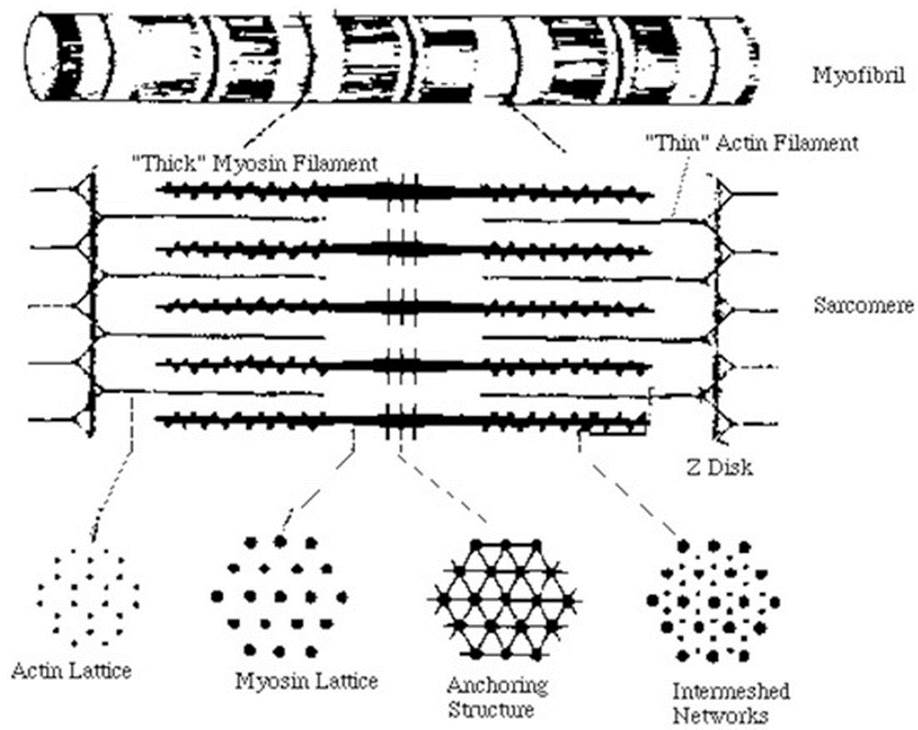
Согласно модели, предложенной Э. Хаксли и Р. Нидергерке, а также X. Хаксли и Дж. Хенсоном, при сокращении миофибрилл одна система нитей проникает в другую, т. е. нити начинают как бы скользить друг по другу, что и является причиной мышечного сокращения.
Механизм мышечного сокращения
Передача возбуждения с двигательного мотонейрона на мышечное волокно происходит с помощью медиатора ацетилхолина (АХ). Взаимодействие АХ с холинорецептором концевой пластинки приводит к активации АХ-чувствительных каналов и появлению потенциала концевой пластинки, который может достигать 60 мВ. При этом область концевой пластинки становится источником раздражающего тока для мембраны мышечного волокна, и на участках клеточной мембраны, прилегающих к концевой пластинке, возникает потенциал действия (ПД), который распространяется в обе стороны со скоростью примерно 3-5 м/с при температуре 36 °С.
Вторым этапом является распространение ПД внутрь мышечного волокна по поперечной системе трубочек, которая служит связующим звеном между поверхностной мембраной и сократительным аппаратом мышечного волокна. Т-система тесно контактирует с терминальными цистернами саркоплазматической сети двух соседних саркомеров. Электрическая стимуляция места контакта приводит к активации ферментов, расположенных в месте контакта, и образованию инозитолтрифосфата. Инозитолтрифосфат активирует кальциевые каналы мембран терминальных цистерн, что приводит к выходу ионов Са2+ из цистерн и повышению внутриклеточной концентрации Са2+ с 107 до 105М. Совокупность процессов, приводящих к повышению внутриклеточной концентрации Са2+, составляет сущность третьего этапа мышечного сокращения. Таким образом, на первых этапах происходит преобразование электрического сигнала ПД в химический — повышение внутриклеточной концентрации Са2+, т. е. электрохимическое преобразование.
При повышении внутриклеточной концентрации ионов Са2+ тропомиозин смещается в желобок между нитями актина, при этом на актиновых нитях открываются участки, с которыми могут взаимодействовать поперечные мостики миозина. Это смещение тропомиозина обусловлено изменением конформации молекулы белка тропонина при связывании Са2+. Следовательно, участие ионов Са2+ в механизме взаимодействия актина и миозина опосредовано через тропонин и тропомиозин.
Следующим этапом электромеханического сопряжения является присоединение головки поперечного мостика к актиновому филаменту, к первому из нескольких последовательно расположенных стабильных центров. При этом миозиновая головка поворачивается вокруг своей оси, поскольку имеет несколько активных центров, которые последовательно взаимодействуют с соответствующими центрами на актиновом филаменте. Вращение головки приводит к увеличению упругой эластической тяги шейки поперечного мостика и увеличению напряжения. В каждый конкретный момент в процессе развития сокращения одна часть головок поперечных мостиков находится в соединении с актиновым филаментом, другая свободна, т. е. существует последовательность их взаимодействия с актиновым филаментом. Это обеспечивает плавность процесса сокращения. На четвертом и пятом этапах происходит хемомеханическое преобразование.
Последовательная реакция соединения и разъединения головок поперечных мостиков с актиновым филаментом приводит к скольжению тонких и толстых нитей относительно друг друга и уменьшению размеров саркомера и общей длины мышцы, что является шестым этапом. Совокупность описанных процессов составляет сущность теории скольжения нитей.
Механизм мышечного расслабления
Описанные механизмы укорочения мышечного волокна позволяют предположить, что для расслабления в первую очередь необходимо понижение концентрации ионов Са2+. Экспериментально было доказано, что саркоплазматическая сеть имеет специальный механизм - кальциевый насос, который активно возвращает кальций в цистерны. Активация кальциевого насоса осуществляется неорганическим фосфатом, который образуется при гидролизе АТФ, а энергообеспечение работы кальциевого насоса происходит также за счет энергии, образующейся при гидролизе АТФ. Таким образом, АТФ является вторым важнейшим фактором, абсолютно необходимым для процесса расслабления.
Кроме того, после мышечных сокращений тонкие протофибриллы стремятся вернуться в свое прежнее положение за счет упругих свойств.
Некоторое время после смерти мышцы остаются мягкими вследствие прекращения тонического влияния мотонейронов. Затем концентрация АТФ снижается ниже критического уровня и возможность разъединения головки миозина с актиновым филаментом исчезает. Возникает явление трупного окоченения с выраженной ригидностью скелетных мышц.
Особенности строения гладких мышц
Гладкие мышцы внутренних органов по характеру иннервации, возбуждения и сокращения существенно отличаются от скелетных. Волны возбуждения и сокращения протекают в гладких мышцах в очень замедленном темпе. Развитие состояния «неутомляемого» тонуса гладких мышц связано, как и в тонических скелетных волокнах, с замедленностью сократительных волн, сливающихся друг с другом даже при редких ритмических раздражениях. Для гладких мышц характерна также способность к автоматизму, т. е. к деятельности, не связанной с поступлением в мышцы нервных импульсов из центральной нервной системы. Установлено, что способностью к ритмическому самопроизвольному возбуждению и сокращению обладают не только нервные клетки, имеющиеся в гладких мышцах, но и сами гладкомышечные клетки.
Своеобразие сократительной функции гладких мышц позвоночных животных определяется не только особенностями их иннервации и гистологического строения, но и спецификой их химического состава: более низким содержанием контрактильных белков (актомиозина), макроэргических соединений, в частности АТФ, низкой АТФ-азной активностью миозина, наличием в них водорастворимой модификации актомиозина - тоноактомиозина и т. д.
Существенное значение для организма имеет способность гладких мышц изменять длину без повышения напряжения (наполнение полых органов, например, мочевого пузыря, желудка и др.).
Энергетика мышечной деятельности
Как уже указывалось, обе фазы мышечной деятельности - сокращение и расслабление - протекают при обязательном использовании энергии, которая выделяется при гидролизе АТФ.
Однако запасы АТФ в мышечных клетках незначительны (в покое концентрация АТФ в мышцах около 5 ммоль/л), и их достаточно для мышечной работы в течение 1-2 с. Поэтому для обеспечения более продолжительной мышечной деятельности в мышцах должно происходить пополнение запасов АТФ. Образование АТФ в мышечных клетках непосредственно во время физической работы называется ресинтезом АТФ и идет с потреблением энергии.
Таким образом, при функционировании мышц в них одновременно протекают два процесса: гидролиз АТФ, дающий необходимую энергию для сокращения и расслабления, и ресинтез АТФ, восполняющий потери этого вещества. Если для обеспечения мышечного сокращения и расслабления используется только химическая энергия АТФ, то для ресинтеза АТФ пригодна химическая энергия самых разнообразных соединений: углеводов, жиров, аминокислот и креатинфосфата.
Строение и биологическая роль АТФ
Аденозингрифосфат (АТФ) является нуклеотидом. Молекула АТФ (аденозинтрифосфорной кислоты) состоит из азотистого основания аденина, пятиуглеродного сахара рибозы и трех остатков фосфорной кислоты, соединенных между собой макроэргической связью. При ее гидролизе высвобождается большое количество энергии. АТФ является основным макроэргом клетки, аккумулятором энергии в виде энергии высокоэнсргетических химических связей.
В физиологических условиях, т. е. при тех условиях, которые имеются в живой клетке, расщепление моля АТФ (506 г) сопровождается выделением 12 ккал, или 50 кДж энергии.
Пути образования АТФ
Аэробное окисление (тканевое дыхание)
Синонимы: окислительное фосфорилирование, дыхательное фосфорилирование, аэробное фосфорилирование.
Протекает этот путь в митохондриях.
Цикл трикарбоновых кислот впервые был открыт английским биохимиком Г. Кребсом (рис. 4).
Рис. 4. Цикл трикарбоновых кислот (цикл Кребса)
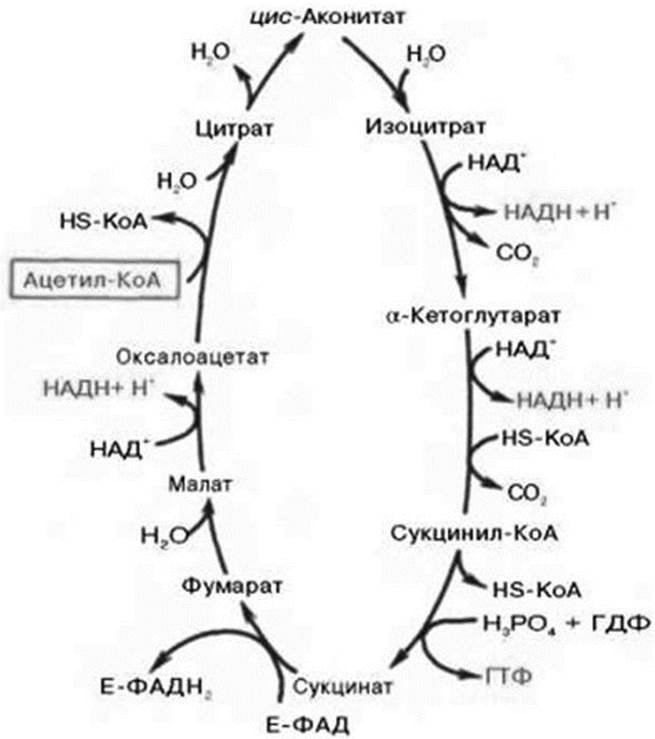
Первая реакция катализируется ферментом цитрат-синтазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота. По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментом цитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и НS-КоА.
В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации- дегидратации фермент аконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата.
Третья реакция, по-видимому, лимитирует скорость цикла Кребса. Изолимонная кислота дегидрируется в присутствии НАД-зависимой изоцитратдегидрогеназы. В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. НАД-зависимая изо- цитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Мg2+ или Мn2+.
Во время четвертой реакции происходит окислительное декарбоксилирование α-кетоглугаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. По механизму эта реакция схожа с реакцией окислительного декарбоксилирования пирувата до ацетил-КоА; α-кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в реакции принимают участие 5 коферментов: ТПФ, амидлипоевой кислоты, НS-КоА, ФАД и НАД+.
Пятая реакция катализируется ферментом сукцинил-КоА- синтетазой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА.
В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД. В свою очередь, сукцинатдегидрогеназа прочно связана с внутренней митохондриальной мембраной.
Седьмая реакция осуществляется под влиянием фермента фума- ратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат).
Наконец, в ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацстат.
За один оборот цикла при окислении одной молекулы ацетил-КоА в цикле Кребса и системе окислительного фосфорилирования может образоваться 12 молекул АТФ.
Анаэробное окисление
Синонимы: субстратное фосфорилирование, анаэробный синтез АТФ. Идет в цитоплазме, отщепленный водород присоединяется к какому-то другому веществу. В зависимости от субстрата выделяют два пути анаэробного ресинтеза АТФ: креатинфосфатный (креатинкиназный, алактатный) и гликолитический (гликолиз, лактатный). В первом случае субстратом выступает креатинфосфат, во втором - глюкоза.
Эти пути протекают без участия кислорода.
Количественные критерии путей ресинтеза АТФ
Для количественной характеристики различных путей ресинтеза АТФ обычно используются следующие критерии:
а) максимальная мощность, или максимальная скорость, - это наибольшее количество АТФ, которое может образоваться в единицу времени за счет данного пути ресинтеза;
б) время развертывания - это минимальное время, необходимое для выхода ресинтеза АТФ на свою наибольшую скорость;
в) время сохранения или поддержания максимальной мощности - это наибольшее время функционирования данного пути ресинтеза АТФ с максимальной мощностью;
г) метаболическая емкость - это общее количество АТФ, которое может образоваться во время мышечной работы за счет данного пути ресинтеза АТФ.
Аэробный путь ресинтеза АТФ
Максимальная мощность составляет 350-450 кал/мин•кг.
Время развертывания - 3-4 мин (у хорошо тренированных спортсменов может быть около 1 мин).
Время работы с максимальной мощностью составляет десятки минут.
Преимущества: экономичность, универсальность в использовании субстратов и большая продолжительность его работы.
Недостатки: обязательное потребление кислорода, наличие неповрежденной мембраны, большое время развертывания и небольшая максимальная мощность.
Поэтому мышечная деятельность, свойственная большинству видов спорта, не может быть полностью обеспечена этим путем ресинтеза АТФ, и мышцы вынуждены дополнительно включать анаэробные способы образования АТФ, имеющие более короткое время развертывания и большую максимальную мощность.
В спортивной практике для оценки аэробного фосфорилирования часто используются следующие показатели:
МПК (максимальное потребление кислорода) - это максимально возможная скорость потребления кислорода организмом при выполнении физической работы.
ПАО (порог аэробного обмена) - это наибольшая относительная мощность работы, измеряемая по потреблению кислорода в процентах по отношению к МПК.
ПАНО (порог анаэробного обмена) - это минимальная относительная мощность работы, измеренная по потреблению кислорода в процентах по отношению к МПК.
Кислородный приход - это количество кислорода, использованное во время выполнения данной нагрузки для обеспечения аэробного ресинтеза АТФ.
Креатинфосфатный путь ресинтеза АТФ
Источник энергии - креатинфосфат. Он либо превращается в креатинин и выводится из организма, либо связывается с АДФ с образованием креатина и АТФ.
Синтез креатинфосфата в мышечных клетках происходи во время отдыха путем взаимодействия креатина с избытком АТФ.
Образование креатина происходит в печени с использованием трех аминокислот: глицина, метионина и аргинина.
Максимальная мощность составляет 900-1000 кал/мин•кг.
Время развертывания всего 1-2 с.
Время работы с максимальной скоростью всего лишь 8-10 с, что связано с небольшими исходными запасами креатинфосфата в мышцах.
Преимущества: очень малое время развертывания и высокая мощность.
Недостаток: короткое время его функционирования.
Биохимическая оценка состояния креатинфосфатного пути ресинтеза АТФ обычно проводится по двум показателям: креатининовому коэффициенту и алактатному кислородному долгу.
Креатининовый коэффициент - это выделение креатинина с мочой за сутки в расчете на 1 кг массы тела.
Алактатный кислородный долг - это повышенное (сверх уровня покоя) потребление кислорода в ближайшие 4-5 мин после выполнения кратковременного упражнения максимальной мощности.
Гликолитический путь ресинтеза АТФ
Источник энергии - мышечный гликоген и глюкоза из кровяного русла.
Максимальная мощность - 750-850 кал/мин•кг.
Время развертывания - 20-30 с.
Время работы с максимальной мощностью - 2-3 мин.
Преимущества: не требует участия митохондрий и кислорода.
Недостатки: процесс малоэкономичен, образование и накопление лактата.
Показателем работы данного пути служит определение после физической нагрузки концентрации лактата в крови и моче, pH крови, определение щелочного резерва крови и лактатного кислородного долга.
Щелочной резерв крови - это щелочные компоненты всех буферных систем крови. При поступлении во время мышечной работы в кровь молочной кислоты она вначале нейтрализуется путем взаимодействия с буферными системами крови (с их щелочными компонентами), и поэтому происходит снижение щелочного резерва крови.
Лактатный кислородный долг - это повышенное потребление кислорода в ближайшие 1-1,5 часа после окончания мышечной работы. Этот избыток кислорода необходим для устранения молочной кислоты.
Аденилаткиназная (миокиназная) реакция
Существует два мнения по поводу времени протекания данной реакции. Одно мнение сводится к тому, что эта реакция протекает в мышцах при утомлении. Второе мнение: данная реакция всегда идет параллельно с остальными путями ресинтеза АТФ. Реакция ускоряется ферментом аденилаткиназой (миокиназой). В ходе этой реакции одна молекула АДФ передаст свою фосфатную группу на другую АДФ, в результате образуется АТФ и АМФ.
Соотношение между различными путями ресинтеза АТФ при мышечной работе
При любой мышечной работе функционируют все три пути ресинтеза АТФ, но включаются они последовательно. В первые секунды работы ресинтез АТФ идет за счет креатинфосфатной реакции, затем подключается гликолиз и, наконец, по мере продолжения работы на смену гликолизу приходит тканевое дыхание.
Конкретный вклад каждого из механизмов образования АТФ в энергообеспечение мышечных движений зависит от интенсивности и продолжительности физических нагрузок.
Вопросы для самоконтроля
1. Какие основные типы мышц выделяют в организме человека?
2. Какие органоиды содержит мышечная клетка?
3. Какие соединения входят в состав миоцита?
4. Что называется миофибриллой?
5. Как выглядит под микроскопом саркомер?
6. Что служит сигналом для запуска мышечного сокращения?
7. Зачем необходима энергия АТФ при осуществлении мышечного сокращения?
8. Нужна ли энергия для расслабления мышечных волокон?
9. В строении каких органов участвуют гладкие мышцы?
10. Каким соединением по химической природе является АТФ?
11. Какие соединения называются макроэргами?
12. Сколько энергии выделяется при расщеплении одного моля АТФ при физиологических условиях?
13. Что является главными потребителями АТФ в организме человека?
14. Какие пути образования АТФ в организме человека выделяют?
15. Дайте определение термину «тканевое дыхание».
16. В какой части клетки происходят аэробный и анаэробный синтез АТФ?
17. Какое соединение является конечным продуктом анаэробного синтеза АТФ?
18. За счет каких механизмов происходит пополнение запасов АТФ?
19. Перечислите преимущества и недостатки аэробного пути ресинтеза АТФ.
20. Сколько минут составляет время работы с максимальной мощностью аэробного пути ресинтеза АТФ?
21. Перечислите преимущества и недостатки лактатного пути ресинтеза АТФ.
22. Какова максимальная мощность гликолитического пути ресинтеза АТФ?
23. Перечислите преимущества и недостатки алактатного пути ресинтеза АТФ.
24. Каково время развертывания креатинфосфатного пути ресинтеза АТФ?