Гликопротеины - Хьюз Р. 1985
Строение
Мембранные гликопротеины. Общие представления
Гликофорин
Выше мы обсуждали строение гликопротеинов, выделяемых из жидкостей организма, например из крови, или же из клеточных секретов. Но гликопротеины являются также важными составными частями всех клеточных мембран, изученных до настоящего времени [18]. Плазматические мембраны особенно богаты гликопротеинами, и основное внимание исследователей сейчас обращено на выяснение строения именно этих белков, их организации в самой мембране, а также на функции мембранных гликопротеинов, в частности их углеводных компонентов. Особенно удобными объектами исследования оказались эритроциты человека, поскольку они имеют лишь одну мембрану. При их изучении было получено очень много данных, которые можно, по-видимому, распространить и на мембранные системы более сложно устроенных клеток.
Мембраны эритроцитов человека содержат относительно небольшое число главных белков. Из них три особенно богаты углеводами, и их можно выделить избирательным экстрагированием, например смесью хлороформ — метанол, фенолом или дииодсалицилатом лития с последующим разделением по молекулярной массе [19]. Эти гликопротеины обозначают как гликофорины А, В и С. Гликофорин А — главный гликопротеиновый компонент мембраны эритроцитов. Его полная структура показана на рис. 2.19.
Гликофорин А с молекулярной массой 29000 состоит из одной полипептидной цепи, построенной из 131 аминокислотного остатка. При изучении его первичной структуры были найдены две замены в положениях 1 и 5 цепи, которые, как будет показано ниже, имеют важное биологическое значение. Ландштейнером была описана еще одна главная система групп крови, обозначенная как MN. Для идентификации соответствующих антигенов была использована антисыворотка, полученная после иммунизации кроликов эритроцитами одного индивидуума. Антитела этой антисыворотки агглютинировали эритроциты лишь у некоторой части других индивидуумов. Если для иммунизации использовали эритроциты, которые не агглютинировались первоначальной антисывороткой, то получаемые антисыворотки агглютинировали эритроциты лишь тех лиц, которые также не реагировали с первоначальной антисывороткой. Обнаруженные с помощью обоих типов антисывороток антигены поверхности эритроцитов оказались продуктами двух аллелей: М и N. Сейчас уже хорошо известно, что различия в антигенности по MN-группе обусловлены по крайней мере частично структурой участка пептидной цепи гликофорина А между остатками аминокислот 1 и 5. Так у индивидуумов, имеющих антиген М, эта последовательность следующая:
![]()
У индивидуумов с антигеном N обнаружены две аминокислотные замены:
![]()
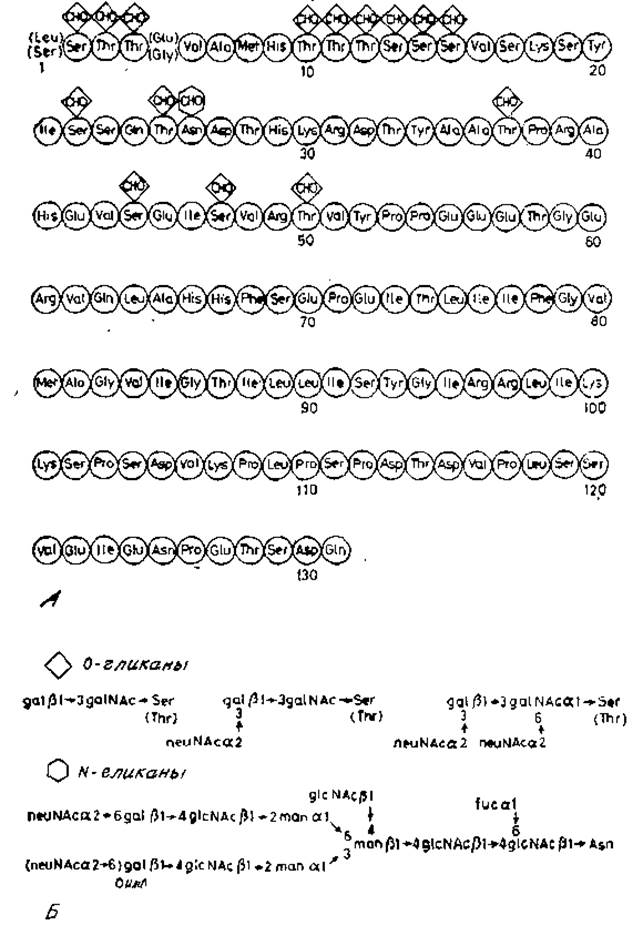
Рис. 2.19. A — первичная структура гдикофорина А; показаны гликозилированные аминокислотные остатки, Б — общая схема строения углеводных цепей.
Для проявления антигенных свойств имеют существенное значение О-гликаны, которые присоединены к аминокислотным остаткам, отмеченным звездочкой. Возможно, эти углеводы способствуют поддержанию той необходимой конформации пептидной цепи, которая узнается специфическими антисыворотками. Другой важной областью цепи гликофорина А является участок между остатками 73 и 95, где расположены аминокислоты с нейтральными или неполярными боковыми цепями. Этот домен вдается в липофильный бислой мембраны, причем одна часть полипептидной цепи располагается по одну сторону мембраны, а другая — по другую ее сторону. Аминоконцевая часть цепи, локализованная снаружи, очень богата углеводными цепями двух основных типов. Здесь расположены 15 О-гликанов, которые представляют собой ди-, три- или тетрасахариды, связанные через остаток N-ацетилгалактозамина с серином или треонином. Эта структура сходна с структурой уже обсуждавшихся О-гликанов, поскольку также содержит последовательность галактозид ß1→3N-ацетилгалактозамин. К одному или обоим этим остаткам может присоединяться по остатку сиаловой кислоты. Подобные олигосахариды встречаются не только в гликофорине, но и в других растворимых гликопротеинах, например в фетуине — основном гликопротеине сыворотки плода. Более сложные углеводные цепи присоединены к единственному остатку аспарагина пептидной цепи гликофорина. Они имеют ряд общих черт с N-гликанами растворимых гликопротеинов. Так, остаток ß-маннозы коровой области присоединен к хитобиозе [20]. К остатку ß-маннозы присоединены два остатка а-маннозы, к которым в свою очередь прикрепляются N-ацстиллактозаминовые последовательности. Концевыми остатками последних являются сиаловая кислота и фукоза. К центральному остатку ß-маннозы (ß1→4)-связью присоединен также остаток N-ацетилглюкозамина, как и в гибридных цепях гликопептидов овальбумина (рис. 2.7).
Первичная структура минорных гликофоринов В и С, no-видимому, сходна с таковой гликофорина А, хотя их цепи короче. Сложные олигосахаридные цепи у них отсутствуют, что указывает на делецию участка пептидной цепи с Asn-26 (рис. 2.19). Еще неясно, происходит ли эта делеция после того, как синтез цепи завершен, или же имеются отдельные гены, кодирующие полипептидные цепи каждого из трех гликофоринов.