Гликопротеины - Хьюз Р. 1985
Биосинтез
Сборка О-гликана
Сборка О-гликанов лучше всего изучена в случае коротких углеводных цепей коллагенов и гликопротеинов, секретируемых подчелюстными железами. Для гликозилирования субъединиц коллагена требуются три фермента (рис. 3.12): лизин-гидроксилаза, галактозилтрансфераза, узнающая довольно протяженный участок пептидной последовательности вокруг гликозилируемого остатка гидроксилизина, и глюкозилтрансфераза (рис. 3.12; [40]).
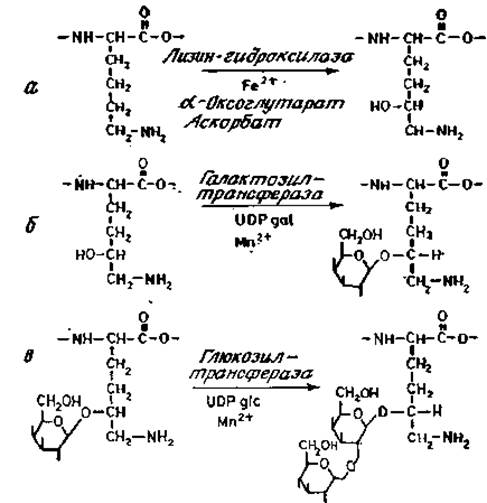
Рис. 3.12. Этапы гликозилирования коллагена.
Сборка О-гликанов гликопротеинов подчелюстных желез также включает в себя прямой перенос сахаров от нуклеотидных промежуточных продуктов, катализируемый мультиферментной системой. Первая гликозилтрансфераза (рис. 3.13, фермент 1), используя UDP-N-ацетилгалактозамин, устанавливает связь с остатками серина или треонина. Для действия этого фермента требуется наличие протяженного участка пептидной цепи вокруг гликозилируемых остатков аминокислот, в связи с чем большая часть полипептидов не может служить субстратом этого фермента. Интересное исключение составляет главный основный белок миелина нервного волокна. Этот белок в норме не гликозилирован, и биологическое значение его акцепторной активности неизвестно. Синтетические пептиды, являющиеся аналогами последовательности в окружении треонина-98 миелинового белка — единственной гликозилированной аминокислоты основного белка — были использованы для определения специфичности galNAc-трансферазы секрета подчелюстных желез (табл. 3.2).
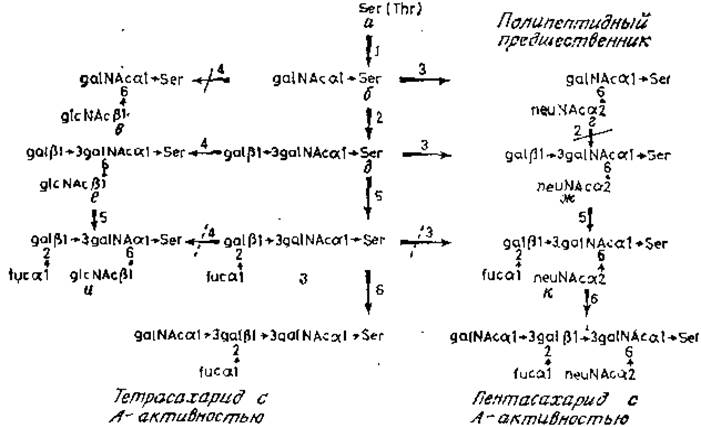
Рис. 3.13. Сборка гликопротеинов подчелюстной железы. Запрещенные реакции перечеркнуты сплошной линией, а частично блокированные — штриховой.
Таблица 3.3. Условия, необходимые для гликозилирования остатка треонина [41]
|
Пептид (или белок) |
Относительная акцепторная активность |
|||||||
|
Основной белок миелина |
1,0 |
|||||||
|
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
|
|
Val |
Thr |
Pro |
Arg |
Thr |
Pro |
Pro |
Pro |
2,5 |
|
Thr |
Pro |
Arg |
Thr |
Pro |
Pro |
Pro |
u |
|
|
Pro |
Arg |
Thr |
Pro |
Pro |
Pro |
1.2 |
||
|
Arg |
Thr |
Pro |
Pro |
Pro |
1,1 |
|||
|
Thr |
Pro |
Pro |
Pro |
0,1 |
||||
|
Thr |
Pro |
Pro |
0 |
|||||
|
Thr |
Pro |
0 |
||||||
Самым важным является то, что остаток треонина для гликозилирования должен быть внутренним остатком в цепи, поэтому наличие в пептиде большого количества остатков пролина облегчает этот процесс. Гликозилирование чрезвычайно специфично для треонина-98. Треонин-95 не является акцептором. Таким образом, свойства этой системы напоминают строгие требования N-ацетилглюкозаминилтрансферазы, участвующей в гликозилировании остатков аспарагина. По-видимому, высокое содержание пролина в полипептидах гликопротеинов подчелюстных желез обусловливает наличие большого числа остатков пролина вокруг каждой из многих гликозилированных оксикислот в этих молекулах. Продукт этой реакции (рис. 3.13,6) служит субстратом для конкурирующих ферментов 2 и 3: сиалилтрансферазы, присоединяющей остаток сиаловой кислоты cCMPneuNAc к N-ацетилгалактозамину (рис. 3.13,г) и галактозилтрансферазы (рис. 3.13,6). В тканях с высокой активностью сиалилтрансфераз, например в железах овцы, накапливается дисахарид типа neuNAca2→GgalNAc, поскольку он не является субстратом для галактозилтрансферазы. Продукт (рис. 3.13,6) служит субстратом для трех гликозилтрансфераз. Сиалилтрансфераза (фермент 3) образует трисахарид (ж), фукозилтрансфераза — вещество з, а N-ацетилглюкозаминилтрансфераза образует продукт е. Фукозилтрансфераза может взаимодействовать также с сиалированным трисахаридом (ж), причем обе фукозилированные структуры (з и к) являются субстратами N-ацетилгалактозаминилтрансферазы.
Согласно приведенным выше данным, эти фукозосодержащие структуры являются детерминантами группоспецифичности Н, а N-ацетилгалактозаминилтрансфераза — продукт гена А, придающий О-гликану активность группы крови А. Третья трансфераза, активная по отношению к структуре 6 (рис. 3.13), по-видимому, должна быть высокоспецифичной. Хотя N-ацетилглюкозамин переносится с UDPglcNAc на остаток N-ацетилгалактозамина, связанного с полипептидом (рис. 3.13, е), для действия трансферазы существенное значение имеет остаток галактозы [42]. Даже замещение галактозы на фукозу (рис. 3.13, з) сильно подавляет последующий перенос N-ацетилглюкозамина, дающий продукт и. Преимущественный путь синтеза структуры и осуществляется благодаря действию специфических фукозилтрансфераз на субстрат е. Взаимоконкурентная природа реакций фукозилирования и сиалирования, отмеченная ранее, здесь проявляется по-другому. Перенос фукозы на остаток галактозы в структуре з в значительной степени подавляет последующий перенос сиаловой кислоты на соседний моносахарид для образования структуры к [43]. Таким образом, предпочтительный путь для синтеза этого тетра- сахарида следующий: а→б→д→ж→к.
Эти важные экспериментальные данные убедительно показали, почему в тканях типа подчелюстных желез овцы с относительно специфической галактозилтрансферазной активностью и высокой сиалилтрансферазной активностью обнаруживается только дисахарид neuNAca2→6galNAc. Кроме того, они объяснили образование длинных гликанов, оканчивающихся детерминантами групповой специфичности крови в гликопротеинах, секретируемых слюнными железами свиньи. Определенное соотношение активности сиалил- и галактозилтрансфераз наводит на мысль о наличии особого механизма контроля, обеспечивающего регуляцию количества длинных О-гликанов, Возможно, что появление N-ацетилглюкозамина, присоединенного (ß1→6)-связью, включает механизм, обеспечивающий точную длину образующегося гликана (так называемый коровый участок продуктов с активностью антигенов группы крови, которые секретируются определенными клетками человека; рис. 2.16). Этот механизм включает в себя и присоединение других моносахаридов к концевой галактозе продукта, синтезированного с участием glcNAc-трансферазы.
Синтез О-гликанов, присутствующих в гликофорине, фетуине (основном гликопротеине, синтезируемом печенью эмбриона) и во многих других гликопротеинах (рис. 2.19), может образовываться тем же путем, что и описанный выше. Специфическая сиалилтрансфераза, образующая последовательность neuNAca2→3Gal, была выделена в очищенном виде из печени свиньи и из других тканей [44, 43], что объясняет существование трисахарида neuNAca2→3galßl→3glcNAc (рис. 2.19). Однако до сих пор остается неясным, как контролируется активность фермента, образующего (а2→6)-связь в дисахариде neuNAca2→6galNAc с последующим синтезом тетрасахарида, содержащего два остатка сиаловых кислот (рис. 2.19). Активности, аналогичной ферменту 3 (рис. 3.13), пока не обнаружено в печени — источнике фетуина, и очевидно, этой сиалилтрансферазе в качестве акцептора требуется другой олигосахарид [44]. Трисахарид с одним остатком сиаловой кислоты в О-гликане (рис. 2.19), возможно, является важным промежуточным продуктом при сборке тетрасахарида О-гликана.