Гликопротеины - Хьюз Р. 1985
Биосинтез
Контроль за биосинтезом гликана
Метаболический контроль
Покоящаяся клетка, такая, как покоящийся лимфоцит или фибробласт в среде, не содержащей сыворотки, сохраняет средний уровень биосинтеза белка и гликозилирования. Оба эти процесса стимулируются, например, добавлением митогена или сыворотки. Каким же образом такая клетка, как лимфоцит, может после стимуляции резко усилить гликозилирование до того высокого уровня, который наблюдается при биосинтезе иммуноглобулинов? Не напоминает ли это мобилизацию гормончувствительными клетками (например, клетками щитовидной железы) своего метаболизма для образования специфического конечного гликопротеина (например, тиреоглобулина)? Существуют несколько возможных путей. Не исключено, что концентрации гликозилирующих ферментов и активных сахарных промежуточных, метаболитов в условиях покоя в клетках являются насыщающими. Тогда гликозилирование нарастающего числа вновь синтезируемых полипептидов должно быть согласовано. Однако имеющиеся данные наводят на мысль, что реакции гликозилирования регулируются внутриклеточной концентрацией долихола и долихолфосфата. Синтез долихолфосфата является частью общего пути биосинтеза холестерола и убихинона (рис. 3.15), а фермент гидрокси-3-метилглутарил-СоА-редуктаза, катализирующая образование мевалоновой кислоты (рис. 3.15, стадия 2), служит важным регуляторным пунктом при биосинтезе обоих соединений. Ингибитор этого фермента 25-гидроксихолестерол уменьшает синтез холестерола и долихолфосфата и снижает уровень гликозилирования белков, по крайней мере у некоторых клеток [50]. Подобное же ингибирование вызывает компактин — эффективный ингибитор гидрокси-3-метилглутарил-СоА — редуктазы из Penicillum citrinum [51]. Интересно, что добавление компактина к развивающимся эмбрионам морских ежей блокирует специфическую гаструляцию, а добавление экзогенного долихола возвращает это развитие к норме, возможно, путем непосредственного влияния на гликозилирование. В печени избыток холестерола угнетает синтез гидрокси-3-метилглутарил-СоА — редуктазы, но этот фермент не может быть первым этапом регуляции синтеза холестерола в печени, поскольку превращение фарнезилпирофосфата в холестерол при этом тоже подавляется (рис. 3.15, стадия 4). По этой причине происходит увеличенный переход фарнезилпирофосфата в долихолфосфат (стадия 5) и убихинон (стадия 8) и стимулируется гликозилирование белка [52]. В печени при нормальных условиях переход предшественников в долихолфосфаты составляет всего лишь 1/100 их превращения в холестерол. Поэтому, даже когда гидрокси-3-метилглутарил-СоА — редуктаза частично ингибирована, все-таки образуется достаточное количество фарнезилфосфата, чтобы обеспечить превращение в долихолфосфат.
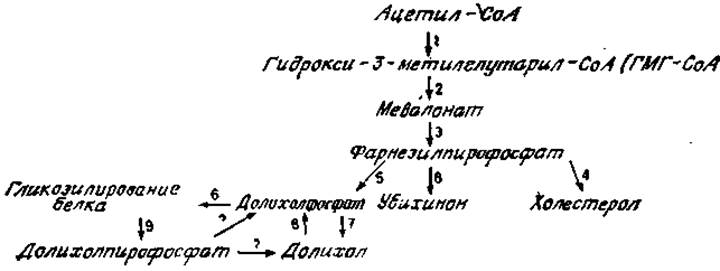
Рис. 3.15. Биосинтез холестерола и долихола. СоА — кофермент А.
Все эти результаты в совокупности свидетельствуют о наличии важного метаболического контроля гликозилирования белков на уровне образования долихолфосфата. Поскольку количество долихолфосфата лимитирует скорость гликозилирования, возможно, существует дополнительный контроль превращения долихолпирофосфата (рис. 3,15, стадия 9) в долихолфосфат специфическими фосфатазами и СТР-зависимой киназой, действующими независимо на отдельные пулы свободных долихолов или эфиров долихола.