ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
15. ПРИНЦИПЫ РЕГУЛЯЦИИ МЕТАБОЛИЗМА
15.2. Теория контроля метаболизма
Детальное изучение механизмов регуляции реакций метаболизма стало возможным лишь после установления основных химических реакций метаболизма и изучения ответственных за эти реакции ферментов. Приблизительно в 1900 г. Эдуард Бухнер доказал, что глюкоза может превращаться в этиловый спирт и СO2 под действием дрожжевого экстракта. Этот момент был переломным, и и после этого открытия биохимики стали заниматься главным образом изучением стадий метаболических путей и выделением ферментов, осуществляющих каждую стадию. К середине XX в. все 10 ферментов гликолитического пути были выделены и охарактеризованы. В последующие 50 лет многочисленные исследования были посвящены изучению регуляции этих ферментов при помощи внутриклеточных и внешних сигналов через различные аллостерические и ковалентные взаимодействия, описанные в настоящей главе. Здравый смысл подсказывал, что в линейных метаболических путях, каким является гликолиз, одна из каталитических стадий должна быть медленнее других, т. е. эта стадия должна определять скорость общего потока метаболитов через весь путь (лимитирующая стадия). В гликолизе таким ферментом считалась PFK-1, поскольку было известно, что ее действие строго регулируется фруктозо-2,6-бисфосфатом и другими аллостерическими регуляторами.
Эдуард Бухнер, 1860-1917

С развитием методов генной инженерии стало возможным проверить эту гипотезу «одной лимитирующей стадии» путем повышения концентрации фермента, катализирующего лимитирующую стадию, и определения того, изменяется ли пропорциональным образом поток метаболитов в данном метаболическом пути.
Оказалось, что это не так: простое решение (наличие одной лимитирующей стадии) было неверным. На сегодняшний день уже ясно, что в большинстве метаболических путей контроль потока метаболитов осуществляется на нескольких ферментативных стадиях, а степень влияния каждого фермента зависит от различных обстоятельств — наличия исходных веществ (например, глюкозы), уровня кислорода, потребностей в других продуктах, которые образуются из интермедиатов данного метаболического пути (скажем, глюкозо-6-фосфата для пентозофосфатного пути в клетках, синтезирующих большое количество нуклеотидов), влияния метаболитов с регуляторными функциями, гормонального статуса организма (уровня инсулина и глюкагона), а также ряда других факторов.
Зачем вообще нужно знать, что ограничивает (лимитирует) поток метаболитов в том или ином метаболическом пути? Это необходимо, чтобы понять действие гормонов и лекарств, а также патологические процессы, возникающие при нарушении метаболической регуляции. При разработке лекарственного препарата, стимулирующего или ингибирующего метаболический путь, вполне понятно, что их мишенью должен быть тот фермент, который оказывает наиболее сильное влияние на интенсивность всего пути. Для создания генно-инженерного штамма микроорганизма, способного производить большие количества ценного коммерческого продукта (см. т. 1, с. 444), требуются знания о факторах, ограничивающих поток других метаболитов в сторону образования данного продукта.
Вклад каждого фермента в поток метаболитов можно измерить экспериментально
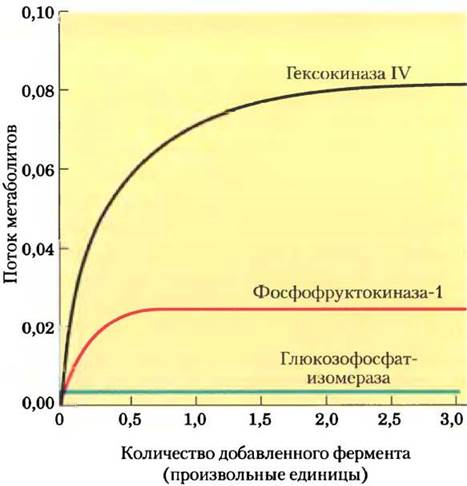
Известно несколько методов экспериментального определения, как изменение ферментативной активности влияет на потоки метаболитов в метаболическом пути. Рассмотрим результаты эксперимента, представленные на рис. 15-7. Образец печени крысы гомогенизировали, так что все ферменты перешли в раствор, а затем измеряли скорость гликолитического превращения глюкозы в фруктозо-6-фосфат под действием полученного экстракта. Для простоты в данном эксперименте рассматривается лишь первая стадия процесса гликолиза. При добавлении дополнительного количества очищенной гексокиназы IV скорость процесса возрастала. Добавление очищенной РРК-1 увеличивало скорость гликолиза, однако не так сильно, как добавление гексокиназы. Внесение в систему очищенной глюкозофосфатизомеразы не оказывало никакого эффекта. Данные результаты говорят о том, что и гексокиназа, и РРК-1 вносят определенный вклад в потоки веществ в этом метаболическом пути, причем гексокиназа оказывает более сильное влияние, а глюкозофосфатизомераза не оказывает никакого действия.
Рис. 15-7. Зависимость интенсивности гликолиза в гомогенате печени крысы от количества добавленных ферментов. К экстракту печени крысы, в котором происходил гликолиз in vitro, добавляли чистые ферменты (ось х). По оси у указан поток метаболитов в данном метаболическом пути.
Аналогичные эксперименты можно провести на целых клетках или организмах, если использовать специфические ингибиторы или активаторы, изменяющие активность одного фермента, и анализировать их влияние на скорость всего метаболического пути. Кроме того, количество фермента можно изменять генетическими методами. Можно создать клетку, несущую дополнительные копии исследуемого белка, или, напротив, обладающую белком с пониженной ферментативной активностью. Повышение концентрации фермента таким генно-инженерным способом иногда оказывает значительное влияние на скорость процесса, а иногда не оказывает никакого действия.
В теории контроля метаболизма имеются три основных параметра, описывающих отклик метаболического пути на изменения условий метаболизма. Обратимся к количественному описанию этих параметров и покажем, как они влияют на процессы в живой клетке. Более строгие количественные выкладки представлены в доп. 15-1.
Дополнение 15-1. Приктическая биохимия. Теория контроля метаболизма: количественные аспекты
Эксперимент позволяет провести количественное определение тех факторов, которые влияют на потоки интермедиатов в метаболическом пути, и выразить их в такой форме, которая удобна для предсказания изменений потока при изменении тех или иных факторов. Рассмотрим простую последовательность реакций, изображенную на рис. 1, в которой субстрат А (скажем, глюкоза) в несколько стадий превращается в продукт В (возможно, пируват, образующийся в результате гликолиза). Один из ферментов данного пути — дегидрогеназа, действующая на субстрат Б (назовем ее бдг). Поскольку активность дегидрогеназы определить легко (см. рис. 13-24), мы можем использовать поток на этой стадии Jбдг в качестве меры потока через весь путь. Изменяя уровень активности одного из предшествующих ферментов данного пути (например, фермента аазы, действующей на субстрат А), будем следить за изменениями потока Jбдг.
Рис. 1. Поток в гипотетической полиферментной системе.
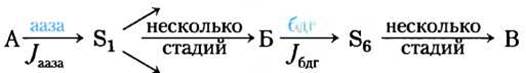
В интактной клетке зависимость потока от А до В от концентрации каждого фермента, действующего на данном пути, должна иметь гиперболический вид, причем при бесконечно малой концентрации фермента поток должен стремиться к 0, а при очень высокой активности фермента достигать максимума. На графике зависимости Jбдг от концентрации первого фермента (Eааза) изменение потока при небольшом изменении концентрации фермента (δJбдг/δЕааза) — прямая с тангенсом угла наклона, равным концентрации Eааза, а при насыщающей концентрации фермента этот параметр стремится к 0. При низкой концентрации фермента угол наклона растет, т. е. поток увеличивается при увеличении концентрации (активности) фермента. При высокой концентрации фермента угол наклона заметно уменьшается, а система становится менее чувствительной к увеличению концентрации фермента, поскольку он и так присутствует в избытке по отношению к другим ферментам данного пути
Для количественного определения зависимости потока от концентрации фермента можно рассматривать отношение δJбдг/δЕааза. Однако этот параметр используется редко, так как потоки и ферментативную активность обычно выражают в разных системах размерности. Используя относительные изменения потока и ферментативной активности (Jбдг/Jбдг и δЕааза/Еааза), получим выражение для безразмерного коэффициента управления С, в данном случае СJбдааза:
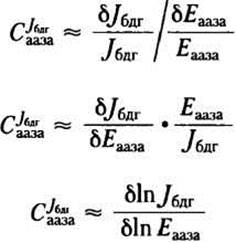 (1)
(1)
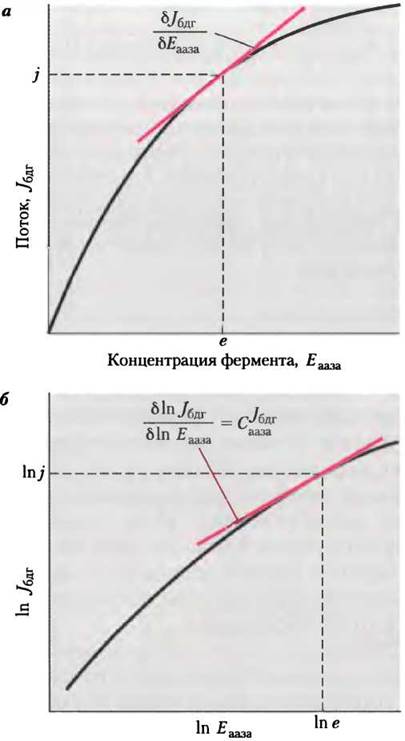
Используя последнюю формулу, можно определить коэффициент управления с помощью графика: СJбдгааза равен тангенсу угла наклона зависимости In Jбдг от In Еааза, построенной по экспериментальным данным (см. рис. 2, о и 2, б). Заметьте, что СJбдгааза не константа; этот параметр зависит от исходного значения Еааза, после которого концентрация фермента начинает изменяться. Обратимся к рис. 2, б: при минимальной концентрации фермента СJбдааза ≈ 1,0, а при высокой концентрации СJбдг ≈ 0,2. Если СJбдг—> 1, то концентрация данного фермента полностью определяет поток через метаболический путь; при СJбдг —> 0 концентрация фермента не влияет на поток. Изменения активности фермента оказывают серьезное влияние на поток только в том случае, когда С >0,5.
Рис. 2. Определение коэффициента управления С. а — типичные изменения потока (Jбдг), измеренные на стадии, катализируемой ферментом бдг, как функция концентрации фермента аазы (Еааза), катализирующего более раннюю стадию превращения субстрата А. Коэффициент управления С в точке с координатами (е, j) равен произведению тангенса угла наклона кривой δJбдг/δЕааза и множителя е/j, б — те же данные в виде логарифмической зависимости; коэффициент управления С можно определить как тангенс угла наклона кривой.
Коэффициент эластичности ε позволяет оценить изменение каталитической активности фермента при изменении концентрации метаболита — субстрата, продукта или эффектора. Этот параметр определяют из зависимости скорости реакции, катализируемой данным ферментом, от концентрации метаболита (при таких концентрациях метаболита, которые характерны для внутриклеточных условий). Аналогично тому, как это было сделано для коэффициента управления, можно показать, что е соответствует тангенсу угла наклона зависимости логарифма скорости реакции V от логарифма концентрации субстрата, продукта или эффектора:
![]()
Для фермента, демонстрирующего типичную кинетику Михаэлиса-Ментен, значение ε варьирует в пределах от 1,0 при концентрации субстрата <КМ до 0,0 вблизи Vmax. Аллостерические ферменты имеют коэффициенты эластичности >1, но не более чем коэффициент Хилла (см. т. 1, с. 239).
Наконец, влияние внешних факторов контроля (т. е. других веществ, не являющихся метаболитами) описывают с помощью параметра отклика R. Изменение потока через путь определяют при разных концентрациях контролирующего фактора Р, в таком случае R описывается уравнением, аналогичным уравнению 1:
![]()
В координатах InJ от InР тангенс угла наклона прямой дает отклик R.
Три коэффициента С, ε и R связаны между собой простым соотношением:
![]()
Таким образом, отклик каждого фермента метаболического пути на изменение внешнего фактора контроля — простая функция двух параметров: коэффициента управления С, отражающего влияние фермента на поток при заданных условиях, и коэффициента эластичности е, характеристического для фермента, так как он отражает чувствительность фермента к изменениям концентрации субстрата или эффектора.
Коэффициент управления С определяет влияние ферментативной активности на поток метаболитов через метаболический путь
Данные, представленные на рис. 15-7, можно использовать для расчета коэффициента управления С для каждого фермента в метаболическом пути. Этот коэффициент выражает относительный вклад каждого фермента в скорость превращения метаболитов в метаболическом пути, т. е. поток J. Коэффициент С может принимать любые значения от 0 (для фермента, не влияющего на поток) до 1 (для фермента, полностью контролирующего поток). Коэффициент управления может иметь и отрицательное значение, поскольку фермент, задействованный в разветвленных метаболических путях, может выводить метаболиты из одного пути и тем самым вносить отрицательный вклад в поток по этому пути (рис. 15-8). Коэффициент управления не константа и не характеристический параметр данного фермента; он зависит от ферментной системы в целом и от концентраций субстратов и эффекторов.
Рис. 15-8. Коэффициенты управления С в разветвленном метаболическом пути. В данном процессе интермедиат В может претерпевать два типа превращений. Поскольку реакция В —> Е выводит вещество В из метаболического пути А —> D, фермент, катализирующий стадию В —> Е, имеет отрицательный коэффициент управления. Обратите внимание, что сумма всех четырех коэффициентов управления равна 1.
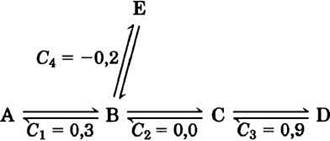
Применение теории контроля метаболизма для интерпретации эксперимента по гликолизу в экстракте печени крысы (рис. 15-7) показало, что для гексокиназы коэффициент управления 0,79, для PFK-1 0,21 и для глюкозофосфати- зомеразы 0,0 (ферменты находятся в экстракте). Видно, что сумма этих коэффициентов равна 1, и это не простое совпадение. Можно показать, что для любого полного метаболического пути сумма коэффициентов управления должна быть равна 1.
Коэффициент эластичности в связан с откликом фермента на изменения концентраций метаболитов или регуляторов
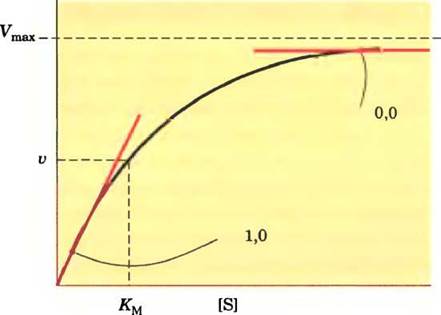
Коэффициент эластичности ε количественно выражает отклик фермента на изменения концентрации метаболита или регулятора и зависит от кинетики ферментативной реакции. Например, если ферментативная реакция описывается кинетикой Михаэлиса-Ментен, продуктивность этой реакции (т. е. активность фермента) связаны с концентрацией субстрата гиперболической зависимостью (рис. 15-9). При низкой концентрации субстрата, равной, скажем, 0,1 Км, увеличение концентрации субстрата приводит к пропорциональному увеличению ферментативной активности; ε ≈ 1,0. При сравнительно высокой концентрации субстрата, например, 10 Км, дальнейшее ее увеличение оказывает лишь небольшое влияние на скорость реакции, поскольку фермент уже насыщен субстратом; ε —> 0. В случае аллостерических ферментов с положительной коопе- ративностью может быть, что ε >1, но е никогда не может быть больше, чем коэффициент Хилла. Вспомните, что коэффициент Хилла — это мера кооперативности; его величина обычно лежит в диапазоне от 1,0 до 4,0.
Рис. 15-9. Коэффициент эластичности ε для фермента, действие которого соответствует кинетике Михаэлиса- Ментен. При [S] « Км увеличение [S] приводит к более значительному росту скорости реакции v; в этой области кривой ε —> 1. При [S] » Kм увеличение [S] слабо сказывается на изменении v; в этой области ε —> 0.
Коэффициент отклика R отражает действие внешнего регулятора на поток через метаболический путь
Количественно можно выразить также относительное влияние на поток любого внешнего фактора (например, гормона или фактора роста), не метаболита и не фермента этого метаболического пути. Чтобы экспериментально определить коэффициент отклика R, следует измерить поток через метаболический путь (в данном случае гликолиз) при различных значениях параметра Р (например, концентрации инсулина) — коэффициент отклика отражает изменения потока при изменениях Р (концентрации инсулина).
Три коэффициента С, ε и R связаны между собой простым соотношением: отклик R метаболического пути на внешний фактор, влияющий на определенный фермент, есть функция 1) чувствительности пути к изменениям активности данного фермента (т. е. коэффициента управления С) и 2) чувствительности данного фермента к изменениям внешнего фактора (т. е. эластичности ε):
R = С • ε
Подобным образом можно проанализировать каждый фермент, задействованный в метаболическом пути, а также определить влияние на поток некоторых внешних факторов. Итак, теоретически возможно предсказать характер изменений потока субстрата в серии ферментативных стадий при изменении одного или нескольких внешних регулирующих факторов. В доп. 15-1 изложен математический аспект данной теории.
Приложение теории контроля метаболизма к метаболизму углеводов дало неожиданные результаты
Теория контроля метаболизма позволяет количественно описывать механизмы регуляции, интерпретировать регуляторную роль каждого фермента метаболического пути, идентифицировать стадии, оказывающие наиболее сильное влияние на поток, а также проводить различие между регуляторными механизмами, направленными на поддержание концентраций метаболитов, и механизмами контроля, которые реально изменяют потоки в метаболическом пути. Например, анализ гликолиза у дрожжей выявил неожиданно низкое значение коэффициента управления С для РЕК-1, которая, как было известно, подвержена аллостерической регуляции и поэтому считалась основным участком контроля потока (лимитирующей стадией) при гликолизе. Пятикратное увеличение уровня РЕК-1 увеличивало поток лишь на 10%, что говорит о роли РЕК-1 не как регулятора потока в гликолитическом пути, а, скорее, как посредника в поддержании гомеостаза, предотвращающего значительные изменения концентрации метаболитов при усилении потока через этот путь в ответ на повышение уровня глюкозы в крови или сигнал инсулина. Вспомните, что при изучении гликолиза в экстракте печени (рис. 15-7) также было получено значение коэффициента управления С, противоречащее теории. Оказалось, что не РЕК-1, а гексокиназа оказывает наиболее сильное влияние на поток в гликолизе. Следует отметить, что экстракт печени вовсе не гепатоцит, и наилучшим способом изучения контроля потока было бы варьирование активности каждого отдельного фермента в живой клетке. В некоторых случаях такие исследования можно выполнить.
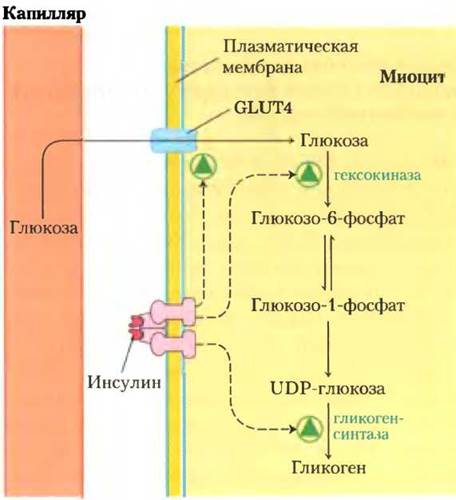
В качестве неинвазивного метода определения концентрации гликогена и метаболитов в пятистадийном процессе превращения глюкозы крови в гликоген в миоцитах человека и крысы применяли ядерный магнитный резонанс (ЯМР; рис. 15-10). Выяснилось, что для гликогенсинтазы коэффициент управления С меньше, чем для переносчика глюкозы и гексокиназы. (Мы обсудим гликогенсинтазу и другие ферменты метаболизма гликогена в разд. 15.4 и 15.5.) Это открытие также противоречило идее о том, что гликогенсинтаза — ключевой пункт контроля потока метаболитов, и показывало, что фосфорилирование и дефосфорилирование гликогенсинтазы связано с поддержанием гомеостаза, т. е. с регуляцией, а не с контролем метаболизма. Два метаболита данного пути глюкоза и глюкозо-6-фосфат — ключевые интермедиаты других метаболических путей, включая гликолиз, пентозофосфатный путь и синтез глюкозамина. Из теории контроля метаболизма следует, что при повышении уровня глюкозы крови начинается действие инсулина, направленное на 1) усиление транспорта глюкозы внутрь клеток путем приближения GLUT4 к плазматической мембране, 2) индукцию синтеза гексокиназы и 3) активацию с помощью ковалентной модификации гликогенсинтазы (см. рис. 15-39). Первые два действия инсулина усиливают поток глюкозы в данном пути (контроль), а третье служит для адаптации активности гликогенсинтазы с целью не допустить серьезных изменений уровня метаболитов (например, глюкозо-6-фосфата) при усилении потока (регуляция).
Рис. 15-10. Контроль синтеза гликогена из глюкозы крови в миоцитах. Инсулин влияет на три из пяти стадий данного пути метаболизма, причем поток метаболитов в сторону синтеза гликогена зависит от действия инсулина на транспорт глюкозы и активность гексокиназы, но не на активность гликогенсинтазы.
Теория контроля метаболизма предлагает общий метод для усиления потока в метаболическом пути
Как создать клетку, в которой усилен поток в одном метаболическом пути, но не изменяются концентрации других метаболитов или другие потоки? Более 20 лет назад Хенрик Кексер, используя теорию контроля метаболизма, предсказал, что это можно осуществить путем увеличения концентрации каждого фермента данного метаболического пути. Его предсказание было подтверждено в нескольких экспериментальных работах и соответствует реальному способу контроля потока в клетке. Например, если в рацион питания крыс включать большое количество белка, они начинают превращать избыточные аминогруппы в мочевину в цикле мочевины (гл. 18). В результате такой смены питания выход мочевины увеличивается в 4 раза, а количество всех восьми ферментов, задействованных в цикле мочевины, возрастает в 2-3 раза. Аналогичным образом, при активации окисления жирных кислот в результате стимуляции рецептора активатора пролиферации пероксисом y (RPARy; см. рис. 21-22) происходит усиление синтеза всего набора окислительных ферментов. Использование ДНК-микрочипов для изменения экспрессии целых групп генов в ответ на различные стимулы, возможно, скоро позволит определить, отражает ли подобная картина общий механизм, с помощью которого клетки изменяют потоки через специфические пути метаболизма.
Краткое содержание раздела 15.2 Теория контроля метаболизма
■ Из теории контроля метаболизма следует, что контроль скорости потока метаболитов в метаболическом пути осуществляется несколькими ферментами данного пути.
■ Коэффициент управления С можно определить экспериментально; он служит мерой влияния концентрации фермента на поток в данном пути с участием многоферментной системы. Этот параметр не относится к каждому ферменту, а характеризует всю систему в целом.
■ Коэффициент эластичности ε фермента также можно определить экспериментально; он служит мерой отклика фермента на изменения концентрации метаболита или регулятора.
■ Коэффициент отклика R (или просто отклик) отражает экспериментально определяемое изменение потока, связанное с влиянием регуляторного гормона или вторичного мессенджера. Отклик представляет собой функцию C и ε: R = С • ε.
■ Некоторые регулируемые ферменты контролируют поток в метаболическом пути, в то время как другие отвечают за поддержание уровня метаболитов при изменениях потока. Ферменты первого рода осуществляют контроль процесса, а вторые — его регуляцию.
■ Из теории контроля метаболизма следует, что наиболее эффективный способ усиления потока в сторону образования желаемого продукта — повышение концентрации всех ферментов, задействованных в метаболическом пути.