ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
15. ПРИНЦИПЫ РЕГУЛЯЦИИ МЕТАБОЛИЗМА
Вопросы и задачи
1. Измерение внутриклеточных концентраций метаболитов.
Измерение концентраций промежуточных продуктов (интермедиатов) метаболизма в живой клетке сопряжено с большими экспериментальными трудностями; обычно для определения концентрации метаболита клетки приходится разрушать. Поскольку ферментативные превращения метаболитов происходят очень быстро, обычно измерения дают не физиологическую, а равновесную концентрацию метаболита. Поэтому надежна только такая экспериментальная методика, которая позволяет мгновенно остановить все ферментативные реакции в интактной ткани и тем самым предотвратить дальнейшие превращения промежуточных продуктов метаболизма. Этого можно достичь, быстро поместив ткань между большими алюминиевыми пластинами, которые охлаждаются жидким азотом (-190 °С); этот метод называется «фиксацией замораживанием». После замораживания, мгновенно подавляющего ферментативную активность, ткань измельчают, а ферменты инактивируют путем осаждения хлорной кислотой. Осадок удаляют центрифугированием, а в прозрачной надосадочной жидкости определяют содержание метаболитов. Для расчета внутриклеточных концентраций метаболитов определяют объем внутриклеточного пространства исходя из общего содержания воды в ткани и внеклеточного объема.
В таблице приведены внутриклеточные концентрации субстратов и продуктов реакции, катализируемой фосфофруктокиназой-1, в ткани сердца крысы.
Метаболит |
Концентрация (мкМ)* |
Фруктозо-6-фосфат |
87 |
Фруктозо-1,6-бисфосфат |
22 |
АТР |
11400 |
АDР |
1320 |
* Размерность — мкмоль/мл внутриклеточной воды.
а) Рассчитайте для реакции, катализируемой РFК-1 в физиологических условиях, отношение действующих масс
![]()
б) ∆G′ = -14,2 кДж/моль. Рассчитайте константу равновесия реакции, катализируемой PFK-1.
в) Сравните значения Q и К′eq. Близка ли эта физиологическая реакция к состоянию равновесия? Объясните ответ. Что данный эксперимент говорит о роли PFK-1 в качестве регуляторного фермента?
2. Равновесны ли метаболические реакции?
а) Фосфоенолпируват (ФЕП) — один из двух доноров фосфорильных групп для синтеза АТР при гликолизе. В эритроцитах человека стационарная концентрация АТР составляет 2,24 мМ, ADP 0,25 мМ, пирувата 0,051 мМ. Определите концентрацию ФЕП при 25 °С, считая, что в клетке реакция, катализируемая пируваткиназой (см. рис. 13-13), происходит в равновесных условиях.
б) Физиологическая концентрация ФЕП в эритроцитах человека составляет 0,023 мМ. Сравните это значение с тем, что вы получили при ответе на вопрос (а). Чем объясняется различие этих значений?
3. Влияние содержания кислорода на скорость реакций гликолиза.
Регулируемые стадии гликолиза в интактных клетках можно идентифицировать, изучая катаболизм глюкозы в целых тканях и органах. Например, потребление глюкозы сердечной мышцей можно найти, если осуществить искусственную циркуляцию крови через изолированное сердце и измерить концентрацию глюкозы в крови до поступления в сердце и на выходе. Если пропускать через сердце кровь без кислорода, то мышца потребляет глюкозу со стационарной скоростью. При обогащении крови кислородом скорость потребления глюкозы резко падает, а затем устанавливается на новом, более низком уровне. Объясните это.
4. Регуляция фосфофруктокиназы-1.
Влияние АТР на активность аллостерического фермента PFK-1 показано на рисунке. При определенной концентрации фруктозо-6-фосфата активность PFK-1 увеличивается с ростом концентрации АТР; однако после достижения некоторой точки рост концентрации АТР начинает ингибировать действие фермента.
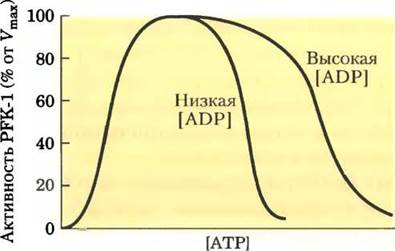
а) Объясните, почему АТР является как субстратом, так и ингибитором PFK-1. Каким образом АТР осуществляет регуляцию фермента?
б) Каким образом гликолиз регулируется в зависимости от уровня АТР?
в) Ингибирование PFK-1 под действием АТР ослабевает при высокой концентрации ADP, как показано на рисунке. Как вы можете объяснить это явление?
5. Концентрация глюкозы в клетке.
Концентрация глюкозы в плазме крови человека поддерживается на уровне 5 мМ, а концентрация свободной глюкозы в миоцитах значительно ниже. Почему концентрация глюкозы в клетках низкая? Что происходит с глюкозой после ее проникновения в клетку? Некоторым пациентам назначают внутривенное введение глюкозы в качестве источника питания. Превращение глюкозы в глюкозо-6-фосфат происходит с затратой АТР, так почему же больным не вводят внутривенно вместо глюкозы глюкозо-6-фосфат?
6. Ферментативная активность и физиологическая функция.
Для гликогенфосфорилазы из скелетных мышц Vmax намного превосходит Vmax для того же фермента из печени.
а) Каковы физиологические функции гликогенфосфорилазы в скелетных мышцах и в печени?
б) Почему в случае мышечной формы фермента Vmax должно быть больше, чем в случае фермента из печени?
7. Равновесие реакции, катализируемой гликоген- фосфорилазой.
Гликогенфосфорилаза катализирует отщепление глюкозы от молекулы гликогена. ∆G′° этой реакции составляет 3,1 кДж/моль
а) Определите отношение [Рi]/[глюкозо-1-фосфат] для реакции, находящейся в равновесии. (Подсказка. Отщепление глюкозы от полимерной молекулы гликогена не влияет на концентрацию гликогена.)
б) В физиологических условиях отношение [Рi]/[глюкозо-1 -фосфат] в миоцитах превышает 100:1. Что это говорит о направлении потока метаболитов в реакции, катализируемой гликоген- фосфорилазой в мышцах?
в) Почему при равновесии и в физиологических условиях значения различаются? В чем смысл этого различия?
8. Регуляция гликогенфосфорилазы.
Скорость превращения гликогена в глюкозо-6-фосфат в мышечной ткани определяется отношением концентраций активной фосфорилазы а и менее активной фосфорилазы b. Определите, как изменится скорость расщепления гликогена, если образец мышечной ткани, содержащий гликогенфосфорилазу, обработать а) киназой фосфорилазы и АТР; б) РР1; в) адреналином.
9. Расщепление гликогена в мышцах кролика.
Расходование гликогена и глюкозы в клетке регулируется на четырех стадиях гликолиза. Для сравнения регуляции гликолиза при избытке и при недостатке кислорода рассмотрим расходование глюкозы и гликогена в мышцах лап кролика в двух физиологических ситуациях: в состоянии покоя, для которого характерны небольшие затраты АТР, и при приближении смертельного врага кролика койота, от которого кролик вынужден прятаться в норе. Для каждого случая определите относительное содержание (высокое, промежуточное или низкое) АМР, АТР, цитрата и ацетил-СоА, а также влияние, которое оказывает их уровень на поток метаболитов в гликолизе, регулируемый специфическими ферментами. В моменты стресса мышцы лап кролика вырабатывают большую часть АТР путем анаэробного гликолиза (молочнокислого брожения) и лишь немного — при окислении ацетил-СоА, образующегося в результате расщепления жиров.
10. Расщепление гликогена у перелетных птиц.
В отличие от кролика, ненадолго скрывающегося в норе, перелетные птицы нуждаются в запасах энергии для длительных перелетов. Например, утки при ежегодной миграции преодолевают расстояния в несколько тысяч километров. Мышцы перелетных птиц обладают высокой окислительной способностью и получают необходимый АТР при окислении ацетил-СоА (из жиров) через цикл лимонной кислоты. Сравните регуляцию гликолиза при краткосрочной активности мышц спасающегося бегством кролика и при длительной активности мышц уток, совершающих перелет. Почему регуляция гликолиза в этих двух случаях должна быть различной?
11. Недостаточность ферментов в метаболизме углеводов.
Ниже описаны четыре клинических случая. Для каждого из них определите дефектный фермент и предложите метод лечения из тех, что указаны ниже. Поясните ответ. Ответьте на вопросы, приведенные в описании каждого случая. Возможно, вам придется обратиться к информации, изложенной в гл. 14.
Случай 1. Сразу после употребления молока у больного начинается рвота и понос. Проведен тест на переносимость лактозы: пациент получал определенное количество лактозы, после чего через некоторые промежутки времени у него в плазме крови определяли концентрации глюкозы и галактозы. В норме уровень этих веществ достигает максимального через час, а затем снижается. У больного концентрации глюкозы и галактозы в плазме крови не увеличивались. Объясните, почему при проведении теста у здоровых людей концентрация этих сахаров в крови сначала возрастает, а затем снижается. Почему этого не происходит у больного?
Случай 2. После употребления молока у больного начинается рвота и понос. В крови пациента концентрация глюкозы низкая, но концентрация восстанавливающих сахаров значительно выше нормы. В моче обнаружена галактоза. Почему повышена концентрация восстанавливающих сахаров в крови? Почему в моче появляется галактоза?
Случай 3. У больного после напряженной физической работы появляются судороги, но в остальном он чувствует себя здоровым. Биопсия мышечной ткани выявила повышенную концентрацию гликогена. Почему происходит накопление гликогена?
Случай 4. Пациентка находится в состоянии вялости и апатии. Печень увеличена, при биопсии в печени обнаружено повышенное содержание
гликогена. У больной понижен уровень глюкозы крови. С чем связано понижение концентрации глюкозы в крови у пациентки?
Дефектные ферменты
а) Мышечная фосфофруктокиназа-1
б) Фосфоманноизомераза
в) Галактозо-1 -фосфатуридилилтрансфераза
г) Фосфорилаза печени
д) Триозокиназа
е) Лактаза в слизистой кишечника
ж) Мальтаза в слизистой кишечника
з) Мышечный фермент, расщепляющий связи в участках ветвления гликогена
Возможное лечение
1. Ежедневный бег трусцой на 5 км
2. Диета с низким содержанием жиров
3. Диета с низким содержанием лактозы
4. Запрет на тяжелую физическую нагрузку
5. Большие дозы ниацина (предшественника NAD+)
6. Частый регулярный прием (небольшого количества) обычной пищи
12. Проявления недостаточности инсулина у больного диабетом.
Человек с инсулиннезависимым диабетом попал в больницу в состоянии, близком к коматозному. Во время отпуска в уединенном месте он потерял лекарства и не принимал инсулин на протяжении двух дней.
а) Для каждой из перечисленных ниже тканей укажите, является ли конкретное метаболическое превращение в данной ситуации более быстрым, более медленным или таким же, как у того же человека при регулярном введении инсулина.
б) Для каждого метаболического пути опишите хотя бы один контрольный механизм, ответственный за предсказанные вами изменения.
Ткани и метаболические пути
1. Жировая ткань: синтез жирных кислот
2. Мышечная ткань: гликолиз, синтез жирных кислот, синтез гликогена
3. Печень: гликолиз, глюконеогенез, синтез гликогена, синтез жирных кислот, пентозофосфатный цикл
13. Уровень метаболитов в крови при недостаточности инсулина.
Предскажите уровень следующих метаболитов в крови у пациента, описанного в задаче 12, до проведения лечения в больнице по сравнению с уровнем этих
же метаболитов в условиях нормального приема лекарства: (а) глюкоза; (б) кетоновые тела; (в) свободные жирные кислоты.
14. Влияние мутации фермента на метаболизм.
Предскажите и объясните влияние каждого дефекта, вызванного мутацией, на метаболизм гликогена: (а) потеря сАМР-связывающего участка на регуляторной субъединице протеинкиназы А (РКА); (б) отсутствие ингибитора протеинфосфатазы (ингибитора 1 на рис. 15-40); (в) повышение уровня экспрессии киназы фосфорилазы b в печени; (г) дефект рецепторов глюкагона в печени.
15. Гормональный контроль метаболических превращений.
Между ужином и завтраком уровень глюкозы крови падает, и печень начинает производить, а не расходовать глюкозу. Опишите гормональную основу этих процессов и объясните, каким образом гормональные изменения вызывают синтез глюкозы в печени.
16. Метаболизм генетически измененных мышей.
Ученые могут манипулировать генами мыши таким образом, что конкретный ген в конкретной ткани начинает кодировать либо неактивный белок (так называемая «нокаутная» мышь с «выключенным» геном), либо постоянно активированный (конститутивно активный) белок. Какие изменения метаболизма произойдут в организме мыши со следующими генетическими изменениями: (а) выключение в печени фермента, расщепляющего участки ветвления гликогена; (б) выключение гексокиназы IV в печени; (в) выключение фруктозо-1,6-бисфосфатазы-2 (FВРазы-2) в печени; (г) конститутивная активность FВРазы-2 в печени; (д) конститутивная активность AMP-зависимой протеинкиназы в мышцах; (е) конститутивная активность белка ChREBP в печени?
Анализ экспериментальных данных
17. Строение гликогена.
При физической нагрузке мышечным клеткам необходимо быстрое поступление больших количеств глюкозы. Глюкоза запасена в печени и в скелетных мышцах в полимерной форме в виде гранул гликогена. Обычно гранула гликогена содержит около 55 000 остатков глюкозы (см. рис. 15-33, б). Мелендез-Хевиа, Уэдделл и Шелтон в 1993 г. рассмотрели некоторые теоретические аспекты строения гликогена, что изложено в данной задаче.
а) Концентрация гликогена в клетках печени составляет около 0,01 М. Какой должна быть концентрация свободной глюкозы в клетках, чтобы ее количество было эквивалентно этой величине? Почему такое содержание свободной глюкозы проблематично для клетки?
Глюкоза высвобождается из гликогена с помощью фермента гликогенфосфорилазы, который отщепляет от одного конца цепи гликогена по одному остатку глюкозы. Цепи гликогена разветвленные (см. рис. 15-26 и 15-33, б), а степень ветвления (т. е. количество ветвлений в каждой цепи) сильно влияет на скорость высвобождения глюкозы.
б) Почему при слишком низкой степени ветвления (ниже оптимального уровня) скорость высвобождения глюкозы снижается? (Подсказка. Рассмотрите предельный случай с неразветвленной цепью из 55 000 остатков глюкозы.)
в) Почему при слишком высокой степени ветвления скорость высвобождения глюкозы также снижается? (Подсказка. Подумайте о физических ограничениях.)
Мелендез-Хевиа с коллегами провели серию расчетов и получили, что оптимальной степенью ветвления является наличие двух ветвлений на одну цепь гликогена (см. рис. 15-33, б). Именно такой гликоген обнаруживают в мышцах и печени.
Для определения оптимального числа глюкозных звеньев в цепи гликогена были рассмотрены два ключевых параметра, определяющих строение гранулы гликогена: t — количество слоев глюкозных цепей в грануле (молекула на рис. 15-33, б имеет пять таких слоев) и gc — число остатков глюкозы в каждой цепи. Была предпринята попытка найти значенияt и gc которые позволяли бы получить максимальные значения следующих параметров: (1) количество глюкозы в грануле гликогена (Gт), приходящееся на единицу объема; (2) количество неразветвленных цепей глюкозы (СА) в единице объема (т. е. количество цепей в наружном слое, легко доступном для гликогенфосфорилазы); и (3) количество глюкозы, доступное для фосфорилазы в этих неразветвленных цепях (Gрт).
г) Покажите, что СА = 2t-1. Это число цепей, доступных для гликогенфосфорилазы до начала действия деветвящего фермента.
д) Покажите, что Ст (общее число цепей в грануле) определяется уравнением Gт = 2t — 1. Таким образом, Gт = gc(CT) = gc(2t — 1) определяет общее число остатков глюкозы в грануле гликогена.
е) Гликогенфосфорилаза не может отщеплять остатки глюкозы от цепей гликогена, содержащих менее пяти остатков глюкозы. Покажите, что GРТ = - 4)(2t- 1). Это количество глюкозы, доступной для гликогенфосфорилазы.
ж) Исходя из размера остатка глюкозы и расположения ветвей получается, что толщина одного слоя цепей гликогена составляет 0,12gc + 0,35 нм. Покажите, что объем гранулы гликогена (Vs) задается уравнением: Vs = 4/3 • πt3(0,12gс + 0,35)3 нм3.
Далее были определены оптимальные значения t и gс — те значения, при которых достигается максимум функции качества f), при которой СТ, СА и СРТ имеют максимальные значения, а Vs минимальные: f = (СТСАСРТ)/Vs. Установлено, что оптимальное значение gc не зависит от t.
з) Выберите t в интервале от 5 до 15 и найдите оптимальное значение gc. Сравните найденное значение gc с gc для гликогена в печени (см. рис. 15-33, б). (Подсказка. Можно воспользоваться электронными таблицами.)