ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
16. ЦИКЛ ЛИМОННОЙ КИСЛОТЫ
16.2. Реакции цикла лимонной кислоты
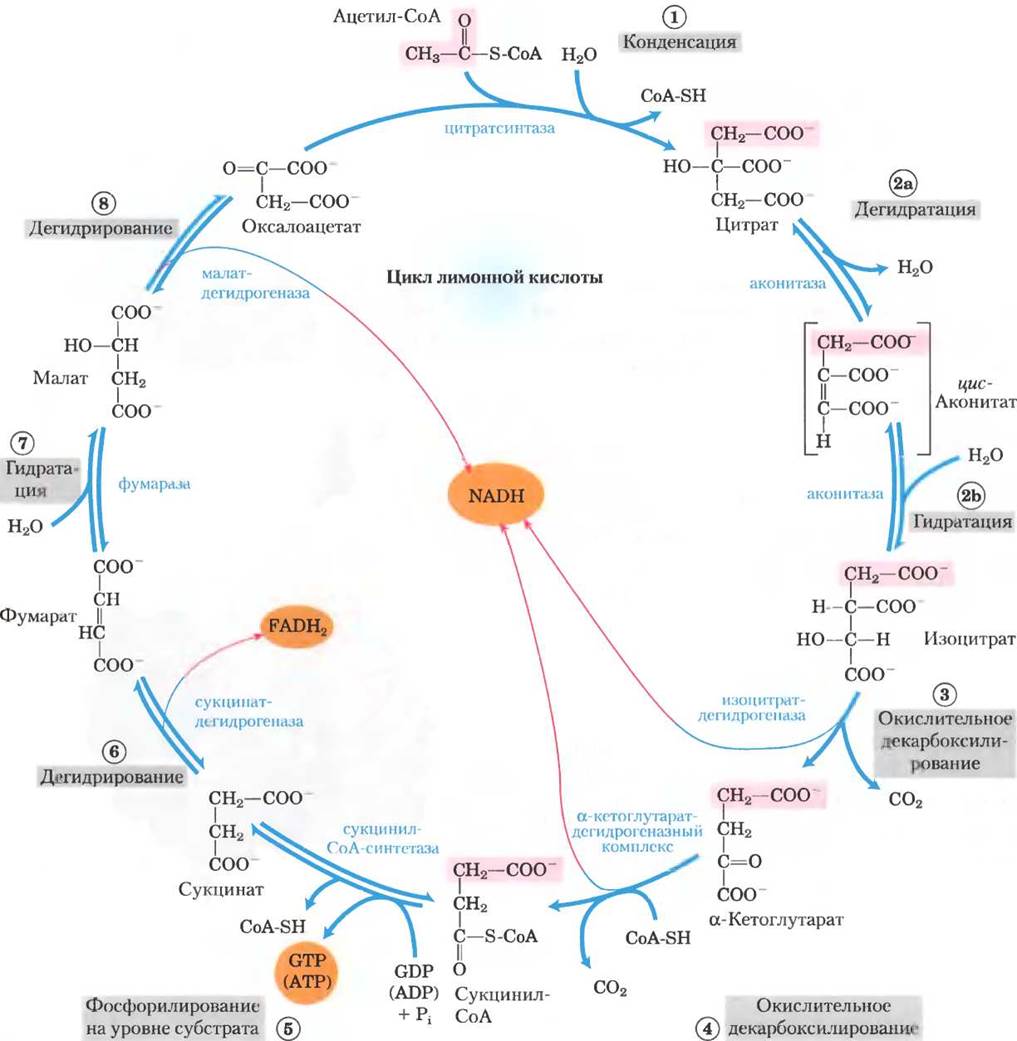
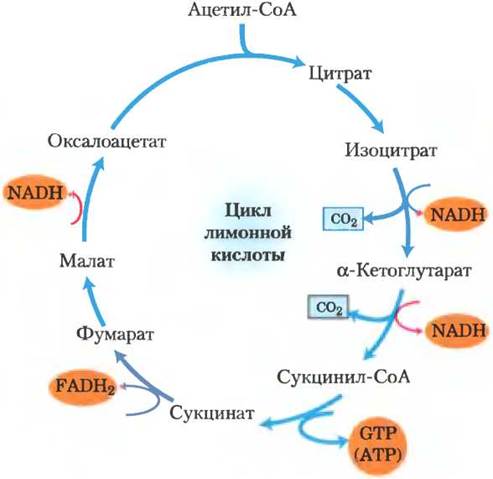
Теперь мы готовы к рассмотрению окисления ацетил-СоА. Эти химические реакции осуществляются в цикле лимонной кислоты — первом циклическом пути метаболизма, с которым мы встретились (рис. 16-7). Чтобы начать цикл реакций, ацетил-СоА передает свою ацетогруппу четырехуглеродному соединению оксалоацетату — образуется цитрат, состоящий из шести атомов углерода. Затем цитрат превращается в изоцитрат, также шестиуглеродный, который при дегидрировании теряет молекулу СО2 и переходит в а-кетоглутарат (иначе называемый оксоглутаратом), состоящий из пяти атомов углерода. α-Кетоглутарат теряет еще одну молекулу СО2 и превращается в четырехуглеродное соединение сукцинат. Сукцинат в трехстадийном ферментативном процессе превращается в оксалоацетат, который готов реагировать с новой молекулой ацетил-СоА. При каждом обороте цикла в него вступает одна ацетогруппа (два атома углерода) в форме ацетил-СоА, а две молекулы СО2 его покидают. Одна молекула оксалоацетата используется на образование цитрата, а еще одна — регенерируется, т. е. в суммарном процессе оксалоацетат не расходуется. Теоретически одна молекула оксалоацетата может использоваться для окисления бесконечного числа ацетогрупп; и на самом деле концентрация оксалоацетата в клетке очень низкая. Четыре из восьми стадий описанного процесса являются реакциями окисления, энергия которых очень эффективно сохраняется в форме восстановленных коферментов NADH и FADH2.
Рис. 16-7. Реакции цикла лимонной кислоты. Розовым цветом выделены атомы углерода, ведущие свое происхождение из ацетогруппы ацетил-СоА, поступающего в самый первый цикл; это не те атомы углерода, которые выделяются в первом раунде в виде СО2 (стадия (3)). Обратите внимание, что в молекулах сукцината и фумарата эту группу из двух атомов углерода невозможно определить однозначно: поскольку сукцинат и фумарат имеют симметричное строение, атомы С-1 и С-2 в этих молекулах неразличимы с атомами С-4 и С-3. Порядковый номер, которым обозначена каждая реакционная стадия, соответствует принятой в тексте нумерации. Красные стрелки указывают на те участки, в которых происходит запасание энергии от переноса электронов на FAD или NAD+, в результате чего образуются FADHZ или NADH + Н+ соответственно. Стадии (1), (3) и (4) в клетке практически необратимы, а остальные реакции обратимые. Продуктом реакции (5) может быть, как АТР, так и GTP, что зависит от того, какой изофермент сукцинил-СоА-синтетазы катализирует данную стадию.
Как уже упоминалось выше, хотя цикл лимонной кислоты занимает центральное положение в энергетическом метаболизме, его роль не ограничивается накоплением энергии. Четырех - и пятиуглеродные интермедиаты цикла служат предшественниками множества разнообразных продуктов. Для восполнения интермедиатов, расходующихся на эти нужды, клетка использует анаплеротические (компенсирующие) реакции, которые мы обсудим ниже.
В 1948 г. Юджин Кеннеди и Альберт Ленинджер показали, что в клетках эукариот все реакции цикла лимонной кислоты осуществляются в митохондриях. В изолированных митохондриях были обнаружены не только все ферменты и коферменты цикла, но также все ферменты и белки, необходимые для осуществления заключительной стадии дыхания — перенос электронов и синтеза АТР путем окислительного фосфорилирования. Как мы увидим в заключительных главах книги, митохондрии, кроме того, содержат ферменты, необходимые для окисления жирных кислот и некоторых аминокислот до ацетил-СоА, а также для окислительного разложения других аминокислот до α-кетоглутарата, сукцинил-СоА или оксалоацетата. Таким образом, у нефотосинтезирующих эукариот именно в митохондриях осуществляется большинство окислительных реакций, приводящих к накоплению энергии, а также сопряженный с этим синтез АТР. У фотосинтезирующих эукариот в темноте АТР синтезируется в основном в митохондриях, а на свету АТР производят главным образом хлоропласты. У большинства бактерий ферменты цикла лимонной кислоты сосредоточены в цитозоле, а плазматическая мембрана играет роль, аналогичную той, что выполняет внутренняя митохондриальная мембрана в синтезе АТР (гл. 19).
Цикл лимонной кислоты осуществляется в восемь стадий
Обсуждая восемь последовательных реакций цикла лимонной кислоты, мы особое место уделим тем, которые происходят при окислении цитрата, образующегося из ацетил-СоА и оксалоацетата с выделением СО2 и энергии, запасающейся в форме восстановленных коферментов NADН и FАDН2.
(1) Образование цитрата. Первая реакция цикла, катализируемая цитратсинтазой, представляет собой конденсацию ацетил-СоА с оксалоацетатом, приводящую к образованию цитрата:
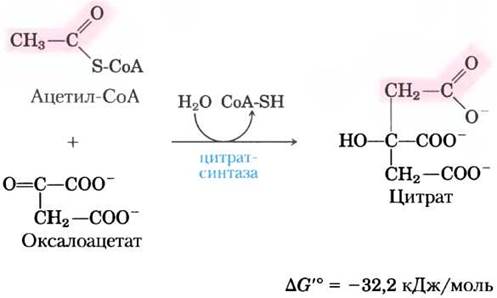
В данной реакции метальный углерод ацетогруппы ацетил-СоА присоединяется к карбонильной группе (С-2) оксалоацетата. Промежуточным продуктом, образующимся в активном центре фермента, является цитроил-СоА (см. рис. 16-9). Он быстро гидролизуется до свободного СоА и цитрата, которые покидают активный центр. Гидролиз этого богатого энергией тиоэфирного производного способствует тому, что реакция оказывается экзергонической. Большая отрицательная величина изменения стандартной свободной энергии реакции, катализируемой цитратсинтазой, имеет важное значение для всего цикла, поскольку, как отмечалось ранее, концентрация оксалоацетата в клетке обычно очень низкая. Высвобождаемый в этой реакции СоА вновь используется для окислительного декарбоксилирования другой молекулы пирувата под действием пируватдегидрогеназного комплекса.
Цитратсинтаза из митохондрий была получена в виде кристаллов, что дало возможность проведения рентгеноструктурного анализа этого фермента в присутствии субстратов и ингибиторов и без них (рис. 16-8). Каждая субъединица этого гомодимерного фермента представляет собой полипептид, состоящий из двух доменов: большого домена с довольно жесткой структурой и меньшего более гибкого домена; активный центр фермента располагается между этими двумя доменами. Оксалоацетат, который первым связывается с ферментом, вызывает сильные конформационные изменения в гибком домене, в результате чего формируется центр связывания второго субстрата — ацетил-СоА. При образовании в активном центре цитрил-СоА вновь происходят конформационные изменения, которые на этот раз приводят к гидролизу тиоэфира и высвобождению СоА-SН. Такое индуцированное соответствие между ферментом и его субстратом, а затем интермедиатом снижает вероятность преждевременного и непродуктивного расщепления тиоэфирной связи в ацетил-СоА. Результаты кинетических исследований согласуются с подобным упорядоченным двухсубстратным механизмом реакции (см. рис. 6-13, т. 1). Реакция, катализируемая цитратсинтазой, это по сути конденсация Кляйзена (с. 23) с участием тиоэфира (ацетил-СоА) и кетона (оксалоацетат) (рис. 16-9).
Рис. 16-8. Структура цитратсинтазы. При связывании оксалоацетата гибкий домен каждой субъединицы претерпевает большие конформационные изменения, в результате которых формируется центр связывания ацетил-СоА. а — открытая форма фермента (РDВ ID 5GSС). 6 — закрытая форма фермента со связанным оксалоацетатом (желтый) и стабильным аналогом ацетил-СоА (карбоксиметил-СоА, красный) (РDВ ID 5GТS).
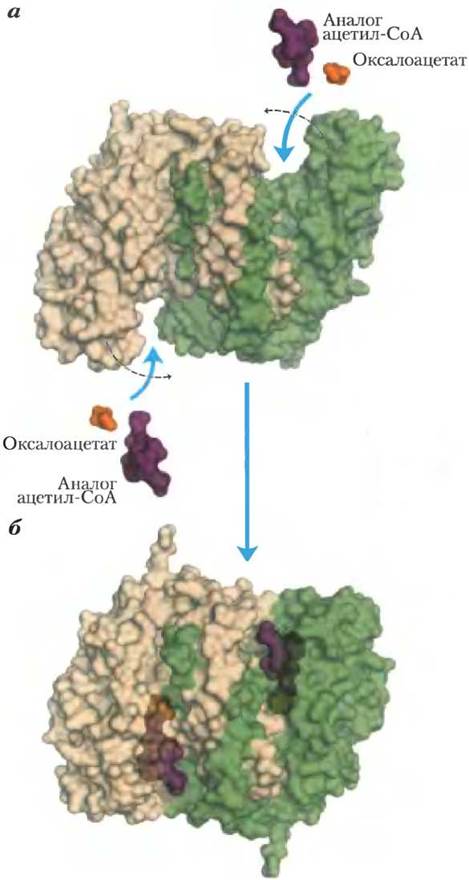
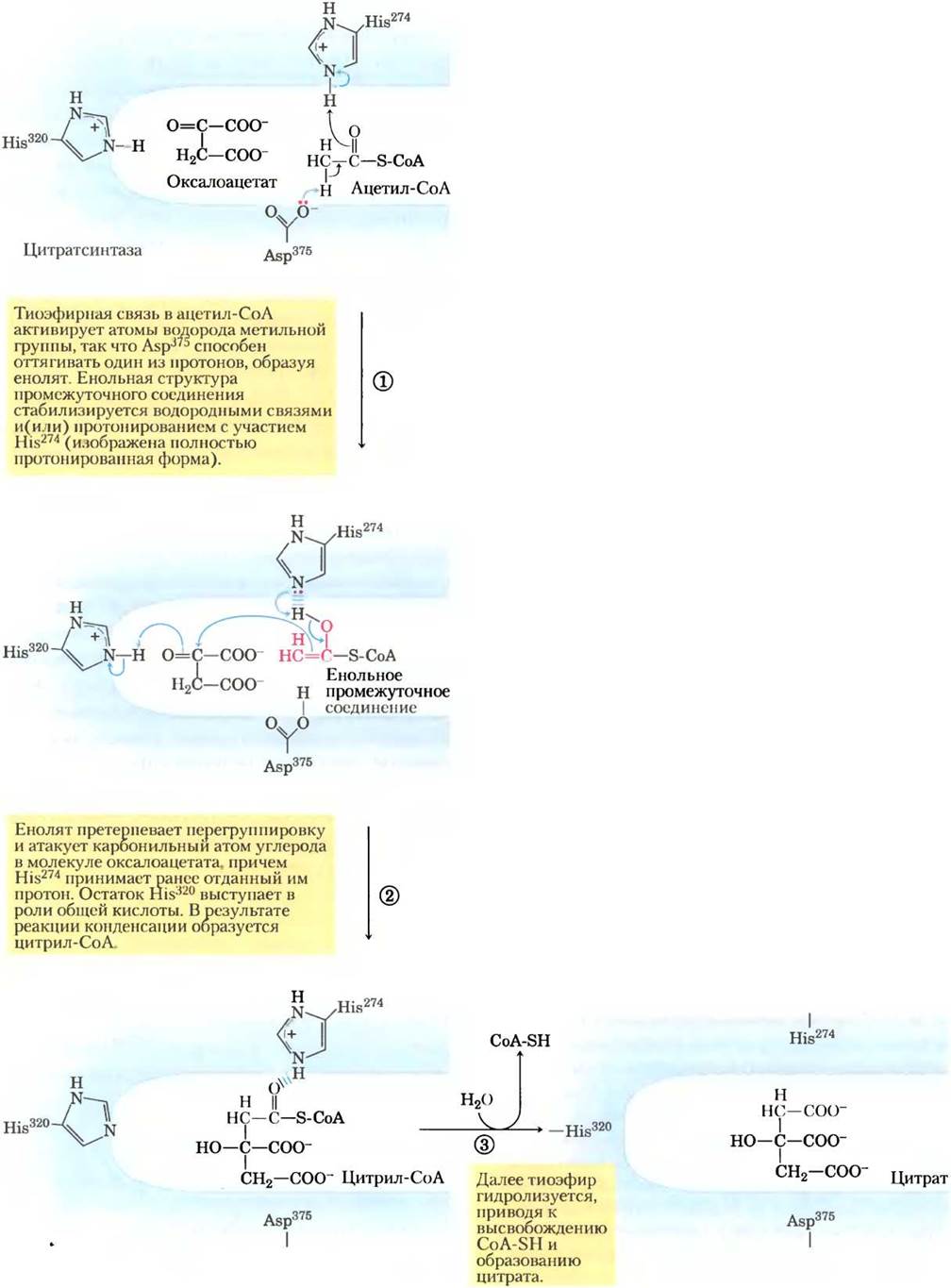
Рис. 16-9. Механизм реакции. Цитратсинтаза. Реакция, катализируемая цитратсинтазой в клетках млекопитающих, происходит в строго определенном порядке, при этом первым связывается оксалоацетат. Это связывание приводит к конформационным изменениям, открывающим центр связывания ацетил-СоА. В активном центре фермента оксалоацетат ориентирован определенным образом, что объясняется взаимодействием двух его карбоксильных групп с двумя положительно заряженными остатками Arg (не показаны). Механизм действия цитратсинтазы
(2) Превращение цитрата в изоцитрат через цис-аконитат. Фермент аконитаза (точнее аконитатгидратаза) катализирует обратимое превращение цитрата в изоцитрат. Промежуточным продуктом реакции (в норме не отделяющимся от активного центра фермента) является трикарбоновая кислота цис-аконитат. Аконитаза может катализировать обратимое присоединение молекулы воды по двойной связи связанного с ферментом цис- аконитата двумя путями: в одном случае образуется цитрат, а в другом — изоцитрат:
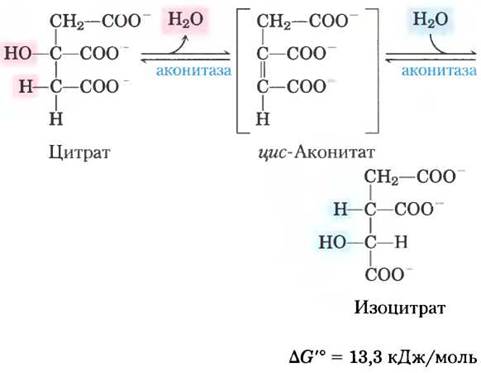
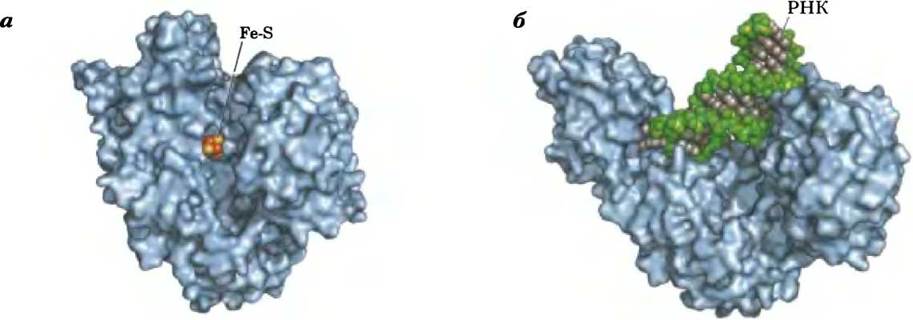
В равновесной смеси при pH 7,4 и 25 °С содержится менее 10% изоцитрата, однако в клетке реакция протекает с высокой скоростью, поскольку изоцитрат быстро расходуется в следующей стадии цикла, что снижает его стационарную концентрацию. Фермент аконитаза содержит так называемый железосерный центр (рис. 16-10), который служит как для связывания субстрата в активном центре, так и для каталитического присоединения и удаления молекулы воды. При недостатке в клетках железа аконитаза теряет свой железосерный кластер и начинает выполнять новую функцию в регуляции гомеостаза железа. Аконитаза — один из многочисленных белков, выполняющих кроме своей основной функции еще и другие функции (так называемые ферменты со скрытой функцией; см. доп. 16-1).
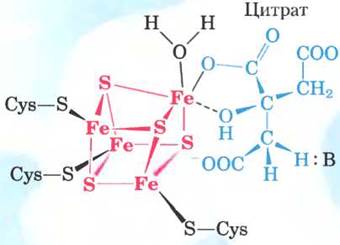
Рис. 16-10. Структура железосерного центра в аконитазе. Железосерный центр показан красным цветом, а молекула цитрата — синим. Три атома железа связывают три остатка Суs в молекуле фермента; четвертый атом железа связан с одной из карбоксильных групп цитрата, а также принимает участие в нековалентном взаимодействии с гидроксильной группой цитрата (штриховая линия). Остаток фермента (:В) имеет основные свойства и помогает определенным образом расположить цитрат в активном центре. Железосерный центр принимает участие как в связывании субстрата, так и в катализе. Свойства железосерных центров обсуждаются в гл. 19 (см. рис. 19-5).
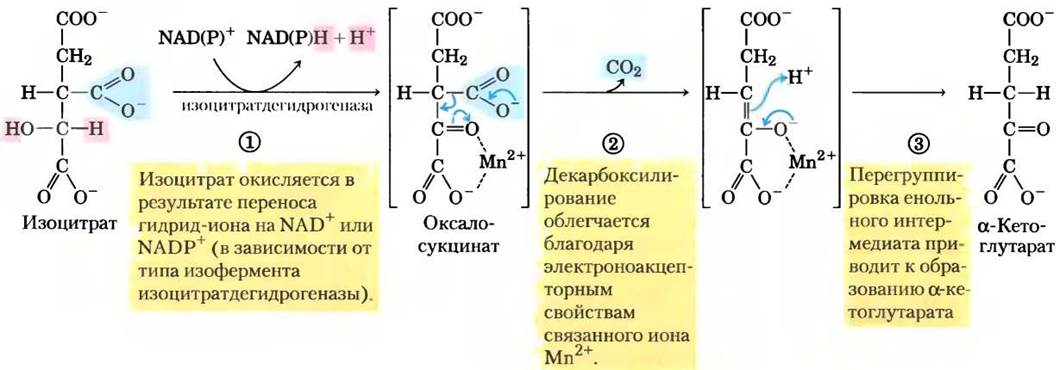
(3) Окисление изоцитрата до α-кетоглутарата и СO2. На следующей стадии под действием изоцитратдегидрогеназы происходит окислительное декарбоксилирование изоцитрата с образованием α-кетоглутарата (рис. 16-11). Ион Мn2+ в активном центре взаимодействует с карбонильной группой в промежуточном соединении (оксалосукцинате), которое не покидает активного центра, пока в результате декарбоксилирования не превратится в α-кетоглутарат. Кроме того, Мn2+ стабилизирует енольную структуру, образующуюся в процессе декарбоксилирования.
Рис. 16-11. Механизм реакции. Действие изоцитратдегидрогеназы. Субстрат (изоцитрат) теряет один атом углерода в результате окислительного декарбоксилирования. Подробнее о переносе гидрид-иона с участием NAD+ и NADP+ см. на рис. 14-13.
В клетках существуют две формы изоцитрат- декарбоксилазы, одна использует NАD+ как акцептор электронов, а другая — NАDР+. В остальном реакции, катализируемые этими изоферментами, идентичны. В эукариотических клетках NАD- зависимый фермент находится в матриксе митохондрий и принимает участие в цикле лимонной кислоты. Возможно, основная функция NАDР- зависимой формы фермента, встречающейся как в митохондриях, так и в цитозоле, — образование NАDРН, необходимого для восстановительных анаболических реакций.
Дополнение 16-1. Ферменты со скрытой функцией
Формула «один ген — один фермент», высказанная в 1940 г. Джорджем Бидлом и Эдвардом Тейтемом (см. гл. 24, т. 3), считалась справедливой на протяжении всего XX в.; считалось также, что каждый белок в клетке выполняет всего одну конкретную функцию. Однако в последнее время было обнаружено множество удивительных примеров того, что один белок, кодируемый одним геном, выполняет в клетке не одну, а несколько функций. Один из таких белков — аконитаза, которая действует и как фермент, и как регулятор синтеза белка.
В эукариотических клетках есть две изоформы аконитазы. Митохондриальная форма фермента превращает цитрат в изоцитрат в цикле лимонной кислоты. Цитозольный фермент выполняет две разные функции. Он катализирует превращение цитрата в изоцитрат, поставляя субстрат для цитозольной изоцитратдегидрогеназы, которая образует NАDРН в качестве восстановителя для синтеза жирных кислот и других процессов анаболизма в цитозоле. Кроме того, эта форма аконитазы участвует в регуляции гомеостаза железа в клетке.
Железо нужно всем клеткам, поскольку многие клеточные белки используют его в качестве кофактора. Дефицит железа в организме человека приводит к анемии, недостатку эритроцитов и снижению кислородной емкости крови, что может угрожать жизни человека. Слишком высокий уровень железа также опасен: железо накапливается в печени и повреждает ее (гемохроматоз и другие заболевания). Получаемое с пищей железо переносится в крови белком трансферрином и попадает в клетки путем эндоцитоза, опосредованного рецепторами трансферрина. Внутри клеток железо используется для синтеза гема, цитохромов, железосерных белков и других железозависимых белков, а избыток железа запасается в комплексе с белком ферритином. Таким образом, содержание трансферрина, рецепторов трансферрина и ферритина — все это играет важную роль в гомеостазе железа в клетке. Синтез этих белков регулируется в зависимости от доступности железа, а «скрытая» функция аконитазы как раз и играет ключевую регуляторную роль в этом процессе.
В активном центре аконитазы содержится железосерный кластер (см. рис. 16-10). Когда в клетке мало железа, этот Fе-S кластер разбирается, и аконитаза теряет свою ферментативную активность. Однако образующийся при этом апофермент (аконитаза без Fе-S-кластера) приобретает другую способность — связываться со специфическими последовательностями мРНК трансферринового рецептора и ферритина и регулировать синтез этих белков на уровне трансляции. Независимо друг от друга были открыты два регуляторных белка IRPI и IRР2, участвующие в метаболизме железа. Оказалось, что белок IRР1 идентичен цитозольной форме апоаконитазы, а IRР2 очень близок к нему по структуре и функции, однако в отличие от IRP1 он не может превратиться в каталитически активную аконитазу. Как IRP1, так и IRP2 связываются с участками мРНК, кодирующей ферри- тин и рецептор трансферрина, что приводит к мобилизации и поглощению железа клеткой. Эти участки мРНК являются фрагментами шпилечной структуры (с. 409, т. 1), называемой железо-чувствительными элементами (IRE, от англ. iron response elements), расположенной на 5' и 3'-концах мРНК (рис. 1). При связывании белков IRP с нетранслируемой 5'-областью мРНК ферритина происходит остановка синтеза ферритина. При связывании белков IRP с нетранслируемой З'-областью последовательности IRE в мРНК рецептора трансферрина происходит стабилизация мРНК, предотвращается ее деградация и появляется возможность синтеза нескольких копий белка с одной молекулы мРНК. Таким образом, при недостатке железа эффективность захвата железа клеткой возрастает, а накопление запасного железа (связанного с ферритином) замедляется. При достижении нормального уровня железа в клетке белок IRР1 превращается в аконитазу, а белок IRР2 подвергается протеолитическому расщеплению.
Каталитически активная аконитаза и регуляторная апоаконитаза имеют разную структуру. У активной аконитазы имеются две доли, окружающие железосерный кластер, а в белке IRР1 две доли раскрыты, в результате чего открывается доступ к участку связывания мРНК (рис. 2).
Рис. 1. Взаимодействие IRP1 и IRP2 с мРНК ферритина и рецептора трансферрина.
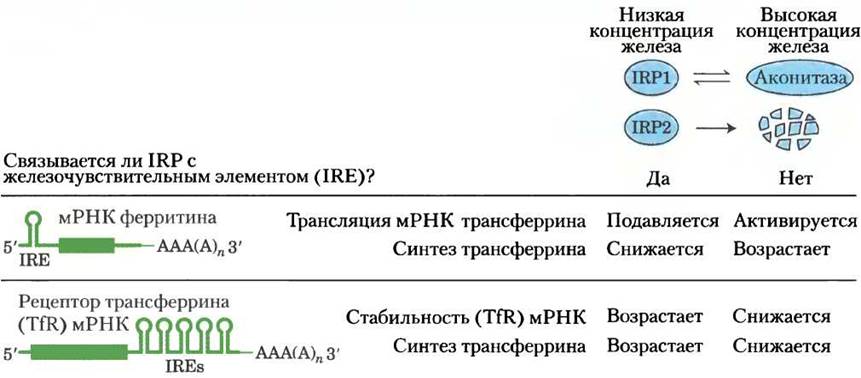
Рис. 2. Две формы цитозольной аконитазы/IRP1 с двумя различными функциями, а — в молекуле аконитазы две большие доли окружают железосерный кластер; в данном случае белок изображен прозрачным, что позволяет увидеть этот кластер (PDB ID 2B3Y). б — в белке IRP1 две доли раскрываются, давая доступ к участку связывания шпильки мРНК субстрата (PDB ID 2IPY).
Аконитаза — это лишь один пример из большого и продолжающего свое увеличение списка ферментов, которые, как выяснилось, имеют вторую, «скрытую» функцию. К этой группе относятся многие гликолитические ферменты. Пируваткиназа действует в ядре, регулируя транскрипцию генов, чувствительных к гормонам щитовидной железы. Глицеральдегид-3-гликолифосфатдегидрогеназа выступает в роли урацил-ДНК- гликозилазы, участвуя в репарации поврежденной ДНК, и регулирует транскрипцию гистона Н2В. В хрусталиках глаза позвоночных также есть гликолитические ферменты с дополнительными функциями, в числе которых фосфоглицераткиназа, триозофосфатизомераза и лактатдегидрогеназа.
До недавнего времени открытие белка, выполняющего несколько функций, происходило в какой-то степени по воле случая: две группы исследователей изучали две несвязанные проблемы и неожиданно выясняли, что «их» белки имеют сходные свойства, проводили сравнительный анализ и понимали, что эти белки идентичны. С увеличением количества аннотированных последовательностей в базах данных белков и ДНК поиск таких белков становится целенаправленным: исследователи ищут белок с такой же последовательностью, но с другой функцией. Это также означает, что белок, про который известно, что он выполняет какую-то определенную функцию, совсем не обязательно имеет только одну эту функцию в клетке. Кроме того, открытие ферментов с несколькими функциями может объяснить эксперименты, в которых клеточные ферменты с известной функцией были инактивированы с помощью мутаций, а в соответственном мутантном организме наблюдались измененные, т. е. иные, функции.
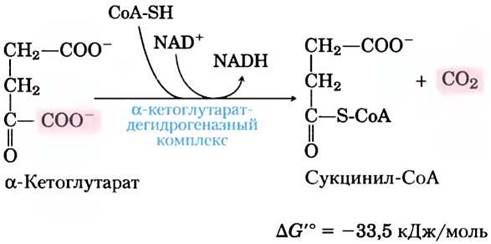
(4) Окисление а-кетоглутарата до сукцинил-СоА и СO2. Следующая стадия вновь представляет собой реакцию окислительного декарбоксилирования, где α-кетоглутарат превращается в сукцинил-СоА и СO2 под действием α-кетоглутарат-дегидрогеназного комплекса.NAD+ выступает в качестве акцептора электронов, а СоА — переносчика сукцинильной группы. Энергия от окисления α-кетоглутарата запасается в тиоэфирной связи в молекуле сукцинил-СоА:
Эта реакция практически идентична реакции, которую мы уже обсуждали выше — реакции, катализируемой пируватдегидрогеназным комплексом, причем α-кетоглутаратдегидрогеназный комплекс очень напоминает ПДГ-комплекс как по строению, так и по функции. Данный комплекс содержит три фермента, гомологичные E1, Е2 и Е3 в ПДГ-комплексе, а также связанный с ферментом ТРР, связанный липоат, FAD, NAD и кофермент А. Можно совершенно определенно сказать, что оба комплекса произошли от общего эволюционного предшественника. Хотя в составе E1 обоих комплексов имеются сходные структуры, их аминокислотные последовательности различаются и, конечно же, они обладают разной субстратной специфичностью: фермент Е1 ПДГ-комплекса связывает пируват, a E1 а-кетоглутаратдегидрогеназного комплекса связывает α-кетоглутарат. В составе Е2 обоих комплексов также очень похожего, причем в обоих комплексах содержатся ковалентно связанные липоильные группы. Ферменты Е3 этих двух комплексов идентичны.
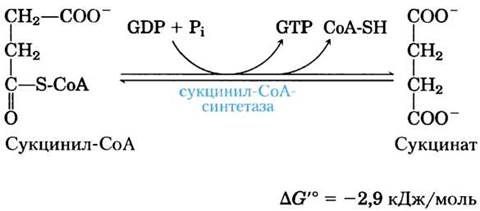
(5) Превращение сукцинил-СоА в сукцинат. В сукцинил-СоА, как в ацетил-СоА, имеется тиоэфирная связь, характеризующаяся большой отрицательной величиной стандартной свободной энергии гидролиза (∆G′° ≈ -36 кДж/моль). На следующей стадии цикла лимонной кислоты происходит гидролиз этой связи, а высвобождающаяся при этом энергия направляется на синтез фосфоангидридной связи в молекуле GTP или АТР, причем в сумме ∆G'° составляет всего -2,9 кДж/моль. В результате данной реакции образуется сукцинат:
Фермент, катализирующий это превращение, называется сукцинил-СоА-синтетазой, или сукцинилтиокиназой; оба названия указывают на участие в реакции нуклеозидтрифосфата (доп. 16-2).
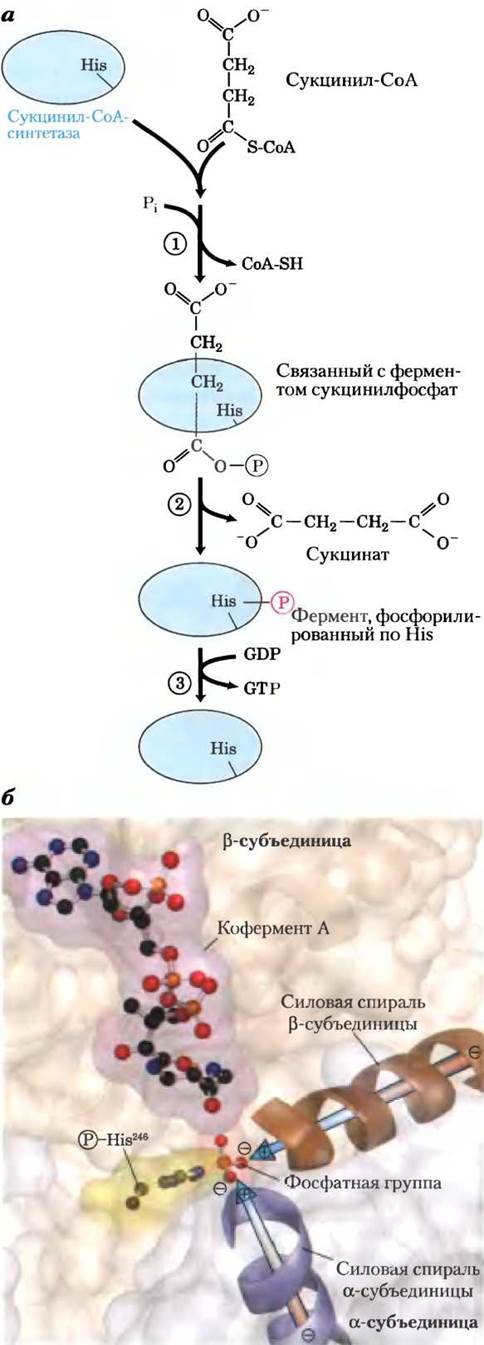
Рис. 16-12. Реакция, катализируемая сукцинил-СоА- синтетазой. а — на стадии (1) фосфорильная группа замещает СоА в связанной с ферментом молекуле сукцинил- СоА, в результате чего образуется богатый энергией ацилфосфат. На стадии (2) сукцинилфосфат передает свою фосфатную группу на остаток His в молекуле фермента, и при этом образуется богатое энергией промежуточное соединение — фосфорилированный фермент. На стадии (3) фосфатная группа переносится с остатка His к концевой фосфатной группе GDP (или ADP), что приводит к образованию GTP (или АТР). б — сукцинил-СоА-синтетаза Е. coli (по PDB ID 1SCU). Активный центр построен из элементов как а- (сиреневая), так и β- (коричневая) субъединиц. Частичные положительные заряды силовых спиралей (сиреневая и коричневая) расположены вблизи фосфатной группы на остатке His246 в α-цепи, что стабилизирует данное промежуточное соединение. Кофермент А показан в виде стержневой структуры (красный цвет). У ферментов бактерий и млекопитающих сходные аминокислотные последовательности и трехмерные структуры.
Дополнение 16-2. Синтазы и синтетазы, лигазы и лиазы, киназы, фосфатазы и фосфорилазы. Да такие названия кого угодно могут сбить с толку!
Цитратсинтаза — это лишь один из многочисленных ферментов, катализирующих реакции конденсации, продукты которых имеют более сложное химическое строение, чем исходные вещества. Синтазы катализируют реакции конденсации, которые не требуют участия нуклеозидтрифосфатов (АТР, GTP и др.) в качестве источника энергии. Синтетазы, напротив, катализируют реакции конденсации, в которых энергию обязательно поставляет АТР или другой нуклеозидтрифосфат. Пример такого фермента — сукцинил-СоА-синтетаза. Лигазы (от лат. ligare — соединять) катализируют реакции конденсации, в которых два атома соединяются друг с другом, используя энергию АТР или другого источника, т. е. синтетазы — частный случай лигаз. Например, ДНК- лигаза зашивает разрывы в молекулах ДНК, используя при этом энергию АТР или NAD4. Этот фермент широко используется в генетической инженерии для соединения фрагментов ДНК. Лигазы не следует путать с лиазами, которые катализируют расщепление (обратная реакция — присоединение), сопровождающееся переносом электронов. Пируватдегидрогеназный комплекс, который окисляет пируват с отщеплением молекулы СО2, относится к большому классу лиаз.
Киназами называют ферменты, которые переносят фосфорильную группу от нуклеозидтрифосфата (например, АТР) на акцепторную молекулу — сахар (гексокиназа и глюкокиназа), белок (киназа гликогенфосфорилазы), другой нуклеотид (нуклеозиддифосфаткиназа) или интермедиат метаболизма, такой как оксалоацетат (ФЕП-карбоксикиназа). Реакции, катализируемые киназами, называют реакциями фосфорилирования. Напротив, фосфоролиз — это реакция замещения, в которой фосфатная группа осуществляет атаку и ковалентно связывается по месту разрыва связи. Такие реакции катализируются фосфорилазами. Например, гликогенфосфорилаза катализирует фосфоролиз гликогена, в результате чего образуется глюкозо-1-фосфат. Дефосфорилирование — удаление фосфорильной группы из эфира
фосфорной кислоты — катализируется фосфатазами; в качестве атакующего агента при этом выступает вода. Фруктозобисфосфатаза-1 превращает фруктозо-1,6- бисфосфат в фруктозо-6-фосфат в процессе глюконеогенеза, а фосфатаза фосфорилазы а удаляет фосфатную группу от фосфосерина в фосфорилированной гликогенфосфорилаза. Вот так!
К сожалению, классы ферментов перекрываются, и многие ферменты имеют два или несколько названий. Например, сукцинил-СоА-синтетазу иначе называют сукцинилтиокиназой; данный фермент выступает синтетазой в цикле лимонной кислоты и киназой при осуществлении синтеза сукцинил-СоА. Все это только увеличивает путаницу с названиями. Например, фермент мог быть открыт в исследовании, при котором А превращалось в В, и получил свое название в соответствии с этим процессом. Однако позднее могло оказаться, что в клетке этот фермент в основном осуществляет превращение В в А. Часто в подобных случаях первое название продолжает использоваться, хотя метаболическую функцию фермента лучше описывает название, соответствующее обратной реакции. Пример подобной ситуации — гликолитический фермент пируваткиназа (с. 79). Начинающего изучать биохимию подобная путаница может сбить с толку. Международные организации прилагали титанические усилия для создания единой номенклатуры ферментов (см. табл. 6-3, т. 1), но некоторые систематические названия оказались слишком длинными и неуклюжими, так что их нечасто используют в биохимическом сообществе.
В данной книге мы старались приводить названия ферментов, которые приняты в биохимической практике, но при этом указывать случаи, когда фермент имеет несколько широко распространенных названий. Для ознакомления с действующей номенклатурой ферментов можно обратиться к рекомендациям Комитета по номенклатуре Международного союза по биохимии и молекулярной биологии (IUВМВ; www.chem.qmw.ac.uk/ iumbmb/nomenclature/).
У данной энергозапасающей реакции есть промежуточная стадия, на которой происходит фосфорилирование самого фермента по остатку His в активном центре (рис. 16-2, а). Именно эта богатая энергией фосфатная группа переносится на ADP (или GDP) с образованием АТР (или GTP). В животных клетках существуют два изофермента сукцинил-СоА-синтетазы, один из которых специфичен к ADP, а другой — к GDP. Фермент состоит из двух субъединиц: а (Мг 32 000) с фосфорилированным остатком His (His246) и центром связывания СоА и β (Мr 42 000), который определяет специфичность к ADP или GDP. Активный центр фермента расположен между двумя субъединицами. Исследование кристаллической структуры сукцинил-СоА-синтетазы выявило наличие двух «силовых» спиралей (по одной на каждой субъединице), ориентированных таким образом, что частичный положительный заряд электрических диполей локализован вблизи отрицательно заряженного![]() -His (рис. 16-12, б), что стабилизирует фосфорилированный фермент. Вспомните, что похожую роль играют образуемые спиралями диполи в стабилизации ионов К+ в калиевых каналах (см. рис. 11-48, т. 1).
-His (рис. 16-12, б), что стабилизирует фосфорилированный фермент. Вспомните, что похожую роль играют образуемые спиралями диполи в стабилизации ионов К+ в калиевых каналах (см. рис. 11-48, т. 1).
Образование АТР (или GTP) за счет энергии, высвобождаемой при окислительном декарбоксилировании α-кетоглутарата, представляет собой фосфорилирование на уровне субстрата, с которым мы уже сталкивались при обсуждении синтеза АТР в реакциях гликолиза, катализируемых глицеральдегид-3-фосфатдегидрогеназой и пируваткиназой (см. рис. 14-2). Образующийся при действии сукцинил-СоА-синтетазы GTP способен передавать концевую фосфорильную группу на ADP с образованием АТР; данную обратимую реакцию катализирует нуклеозиддифосфаткиназа (с. 41):
GTP + ADP —> GDP + АТР
∆G'° = 0 кДж/моль
Таким образом, итог действия любого изофермента сукцинил-СоА-синтетазы состоит в сохранении энергии в форме АТР. Реакция, катализируемая нуклеозиддифосфаткиназой, не сопровождается изменением свободной энергии; по количеству запасаемой энергии АТР и GTP эквивалентны.
(6) Окисление сукцината с образованием фумарата. Образовавшийся из сукцинил-СоА сукцинат далее окисляется до фумарата под действием флавопротеина сукцинатдегидрогеназы:
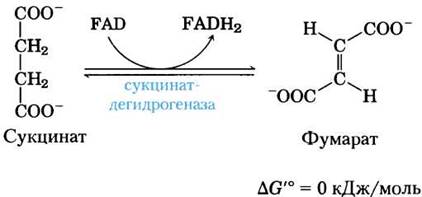
У эукариот сукцинатдегидрогеназа прочно связана с внутренней митохондриальной мембраной, а у прокариот — с плазматической мембраной. Фермент содержит три различных железосерных кластера и одну ковалентно связанную молекулу FAD (см. рис. 19-10). Прежде чем попасть в цепь переноса электронов во внутренней мембране митохондрий (или в плазматической мембране бактерий) электроны от сукцината сначала проходят через FAD и железосерные кластеры. Поток электронов от сукцината через эти структуры к окончательному акцептору электронов молекуле O2 сопряжен с синтезом примерно 1,5 молекул АТР в пересчете на пару электронов (окислительное фосфорилирование в дыхательной цепи). Аналог сукцината малонат, которого обычно в клетке нет, является мощным конкурентным ингибитором сукцинатдегидрогеназы; его добавление к митохондриям блокирует цикл лимонной кислоты.
(7) Гидратация фумарата с образованием малата. Обратимая гидратация фумарата с образованием L-малата катализируется ферментом фумаразой (более точное название — фумаратгидратаза). В переходном состоянии образуется карбанион:
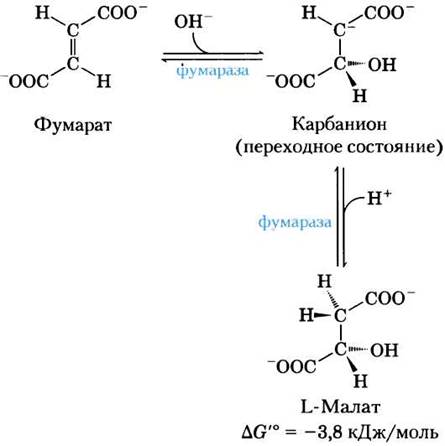
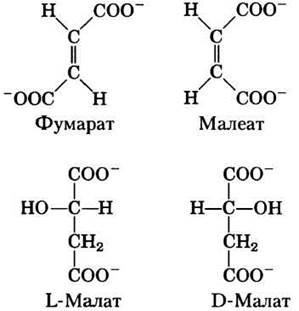
Фумараза обладает высокой стереоспецифичностью. Она катализирует гидратацию только трансформы двойной связи фумарата, но не действует на его цис-изомер (малеат). В обратной реакции фумараза также проявляет стереоспецифичность: D-малат не ее субстрат.
(8) Окисление малата до оксалоацетата. На последней стадии цикла лимонной кислоты NАD- зависимая L-малатдегидрогеназа катализирует окисление L-малата до оксалоацетата:
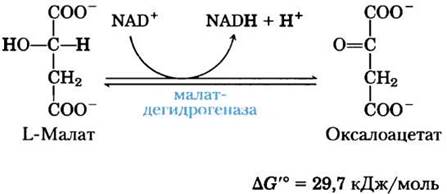
В стандартных термодинамических условиях равновесие этой реакции сильно сдвинуто влево, но в клетке оксалоацетат постоянно удаляется в экзергонической реакции, катализируемой цитратсинтазой (стадия (1) на рис. 16-7). В результате концентрация оксалоацетата в клетке остается очень низкой (<10-6 М), что способствует протеканию малатдегидрогеназной реакции в сторону образования оксалоацетата.
Первые исследования отдельных реакций цикла лимонной кислоты проводились в условиях in vitro на образцах измельченной мышечной ткани, однако весь путь, а также его регуляция активно изучались in vivo. Использование радиоактивно меченных предшественников, таких как [14С] пируват и [14С] ацетат, позволило проследить судьбу отдельных атомов углерода в цикле лимонной кислоты. Некоторые из первых экспериментов с изотопной меткой дали неожиданные результаты и внесли значительные разногласия в представления о цикле и его регуляции. Казалось, что результаты этих экспериментов указывали на то, что первая трикарбоновая кислота, образующаяся в цикле, не цитрат. Некоторые подробности этого периода изучения цикла лимонной кислоты изложены в доп. 16-3. Сегодня поток метаболитов в цикле можно анализировать в живой ткани с помощью 13С-меченных предшественников и ЯМР- спектроскопии целых тканей. Благодаря уникальности ЯМР-сигнала от соединения, содержащего 13С, исследователь может проследить переход атомов углерода из молекулы-предшественника в интермедиаты и продукты цикла. Данный метод значительно продвинул изучение регуляции цикла лимонной кислоты и его связей с другими путями метаболизма, такими как гликолиз.
Дополнение 16-3. Цитрат: симметричная молекула с реакциями асимметричной природы
Когда более полувека назад стали доступны соединения, обогащенные тяжелым изотопом углерода 13С и радиоактивными изотопами 11С и 14С, их сразу стали использовать для того, чтобы проследить путь атомов углерода в цикле лимонной кислоты. С одного из таких экспериментов началась дискуссия о роли лимонной кислоты. Меченный по карбоксильной группе ацетат ([1-14С- ацетат) инкубировали с образцом животной ткани в аэробных условиях. В животных тканях ацетат ферментативным путем превращается в ацетил-СоА, поэтому в реакциях цикла можно было проследить путь меченого атома углерода ацетогруппы. После инкубации из препарата ткани выделили α-кетоглутарат, который затем подвергли химическому разложению для того, чтобы определить положение изотопа углерода.
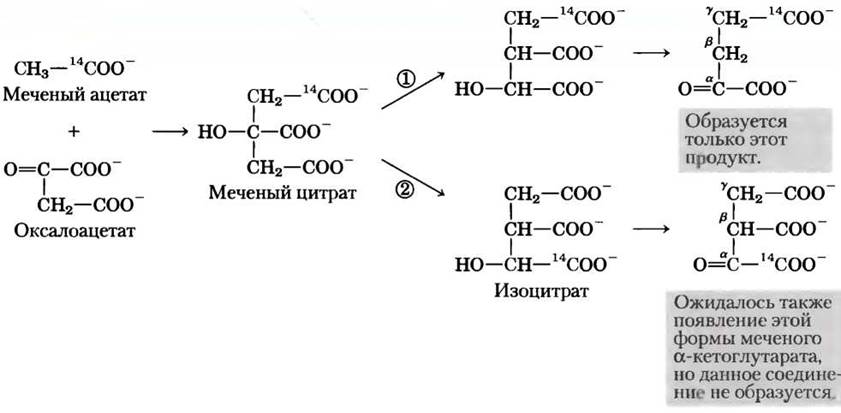
Можно было ожидать, что при конденсации немеченого оксалоацетата с меченным по карбоксильной группе ацетатом образуется цитрат, содержащий метку в одной из двух первичных карбоксильных групп. Цитрат — симметричная молекула с двумя химически неразличимыми карбоксильными группами на концах. Следовательно, предполагалось, что половина молекул цитрата превратится в α-кетоглутарат, меченный по α-карбоксильной группе, а вторая половина — в α-кетоглутарат, меченный по y-карбоксильной группе, т. е. образуется смесь двух молекул, меченных по разным положениям (рис. 1, пути (1) и (2)). Однако выделенный из образца ткани α-кетоглутарат содержал метку 14С только в y-карбоксильной группе (рис. 1, путь (1)). Отсюда был сделан вывод, что цитрат (или любая другая симметричная молекула) не может быть интермедиатом в процессе превращения ацетата в а-кетоглутарат, но первым продуктом, образующимся при конденсации ацетата и оксалоацетата, должна быть асимметричная трикарбоновая кислота, например, цис-аконитат или изоцитрат.
Рис. 1. Включение углеродной метки (14С) из ацетогруппы в α-кетоглутарат в цикле лимонной кислоты. Атомы углерода исходной ацетогруппы выделены красным цветом.
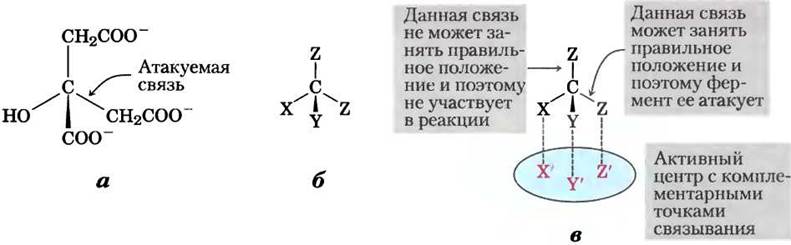
Однако в 1948 г. Александер Огстон показал, что, хотя цитрат не имеет хирального центра (см. рис. 1-19), он может реагировать асимметричным образом, если у фермента, с которым он взаимодействует, асимметричное строение активного центра. Огстон предположил, что активный центр аконитазы имеет три участка связывания цитрата, а цитрат специфическим образом должен связываться с этими тремя участками одновременно. Как показано на рис. 2, связывание цитрата с этими тремя точками может осуществляться единственным способом, что объясняет образование лишь одного типа меченого α-кетоглутарата. Подобные цитрату органические молекулы, не имеющие хирального центра, но способные реагировать асимметричным образом с асимметричным активным центром фермента, получили название прохиральных молекул.
Рис. 2. Лимонная кислота — пример прохирального соединения, а — структура цитрата; б — схема молекулы цитрата: X = -ОН, Y = -СОО-, Z = -СН2СОО-. в — комплементарность цитрата центру связывания на молекуле аконитазы. Возможен лишь один вариант, при котором специфические группы цитрата соответствуют трем участкам в центре связывания. В результате лишь одна из двух групп -СН2СОО- связывается с аконитазой.
Выделяющаяся в цикле лимонной кислоты энергия эффективно сохраняется
Итак, мы проследили цикл лимонной кислоты целиком (рис. 16-13). Ацетильная группа, состоящая из двух атомов углерода, вступила в цикл, взаимодействуя с оксалоацетатом. Два атома углерода высвободились из цикла в виде СО2 при окислении изоцитрата и α-кетоглутарата. Энергия от этого окисления сохранилась в результате восстановления трех молекул NAD+ и одной молекулы FAD, а также образования одной молекулы АТР или GTP. Молекула оксалоацетата регенерировалась в конце цикла. Обратите внимание, что два атома углерода, покидающие цикл в виде СО2, — это не атомы углерода из входящей в цикл ацетильной группы. Для выделения этих атомов углерода в виде СО2 цикл должен повториться еще несколько раз (рис. 16-7).
Рис. 16-13. Продукты одного оборота цикла лимонной кислоты. В каждом обороте цикла лимонной кислоты в результате реакций окислительного декарбоксилирования высвобождаются три молекулы NADH, одна FADH2, одна GTP (или АТР) и две СО2. Здесь и на нескольких следующих рисунках все стадии цикла изображены как необратимые, однако следует помнить, что на самом деле большинство реакций обратимы (см. рис. 16-7).
Хотя за один оборот цикла лимонной кислоты непосредственно образуется лишь одна молекула АТР (при превращении сукцинил-СоА в сукцинат), четыре окислительные стадии цикла создают значительный поток электронов в дыхательную цепь через молекулы NADH и FADH2, тем самым способствуя образованию большого числа молекул АТР при окислительном фосфорилировании.
В гл. 14 мы видели, что энергетический выход реакции образования двух молекул пирувата из одной молекулы глюкозы при гликолизе составляет 2 АТР и 2 NADH. При окислительном фосфорилировании (гл. 19) переход двух электронов от NADH на О2 приводит к образованию примерно 2,5 АТР, а переход двух электронов от FADH2 на О2 — примерно 1,5 АТР. Исходя из этого мы можем рассчитать общий выход АТР при полном окислении глюкозы. Окисление двух молекул пирувата до 6СО2 посредством пируватдегидрогеназного комплекса и цикла лимонной кислоты, а также передача электронов на молекулярный кислород в результате окислительного фосфорилирования приводят к образованию 32 молекул АТР из одной молекулы глюкозы (табл. 16-1). Округляя числа, получаем, что это соответствует сохранению энергии в 32 • 30,5 кДж/моль = 976 кДж/моль, или 34% теоретически возможной, т. е. максимальной, энергии при полном окислении глюкозы (≈2840 кДж/моль). В этих расчетах были использованы величины стандартной свободной энергии; если учесть реальную ситуацию — свободную энергию для синтеза АТР в клетке (см. пример 13-2, с. 31), расчет приведет к эффективности процесса, близкой 65%.
Таблица 16-1. Стехиометрия восстановления коферментов и образования АТР при аэробном окислении глюкозы через гликолиз, действие пируватдегидрогеназного комплекса, цикл лимонной кислоты и окислительное фосфорилирование
Реакция |
Число образующихся молекул АТР или восстановленных коферментов |
Число образующихся в итоге молеку АТР* |
Глюкоза —> глюкозо-6-фосфат |
-1 АТР |
-1 |
Фруктозо-6-фосфат —> фруктозо-1,6-бисфосфат |
-1 АТР |
-1 |
2 Глицеральдегид-3-фосфат —> 2 1,3-дифосфоглицерат |
2 NADH |
3 или 5** |
2 1,3-Дифосфоглицерат —> 2 3-фосфоглицерат |
2 АТР |
2 |
2 Фосфоенолпируват —> 2 пируват |
2 АТР |
2 |
2 Пируват —> 2 ацетил-СоА |
2 NADH |
5 |
2 Изоцитрат —> 2 α-кетоглутарат |
2 NADH |
5 |
2 α-Кетоглутарат —> 2 сукцинил-СоА |
2 NADH |
5 |
2 Сукцинил-СоА —> 2 сукцинат |
2 АТР (или 2 GTP) |
2 |
2 Сукцинат —> 2 фумарат |
2 FADH2 |
3 |
2 Малат —> 2 оксалоацетат |
2 NADH |
5 |
Всего |
30-32 |
* Из расчета 2,5 АТР на NADH и 1,5 АТР на FADH2; отрицательное число указывает на расход АТР.
** В зависимости от механизма передачи эквивалентов NADH из цитозоля в матрикс митохондрий; см. рис. 19-30 и 19-31.
Почему окисление ацетата осуществляется так сложно?
Восьмистадийный процесс окисления простой двухуглеродной ацетогруппы до СО2 может показаться неоправданно сложным и противоречащим биологическому принципу максимальной экономии. Однако роль цикла лимонной кислоты не сводится к окислению ацетата. Этот путь является одним из центральных моментов в промежуточном метаболизме. Четырех- и пятиуглеродные конечные продукты многих катаболических путей поступают в цикл в качестве топливных молекул. Например, оксалоацетат и α-кетоглутарат образуются при разложении белков из аспарагиновой и глутаминовой кислот соответственно. При некоторых метаболических условиях интермедиаты покидают цикл и используются в качестве предшественников для биосинтеза многих других веществ.
Подобно всем другим путям метаболизма, цикл лимонной кислоты — «продукт» эволюции, значительный период которой происходил до появления аэробных организмов. Это вовсе не кратчайший путь от ацетата к СО2, но он оказался наиболее выгодным при эволюционном отборе. Вполне вероятно, что первые анаэробы использовали некоторые реакции цикла лимонной кислоты в линейном биосинтетическом процессе. Действительно, некоторые ныне существующие анаэробные организмы используют неполный цикл лимонной кислоты не для получения энергии, а для производства предшественников в различных путях биосинтеза (рис. 16-14). В этих организмах в результате трех первых реакций цикла образуется α-кетоглутарат, но поскольку у них отсутствует α-кетоглутаратдегидрогеназа, они не могут осуществлять полностью весь цикл. У этих организмов есть четыре фермента, катализирующие обратимое превращение оксалоацетата в сукцинил-СоА, и они могут производить малат, фумарат, сукцинат и сукцинил-СоА из оксалоацетата в последовательности реакций, развивающихся в обратном направлении по сравнению
с «нормальным» (окислительным) процессом. Такой путь метаболизма — брожение, при котором NАDH, образующийся в результате окисления изоцитрата, вновь превращается в NАD+ при восстановлении оксалоацетата до сукцината.
Рис. 16-14. Метаболические предшественники, образующиеся в неполном цикле лимонной кислоты у анаэробных бактерий. Эти анаэробные организмы не имеют α-кетоглутаратдегидрогеназы и поэтому не способны осуществлять полный цикл лимонной кислоты. α-Кетоглутарат и сукцинил-СоА являются предшественниками в различных путях биосинтеза. («Нормальная» последовательность реакций данного цикла изображена на рис. 16-13.)
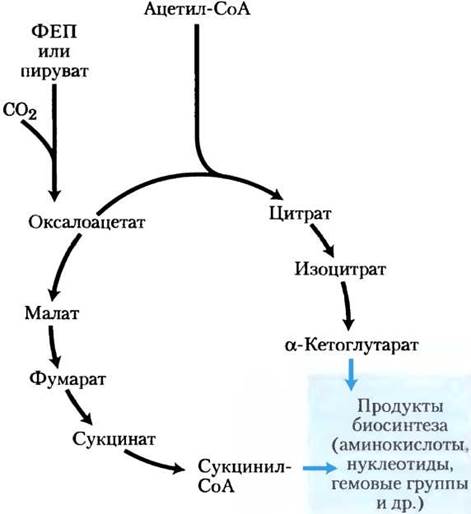
С появлением цианобактерий, образующих O2 из воды, земная атмосфера превратилась в аэробную, а организмы были вынуждены развивать аэробный метаболизм, который, как мы показали, гораздо более эффективен, чем анаэробное брожение.
Компоненты цикла лимонной кислоты — важные интермедиаты биосинтеза
У аэробных организмов цикл лимонной кислоты является одним из амфиболических путей, т. е. он задействован как в процессах катаболизма, так и в процессах анаболизма. Кроме участия в окислительном катаболизме углеводов, жирных кислот и аминокислот, цикл лимонной кислоты поставляет исходные молекулы для многих путей биосинтеза (рис. 16-15) с помощью реакций, которые служили для той же цели у анаэробных предков. Например, α-кетоглутарат и оксалоацетат превращаются в аспартат и глутамат путем простого трансаминирования (гл. 22). Через эти две аминокислоты атомы углерода из α-кетоглутарата и оксалоацетата далее служат для построения других аминокислот, а также пуриновых и пиримидиновых оснований. Оксалоацетат превращается в глюкозу в процессе глюконеогенеза (см. рис. 15-11). Сукцинил-СоА выступает центральным интермедиатом в синтезе порфиринового кольца гемовой группы, принимающей участие в переносе кислорода (в гемоглобине и миоглобине) и электронов (в цитохромах) (см. рис. 22-23). А цитрат, образуемый некоторыми организмами, используют в различных коммерческих целях (доп. 16-4).
Рис. 16-15. Роль цикла лимонной кислоты в процессах анаболизма. Интермедиаты цикла лимонной кислоты выходят из цикла и служат предшественниками при биосинтезе различных веществ. Красным цветом выделены четыре анаплеротические реакции, восполняющие израсходованные интермедиаты цикла (см. табл. 16-2).
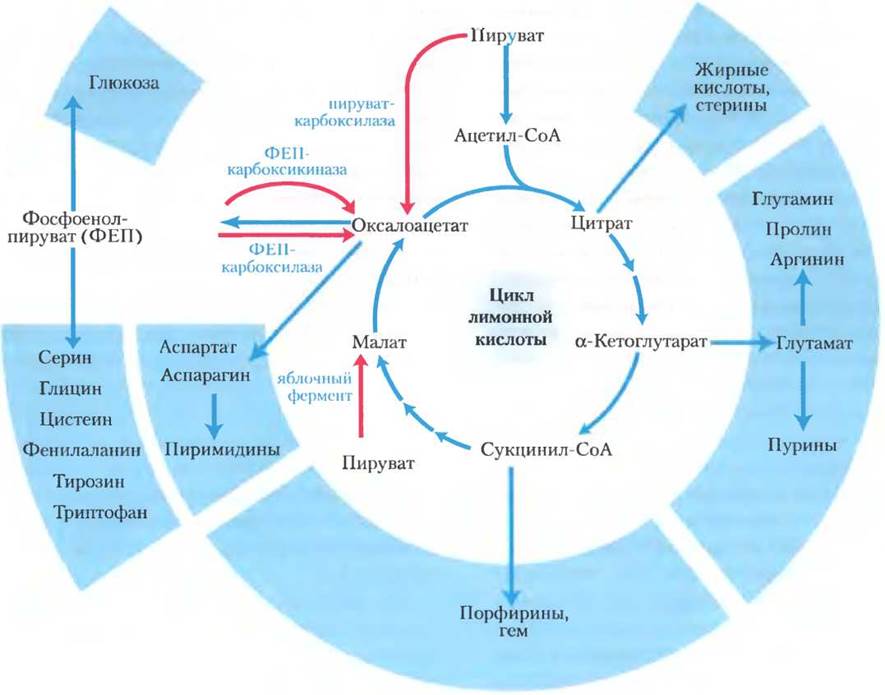
Анаплеротические реакции служат для восполнения затрат интермедиатов цикла лимонной кислоты
Поскольку интермедиаты цикла лимонной кислоты расходуются в качестве предшественников в биосинтезе, их необходимо постоянно восполнять, для чего служат анаплеротические реакции (рис. 16-15; табл. 16-2). В обычных условиях существует равновесие между реакциями, по которым интермедиаты покидают цикл лимонной кислоты и по которым они восполняются, так что концентрация интермедиатов остается практически неизменной.
Таблица 16-2. Анаплеротические реакции

В табл. 16-2 представлены наиболее распространенные анаплеротические реакции, все они превращают пируват или фосфоенолпируват в оксалат или малат в различных тканях и организмах. Наиболее важная анаплеротическая реакция в печени и почках млекопитающих — обратимое карбоксилирование пирувата до оксалоацетата, катализируемое пируваткарбоксилазой. При недостатке оксалоацетата или другого интермедиата цикла лимонной кислоты декарбоксилирование пирувата приводит к образованию дополнительного оксалоацетата. Ферментативное присоединение карбоксильной группы к пирувату происходит с затратой энергии, поставляемой в форме АТР; свободная энергия, необходимая для осуществления этой реакции, приблизительно равна свободной энергии, которую дает АТР.
Дополнение 16-4. Цитратсинтаза, газированные напитки и запасы продовольствия
Цитрат довольно широко используют в коммерческих целях. Если обратить внимание на состав большинства выпускаемых промышленностью безалкогольных напитков, можно обнаружить там лимонную кислоту, которую добавляют для придания кисловатого фруктового вкуса. Лимонная кислота применяется как пластификатор и ингибитор пенообразования в производстве некоторых сортов резины, для закрепления красителей, а также как антиоксидант для сохранения вкуса пищевых продуктов. В промышленных условиях источником лимонной кислоты служит гриб Aspergillus niger, выращенный на недорогом сахаросодержащем сырье, чаще всего на мелассе. Условия культивирования подбирают таким образом, чтобы предотвратить протекание реакций цикла лимонной кислоты и способствовать накоплению цитрата.
Если подойти к вопросу о цикле лимонной кислоты глубже, лимонная кислота может однажды быть очень полезной для предотвращения голода на нашей планете. Дело в том, что благодаря трем отрицательно заряженным карбоксильным группам цитрат является хорошим хелатирующим агентом, активно связывающим ионы металлов. Некоторые растения используют это свойство, выделяя цитрат в почву, где он связывает ионы металлов и предотвращает их всасывание растением. Особую роль играет связывание ионов алюминия Аl3+, которые токсичны для многих растений и на 30-40% снижают урожайность всех возделываемых земель. По распространенности в земной коре алюминий занимает первое место среди всех металлов, причем в основном он присутствует в виде биологически инертных соединений (таких как Аl(ОН)3). Однако на почвах с pH <5 ионы алюминия переходят в растворимую форму и могут поглощаться корнями растений. Кислые почвы и токсичное влияние Аl3+ чаще встречаются в тропических зонах, где по этой причине урожайность кукурузы может быть меньше на 80%! В Мексике из-за наличия алюминия в почве площади под папайей были сокращены до 20 000 га при общей площади сельскохозяйственных земель 3 млн га. Одно из возможных решений в этом случае — повышение pH почвы путем известкования, но это не лучший выход как с экономической, так и с природоохранной точек зрения. Другой путь — выведение устойчивых к алюминию сортов растений. В природе существуют виды, на которые не действует закисление почвы и присутствие там алюминия, и это может послужить основой для третьего способа решения проблемы — передачи необходимой устойчивости культурным сортам с помощью методов генетической инженерии.
Группа мексиканских исследователей вывела генетически модифицированные сорта табака и папайи, вырабатывающих повышенный уровень бактериальной цитратсинтазы. Эти растения секретируют в 5-6 раз больше лимонной кислоты, чем обычные растения, и поэтому могут расти на почве с уровнем Аl3+, в десятки раз превышающим соответствующие показатели для выживания контрольных растений. При таком уровне устойчивости в Мексике можно выращивать папайю на 3 млн га, которые в настоящее время не используются из-за высокого содержания Аl3+.
По прогнозам, численность населения Земли в следующие 50 лет может увеличиться до 9,6 млрд человек, что ставит перед цивилизацией задачу увеличения производства пищевых продуктов более чем в 3 раза. Долгосрочное решение этой проблемы может включать в себя повышение плодородия пахотных земель с высоким содержанием алюминия, причем важную роль здесь может сыграть лимонная кислота.
Пируваткарбоксилаза — регуляторный фермент и практически неактивна без своего аллостерического активатора, ацетил-СоА. Если ацетил- СоА (топливная молекула в цикле лимонной кислоты) присутствует в избытке, происходит стимуляция пируваткарбоксилазной реакции и образуется больше оксалоацетата, что позволяет расходовать большее количество ацетил-СоА в реакции цикла, катализируемой цитратсинтазой.
Другие анаплеротические реакции (табл. 16-2) также подвержены регуляции, цель которой состоит в поддержании достаточно высокого уровня интермедиатов, необходимого для осуществления цикла лимонной кислоты. Так, ФЕП-карбоксилаза активируется в присутствии интермедиата гликолиза фруктозо-1,6-бисфосфата, который накапливается при слишком медленном продвижении цикла лимонной кислоты, когда образующийся в результате гликолиза пируват не успевает перерабатываться.
Биотин в составе пируваткарбоксилазы переносит группы СО2
Реакция, катализируемая пируваткарбоксилазой, требует наличия биотина — простетической группы этого фермента (рис. 16-16). Витамин биотин играет очень важную роль во многих реакциях карбоксилирования. Это специализированный переносчик одноуглеродных групп в их наиболее окисленной форме — в форме СО2. Перенос одноуглеродных групп в более восстановленной форме осуществляют другие кофакторы, такие как тетрагидрофолат и S-аденозилметионин (гл. 18). Активация карбоксильных групп происходит при расщеплении АТР и присоединении СО2 к связанному с ферментом биотину. Затем этот «активированный» СО2 передается на молекулу акцептора (в данном случае на пируват) в реакции карбоксилирования.
Рис. 16-16. Механизм реакции. Участие биотина в реакции, катализируемой пируваткарбоксилазой. Биотин прикрепляется к ферменту амидной связью через α-аминогруппу остатка Lys, образуя биотинилированный фермент. Опосредованные биотином реакции карбоксилирования обычно протекают в две стадии в двух разных активных центрах фермента, как показано на примере пируваткарбоксилазной реакции. На первой стадии (реакции (1)-(3)) гидрокарбонат превращается в активированный СО2 и используется для карбоксилирования биотина. Биотин переносит СО2 между двумя активными центрами фермента (реакция (4)). На второй стадии (реакции (5)-(7)), происходящей в другом активном центре фермента, СО2 реагирует с пируватом с образованием оксалоацетата.
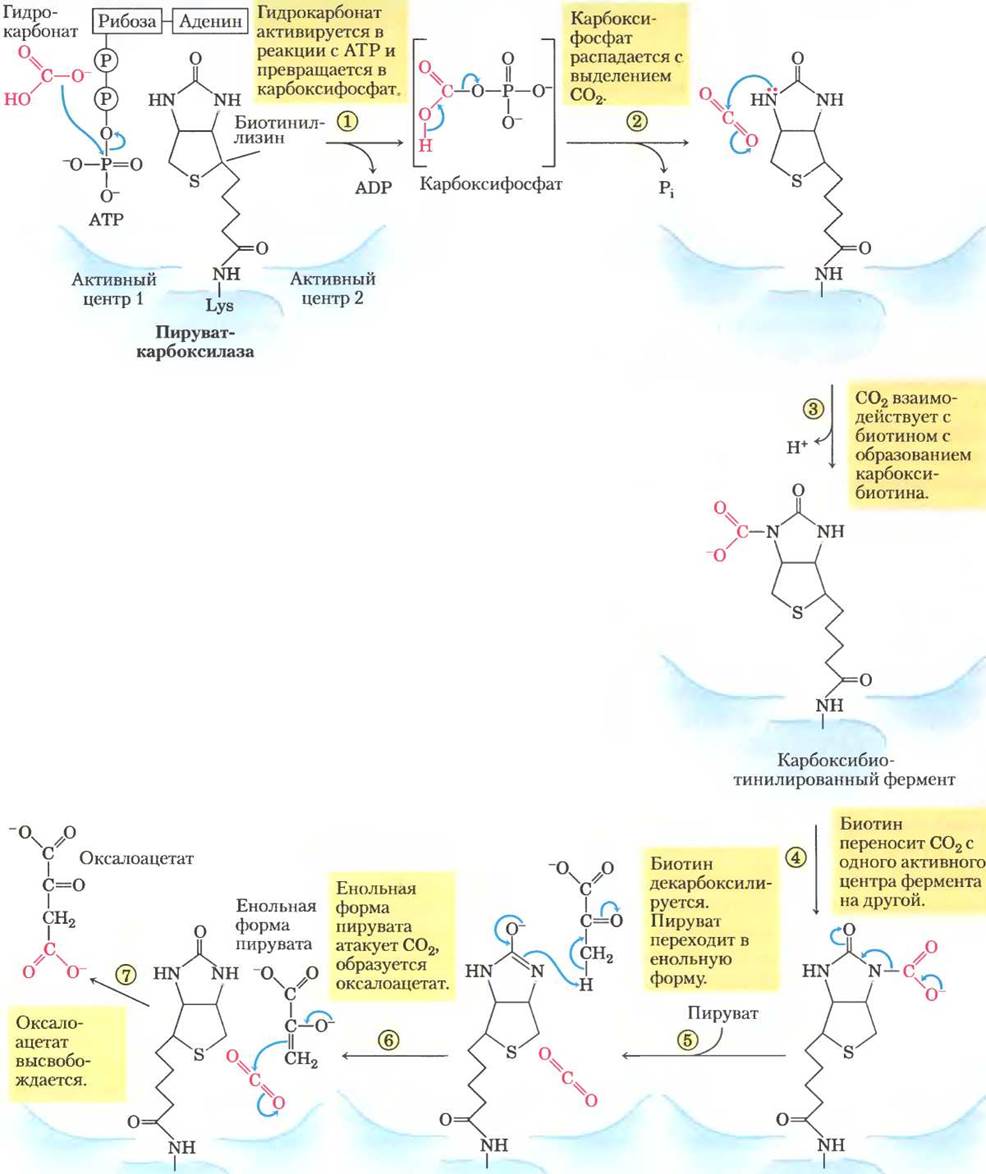
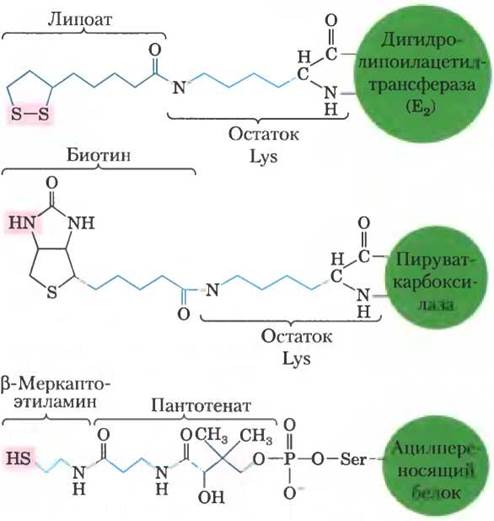
Пируваткарбоксилаза состоит из четырех идентичных субъединиц, каждая из которых содержит ковалентно связанный биотин, присоединенный амидной связью к ε-аминогруппе специфического остатка лизина в активном центре фермента. Карбоксилирование пирувата происходит в две стадии (рис. 16-16): сначала карбоксигруппа, поставляемая НСОз, связывается с биотином, а затем переносится на пируват с образованием оксалоацетата. Эти две стадии протекают в разных активных центрах. Длинное гибкое «плечо» биотина переносит активированную карбоксильную группу от первого активного центра ко второму, действуя примерно так же, как липоиллизиновое «плечо» фермента Е2 в пируватдегидрогеназном комплексе (рис. 16-6) и длинное «плечо» СоА-подобного фрагмента в ацилпереносящем белке, участвующем в синтезе жирных кислот (см. рис. 21-5). Перечисленные структуры схематично представлены на рис. 16-17. Липоат, биотин и пантотенат проникают в клетку с помощью одного и того же переносчика; все они в аналогичных реакциях ковалентно связываются с белками, а также все они служат гибким «плечом», способствующим переносу интермедиатов из одного активного центра в другой без их диссоциации из ферментного комплекса, т. е. принимают участие в туннелировании субстрата.
Рис. 16-17. Строение гибких «плеч», образованных липоатом, биотином и пантотенатом. Кофакторы липоат, биотин и β-меркаптоэтиламинпантотенат образуют
длинные гибкие «плечи», присоединяясь к ферменту ковалентной связью. По этим «плечам» интермедиаты перемещаются от одного активного центра к другому. Розовым выделены группы, с которыми связывается активированный интермедиат.
Биотин необходим человеку для жизни; большое количество биотина содержится во многих продуктах, кроме того, он синтезируется микрофлорой кишечника. Дефицит биотина встречается редко, но иногда может быть вызван употреблением в пищу большого количества сырых яиц. Яичный белок содержит много белка авидина (Мr 70 000), который прочно связывает биотин и предотвращает его всасывание в кишечнике. Наличие авидина в яичном белке, возможно, защищает куриный эмбрион от бактериального заражения. При тепловой обработке яиц авидин, как и все другие белки, денатурирует и, следовательно, инактивируется. Очищенный авидин широко применяют в качестве реагента в биохимии и клеточной биологии. Белок, содержащий ковалентно связанный биотин (как искусственно сконструированный, так и образую
щийся in vivo), можно выделить с помощью аффинной хроматографии (см. рис. 3-17, в), пользуясь высоким сродством биотина к авидину. Связавшийся на колонке белок смывают избытком свободного биотина. Высокое сродство биотина к авидину также используют в лабораторной практике для создания «молекулярного клея», способного удерживать вместе две структуры (см. рис. 19-28).
Краткое содержание раздела 16.2 Реакции цикла лимонной кислоты
■ Цикл лимонной кислоты (цикл Кребса или цикл трикарбоновых кислот) является практически универсальным центральным путем катаболизма, в котором вещества, образующиеся при расщеплении углеводов, жиров и белков, окисляются до СO2, а большая часть энергии этого окисления сохраняется в переносчиках электронов FADH2и NADH. При аэробном метаболизме электроны от этих переносчиков передаются на O2, а энергия от переноса электронов запасается в форме АТР.
■ Ацетил-Со А поступает в цикл лимонной кислоты (в митохондриях у эукариот или в цитозоле у прокариот), по мере того как фермент цитратсинтаза катализирует его конденсацию с оксалоацетатом, в результате которой образуется цитрат.
■ В семи последующих реакциях, в том числе в двух реакциях декарбоксилирования, цитрат превращается в оксалоацетат и выделяются две молекулы СO2. Данный путь метаболизма замкнут, т. е. интермедиаты цикла не расходуются: на каждую затраченную в цикле молекулу оксалоацетата образуется одна новая.
■ Выигрыш энергии в пересчете на каждую окисленную молекулу ацетил-СоА составляет три молекулы NADH, одна молекула FADH2и одна молекула нуклеозидтрифосфата (АТР или GТР).
■ В цикле лимонной кислоты может окисляться не только ацетил-СоА, но любое соединение, превращающееся в четырех- или пятиуглеродный интермедиат, например продукты распада многих аминокислот.
■ Цикл лимонной кислоты амфиболическии, он задействован как в путях катаболизма, так и анаболизма. Интермедиаты цикла могут расходоваться в качестве исходных веществ в биосинтезе множества различных продуктов.
■ Поскольку интермедиаты цикла расходуются в других путях биосинтеза, их приходится восполнять в нескольких анаплеротических реакциях, где четырехуглеродные интермедиаты цикла образуются при карбоксилировании трехуглеродных соединений. Эти реакции катализируют ферменты пируват- карбоксилаза, ФЕП-карбоксикиназа, ФЕП- карбоксилаза и малат-фермент (яблочный фермент). Ферменты, катализирующие карбоксилирование, часто используют биотин для активации и переноса СO2 на молекулы пирувата или фосфоенолпирувата.