ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
19. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ И ФОТОФОСФОРИЛИРОВАНИЕ
19.8. Основной фотохимический процесс — это индуцированный светом перенос электронов
Индуцированный светом перенос электронов в хлоропластах растений осуществляется поли- ферментной системой, встроенной в мембрану тилакоидов. Как показали результаты изучения строения и функций хлоропластов растений, различных бактерий и водорослей, фотосинтез осуществляется по сложным механизмам и выяснение этих механизмов составляет одну из фундаментальных проблем биохимии. Значительный вклад в понимание молекулярных механизмов фотосинтеза внесло изучение структуры фотосинтезирующих комплексов в бактериях методом рентгеноструктурного анализа.
У бактерий присутствует один из двух типов фотохимических реакционных центров
Важные данные о процессах фотосинтеза у бактерий были получены Луи Дюйзенсом. В 1952 г. он провел ряд экспериментов по облучению фотосинтезирующих мембран пурпурной бактерии Rhodospirillum rubrum пульсирующим светом с длиной волны 870 нм и наблюдал временное снижение интенсивности поглощения в этой области, т. е. обесцвечивание (выцветание) клеток под действием световой волны 870 нм.
Несколько лет спустя Бессел Кок и Хорст Витт наблюдали обесцвечивание пигментов в хлоропластах растений при освещении их светом с длинами волн 680 и 700 нм. Поскольку такой же эффект наблюдался без освещения, но при добавлении к суспензии мембран фотосинтезирующих клеток сильного, но небиологического акцептора электронов феррицианида [Fe(CN)6]3-, обесцвечивание пигментов стали связывать с потерей электрона фотохимическим реакционным центром. В соответствии с длинами волн, вызывающими обесцвечивание, пигменты стали обозначать как Р870, Р680 и Р700.
Фотохимическая реакционная система у фотосинтезирующих бактерий относительно простая и включает один из двух главных типов реакционных центров. У пурпурных бактерий есть реакционный центр, от которого возбужденные электроны через переносчик электронов феофитин (хлорофилл, не содержащий ион Mg2+) поступают к хинону. У зеленых серных бактерий электроны переносятся через хинон к железосерному белку. У цианобактерий и растений присутствуют две фотосистемы ФСI и ФСII (по одной каждого типа), они выполняют разные функции, но взаимодействуют между собой.
Биохимическими и биофизическими методами подробно изучен молекулярный механизм процессов, протекающих в фотохимических реакционных системах бактерий, которые являются прототипом более сложных протонпреобразующих систем у высших растений.
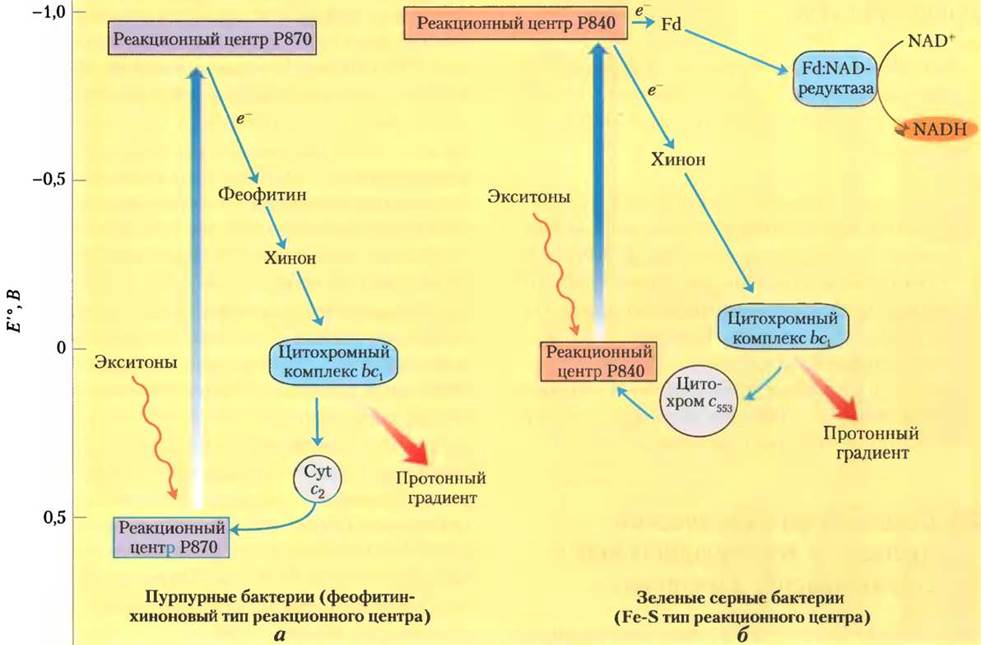
Фотохимическая реакционная система типа II — феофитин-хиноновая система. Фотосинтезирующий ансамбль пурпурных бактерий включает три основных компонента (рис. 19-54, а): реакционный центр, содержащий пигмент Р870, переносчик электронов — цитохромный комплекс bс1 близкий по строению к комплексу III в митохондриальной цепи переноса электронов, и комплекс ATP-синтазу, аналогичный АТР-синтазному комплексу в дыхательной цепи митохондрий. При освещении фотосинтезирующих клеток выброшенные из реакционного центра электроны поступают через феофитин и хинон к цитохром- ному комплексу bc1 и затем вновь возвращаются в реакционный центр через цитохром с2 на прежнюю энергетическую орбиталь. Индуцированный светом поток электронов в такого рода цепи, так называемый циклический поток, высвобождает энергию для перекачивания протонов из среды в тилакоид с помощью цитохромного комплекса bс1, в результате чего возникает трансмембранный градиент Н+. При возврате ионов Н+наружу через ATP-синтазу происходит синтез АТР, так же как в митохондриях.
Рис. 19-54. Функциональные ансамбли, участвующие в фотосинтетическом преобразовании световой энергии у пурпурных и зеленых серных бактерий, а — у пурпурных бактерий электроны, выброшенные под действием энергии света реакционным центром Р870, проходят через переносчики электронов феофитин, хинон и цитохромный комплекс bс1 и вновь возвращаются в реакционный центр через цитохром с2. При прохождении электронов через комплекс bс1 происходит перекачивание протонов внутрь тилакоида, в результате чего создается электрохимический потенциал, поставляющий энергию для синтеза АТР. б — у зеленых серных бактерий есть два пути движения электронов, выброшенных из реакционного центра Р840 под действием световой энергии. Во-первых, циклический путь, по которому электроны из реакционного центра проходят через хинон к цитохромному комплексу bс1 и возвращаются в реакционный центр через цитохром с2. Во-вторых, нециклический путь, когда возбужденные электроны движутся от реакционного центра через железосерный белок, ферредоксин и флавопротеин ферредоксин-NAD-редуктазу к NAD+.
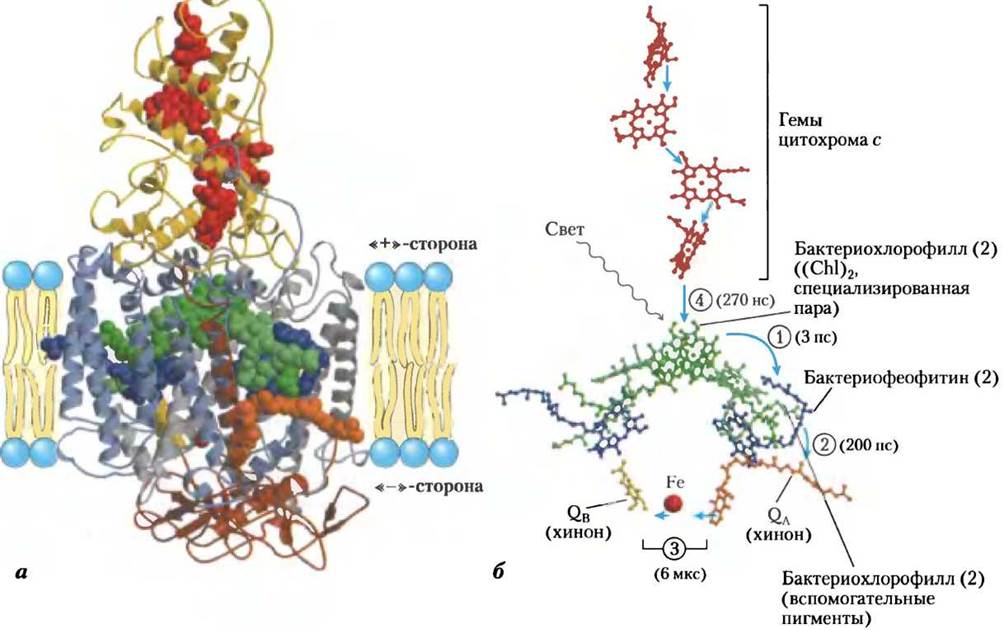
Данные рентгеноструктурного анализа о трехмерном строении реакционных центров пурпурных бактерий (Rhodopseudomonas viridis и Rhodobacter sphaeroides) позволили предложить молекулярный механизм фотохимических процессов в феофитин-хиноновой системе. Реакционный центр бактерии Rhodopseudomonas viridis представляет собой крупный белковый комплекс, включающий четыре полипептидные субъединицы и 13 кофакторов, в которые входят две пары молекул бактериохлорофилла, пара молекул феофитина, две молекулы хинона, негеминовый железосодержащий белок и четыре гема, связанные с цитохромом с (рис. 19-55, а).
На основе изучения последовательности стадий очень быстрого переноса электронов (рис. 19-55, б) было установлено, что способностью превращать световую энергию в химическую в реакционных центрах бактерий обладает так называемая «специализированная пара» молекул бактериохлорофилла. Ее обычно обозначают (Сhl)2, именно она служит начальной точкой фотохимического акта. Световая энергия, поглощенная одной из многих антенных молекул хлорофилла, окружающих реакционный центр, передается в виде экситона специализированной паре молекул бактериохлорофилла, электронные орбитали которых сильно перекрываются, и переводит ее в возбужденное состояние. В результате окислительно-восстановительный потенциал (Сhl)2 изменяется на величину энергии поглощенного фотона. Пара (Сhl)2 становится сильным восстановителем и теряет один электрон, который проходит через соседние молекулы хлорофилла к феофитину Pheo. При получении электрона феофитином образуются два радикала — положительно заряженная пара молекул хлорофилла и отрицательно заряженный радикал феофитина:
(Сhl)2 + 1 экситон —> (Сhl)2* (стадия возбуждения (Сhl)2)
(Сhl)2* + Pheo —> (Сhl)2 + •Pheo- (стадия разделения зарядов)
Рис. 19-55. Фотореакционная система пурпурной бактерии Rhodopseudomonas viridis (PDB ID 1 PRG), a — система включает четыре компонента: три субъединицы Н, М, L(окрашенные на рисунке в коричневый, синий и серый цвета соответственно), 11 сегментов спиралей которых пронизывают насквозь мембрану тилакоидов, и белковый комплекс цитохром с (желтый), встроенный в поверхность тилакоидной мембраны. Субъединицы L и М спарены с трансмембранными белками и образуют цилиндрическую структуру с осью второго порядка. Здесь, как и на схеме (б), также изображены простетические группы, участвующие в фотохимических процессах. Субъединицы L и М связаны с двумя парами молекул бактериохлорофилла (зеленые). Одна из этих двух пар — «специализированная пара» (Сhl)2 — реакционный центр, в котором после поглощения световой энергии начинается фотохимический акт. В систему входят также две молекулы феофитина (голубые), менахинон QA и убихинон QB (оранжевый и желтый соответственно), расположенные приблизительно симметрично между двумя молекулами хинона. Вверху изображены четыре гемовые группы (красные), связанные с цитохромом с. Фотореакционная система бактерии Rhodobacter sphaeroides включает те же самые функциональные блоки, что и система Rhodopseudomonas viridis, за исключением цитохрома с. б — стадии процесса фотосинтеза в фотореакционных системах бактерий Rhodopseudomonas viridis и Rhodobacter sphaeroides после возбуждения специализированной пары молекул бактериохлорофилла. Все компоненты системы окрашены в те же цвета, что на схеме (а). В скобках указано время, необходимое для передвижения электронов по этому участку. (1) Возбужденная специализированная пара молекул бактериохлорофилла передает электрон феофитину. (2) От феофитина электрон быстро передвигается к прочно связанной с феофитином молекуле менахинона QA. (3) Молекула QА передает электроны в более медленном темпе негеминовому железу и затем диффундирующей молекуле убихинона QB. (4) «Электронная дырка» в специализированной паре хлорофиллов заполняется электронами, поступившими от гема, связанного с цитохромом с.
Электрон от радикала •Pheo- затем передается прочно связанной с ним молекуле хинона QA, превращая его в радикал семихинона. Радикал семихинона в свою очередь передает приобретенный электрон молекуле хинона QB, слабо связанной с феофитином. При присоединении двух электронов хинон QB восстанавливается до гидрохинона QBH2, который покидает реакционный центр и диффундирует в бислой мембраны. Уравнение этой реакции имеет следующий вид:
2 •Pheo- + 2 Н+ + QB —> 2 Pheo + QBH2 (восстановление хинона)
Молекула гидрохинона QBH2, в химических связях которой заключена часть энергии фотонов, возбудивших реакционный центр Р870, проходит через пул растворенного в мембране восстановленного гидрохинона QH2 и движется через липидную фазу бислоя к цитохромному комплексу bс1.
Цитохромный комплекс bс1 пурпурных бактерий, подобно комплексу III в дыхательной цепи митохондрий, переносит электроны от донора — молекулы хинона QH2 — к акцептору электронов, а высвобождающаяся при этом энергия используется для перекачивания протонов через мембрану, в результате чего возникает протон-движущая сила. Путь электронов через комплекс bс1 напоминает путь электронов через комплекс III в дыхательной цепи митохондрий, включенной в Q-цикл (см. рис. 19-12), в результате которого создается трансмембранный градиент pH. Конечным акцептором электронов в клетках пурпурных бактерий является потерявший электрон реакционный центр Р870, иначе говоря, •(Сhl)2+ (рис. 19-54, о). Электроны, выброшенные реакционным центром Р870, движутся от цитохромного комплекса bс1 через цитохром с2 — водорастворимую форму цитохрома с1 — снова к реакционному центру. Таким образом, при освещении пурпурных бактерий электроны совершают циклические переходы — покидают реакционный центр фотосистемы и вновь возвращаются в него на прежние невозмущенные орбитали, в результате чего реакционный центр переходит в восстановленное состояние и способен снова поглощать экситон от антенных молекул хлорофилла.
Следует отметить, что все химические реакции в этой фотохимической системе протекают между твердыми частицами, расположенными близко друг к другу и ориентированными определенным образом, что обеспечивает большую скорость и эффективность реакций.
Фотохимическая реакционная система типа I — реакционная Fe-S-система. У зеленых серных бактерий, кроме функциональных ансамблей, характерных для пурпурных бактерий, в фотосинтезе участвуют дополнительные ферментные комплексы (рис. 19-54, б) и пути переноса электронов. Во-первых, у зеленых серных бактерий существует циклический поток, когда выброшенные из реакционного центра электроны присоединяются первым переносчиком электронов хиноном Q, а затем переходят к цитохромному комплексу bс1. Этот процесс сопровождается транспортом протонов через мембрану тилакоидов и возникновением протон-движущей силы, поставляющей энергию для синтеза АТР, как это происходит у пурпурных бактерий и в дышащих митохондриях. Во-вторых, у них кроме циклического потока существует еще поток электронов другого типа, также индуцируемый светом, — нециклический. В нециклическом потоке часть выброшенных из реакционного центра электронов движется к железосерному белку ферредоксину, а затем через флавопротеин ферредоксин-NAD- редуктазу к NAD+, восстанавливая последний до NADH, — таким образом, электроны все время движутся в одном направлении. Электроны, ушедшие из реакционного центра на восстановление NAD+, заменяются электронами, полученными при окислении H2S до элементной серы, а затем до SO2-4, т. е. в реакциях, характерных для фотосинтеза зеленых серных бактерий. Процесс окисления H2S бактериями сходен с процессом окисления Н2O растениями-продуцентами кислорода.
Кинетические и термодинамические факторы, препятствующие потере энергии
Сложное строение фотореакционных систем — результат эволюционного отбора наиболее эффективных фотосинтезирующих молекулярных структур. Специализированная пара молекул хлорофилла, поглотившая фотон, находится в высокоэнергетическом, возбужденном состоянии (Сhl)2*, которое, в принципе, крайне неустойчиво. «Высокоэнергетические» электроны могут очень быстро (в течение 10 пикосекунд; 1 пс = 10-12 с) возвратиться в основное состояние, высвобождая энергию поглощенного фотона в виде тепла (кинетическая энергия молекул). Однако реакционные фотоцентры имеют молекулярную структуру, препятствующую неэффективному использованию поглощенной энергии света на внутренние превращения. Белковые молекулы реакционной системы закрепляют молекулы бактериохлорофилла, бактериофитина и хинонов в мембране тилакоидов и удерживают их в определенном положении по отношению друг к другу, в результате чего фотохимические реакции фактически протекают в частицах, находящихся в твердой фазе. Причина высокой эффективности и быстроты протекающих фотохимических реакций — отсутствие столкновений или беспорядочной диффузии частиц в фотосистеме. Передача экситона от антенного хлорофилла специализированной паре хлорофиллов в реакционном центре происходит менее чем за 100 пс с эффективностью выше 90%. В течение 3 пс после возбуждения реакционного центра Р870 молекула феофитина получает электрон и превращается в радикал с отрицательным зарядом. Менее чем за 200 пс электрон достигает молекулы хинона QB (рис. 19-55, б). Реакции фотосинтетического переноса электронов не только имеют большую скорость, но их направление согласуется с законами термодинамики, т. е. электроны движутся «вниз» от мощного восстановителя к мощному окислителю. Действительно, специализированная пара хлорофиллов в возбужденном состоянии (Сhl)2* является очень хорошим донором электронов (Е'° = -1 В) и электроны от нее движутся к акцептору, с менее отрицательным значением стандартного восстановительного потенциала Е'°. Изменение стандартной свободной энергии в процессе фотосинтеза — большая отрицательная величина. Как было показано в гл. 13, изменение стандартной свободной энергии можно рассчитать по формуле ∆G'° = -nАЕ'°, где ∆Е'° — разность стандартных потенциалов восстановления двух полуреакций:
(1) (Сhl)2* —> (Сhl)2+ + е- Е'° = -1 В
(2) Q + 2H+ + 2e- —> QH2 Е'° = -0,045 В
Тогда
∆Е'° = -0,045 В - (-1,0 В) ≈ 0,95 В
∆G'° = -2 (96,5 кДж/B • моль)(0,95 В) = -180 кДж/моль
Высокая скорость реакций и их соответствие законам термодинамики делают процессы фотосинтеза необратимыми и высокоэффективными. Общий энергетический выход реакции фотосинтеза, т. е. доля поглощенной энергии фотонов, конвертированной в QH2, составляет более 30% с учетом энергии, рассеянной в виде тепла и энтропии.
У растений две реакционные фотосистемы взаимодействуют между собой
У современных цианобактерий, водорослей и сосудистых растений более сложный фотосинтезирующий аппарат, чем у фотосинтезирующих бактерий, у которых есть только один тип фотохимической реакционной системы. Накопленный фактический материал позволяет сделать вывод, что фотосинтезирующие системы сложных клеток, по-видимому, являются комбинацией двух простых бактериальных фотосистем, работающих взаимосогласованно и составляющих единую последовательность рабочих звеньев. В тила- коидных мембранах хлоропластов присутствуют два типа фотохимических систем, каждая со своим собственным ансамблем светопоглощающих пигментов (антенных молекул) и реакционным центром для захвата энергии. Каждая система имеет свои основные и дополнительные функции (рис. 19-56). Фотосистема II (ФС II), так называемая феофитин-хиноновая система, аналогична единственной фотосистеме пурпурных бактерий; она включает примерно одинаковые количества молекул хлорофилла а и b. Реакционный центр фотосистемы II содержит пигмент Р680, при возбуждении которого электроны выводятся из систем через цитохромный комплекс b6f, что сопряжено с переносом протонов через тилакоидную мембрану. Фотосистема I (ФС I) по строению и функциям аналогична фотосинтезирующей системе типа I у зеленых серных бактерий. Фотосистема I характеризуется высоким соотношением между количеством хлорофилла а и хлорофилла b и имеет в реакционном центре пигмент Р700, способный захватывать экситоны с последующей передачей электрона через железо-серный белок ферредоксин к NADP+, переводя его в восстановленное состояние NADPH. У шпината в тилакоидных мембранах одного хлоропласта имеются сотни фотосистем того и другого типа.
Рис. 19-56. Совместное действие фотосистем I и II в хлоропластах. Зигзагообразная схема (Z-схема) показывает путь потока электронов от Н2O к NADР+ (внизу справа) в нециклическом фотосинтезе растений. Вертикальная шкала слева отражает энергетические взаимоотношения. Для того чтобы электроны, происходящие из молекулы Н2O, оказались на энергетическом уровне, на котором они смогут восстановить NADР+ в NADPH, каждый из них должен быть дважды «подброшен вверх» (толстые голубые стрелки) фотонами, поглощенными фотосистемой I и фотосистемой II. В каждой фотосистеме на один «подброшенный вверх» электрон расходуется один квант, или фотон. После каждого из таких «подбрасываний» электроны с избыточной энергией устремляются «вниз» (маленькие синие стрелки) по цепи переносчиков. Движение электронов в цепи, соединяющей фотосистему II с фотосистемой I, в которую включен цитохромный комплекс b6f, сопряжено с возникновением протонного градиента, поставляющего энергию для фотофосфорилирования. Прерывистая черная стрелка указывает путь электронов в циклическом потоке электронов (см. в след, разд.), в котором участвует только фотосистема I; электроны возвращаются по обходному пути к фотосистеме I вместо того, чтобы восстанавливать NADР+ в NАDРН.
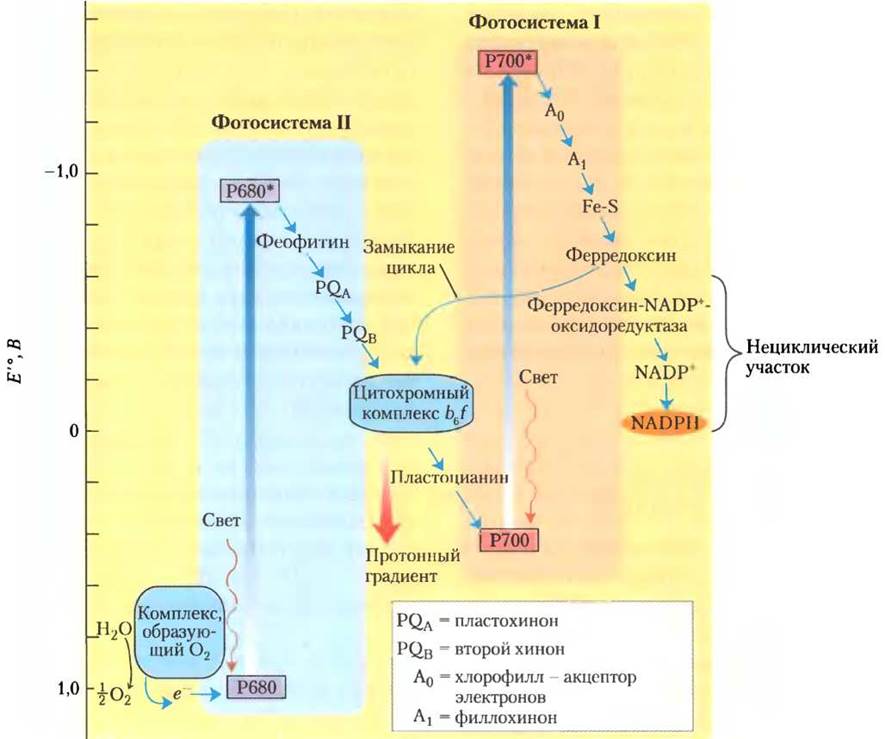
У растений фотосистемы I и II функционируют совместно в реакциях фотосинтеза, от которых зависит движение электронов от Н2O к NADP+ (рис. 19-56). Перенос электронов между двумя фотосистемами осуществляется водорастворимым белком пластоцианином (одноэлектронным переносчиком); по своим свойствам он аналогичен цитохрому с в митохондриях. «Дырки» от электронов, ушедших из системы ФС II к NADP+, у цианобактерий и растений, выделяющих кислород, заполняются электронами, поступающими от Н2O при окислении. В отличие от фотосинтеза у пурпурных и зеленых серных бактерий, окисляющих H2S и не выделяющих кислород, такой процесс называется оксигенным фотосинтезом. Во всех фотосинтезирующих клетках, выделяющих кислород, т. е. в клетках высших растений, водорослей и цианобактерий, содержатся обе фотосистемы I и II. У фотосинтезирующих бактерий, не выделяющих кислород, есть только одна фотосистема. На рис. 19-56 приведена схема, которую из-за ее зигзагообразной формы часто называют Z-схемой. Она позволяет проследить поток электронов между фотосистемами I и II, а также энергетические взаимоотношения этих двух фотосистем в световых реакциях. Таким образом, Z-схема описывает весь путь, по которому электроны переходят от Н2O к NADP+ согласно уравнению:
2 Н2O + 2 NADP+ + 8 фотонов —> O2 + 2 NADPH + 2 Н+
На каждый электрон, переходящий от Н2O к NADP+, поглощаются два кванта света, по одному на каждую фотосистему. Для образования одной молекулы O2 от Н2O к NADP+должны быть переданы четыре электрона, т. е. должно быть поглощено восемь квантов — по четыре на каждую фотосистему.
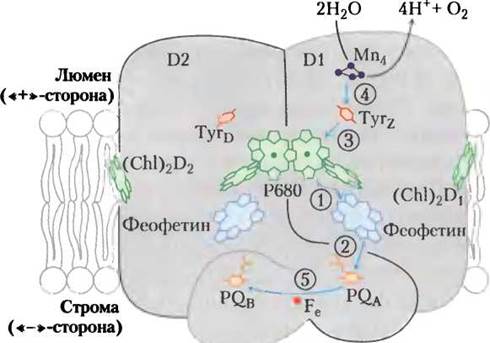
У растений и бактерий молекулярные механизмы световых фотохимических реакций в фотосистемах I и II в основном аналогичны. Однако есть и некоторые различия. Фотосистема II бактерий включает два небольших почти одинаковых белковых ансамбля D1 и D2, образующих почти симметричный димерный комплекс, содержащий всеэлектронпереносящие кофакторы (рис.19-57). Поглощение световой энергии реакционным центром Р680 в фотосистеме II переводит пигмент Р680 в возбужденное состояние Р680*, в котором он легко теряет электроны. Поступающие от возбужденного реакционного центра электроны переносятся за несколько пикосекунд к феофетину, преобразуя его в •Pheo-. При потере электрона Р680* переходит в катион-радикал Р680+. ’Pheo- очень быстро передает электрон связанному с белком пластохинону PQA, или QA. Восстановленная форма пластохинона PQA в свою очередь передает электроны пластохинону другого типа PQB, или QB, не связанному с белком. После получения двух электронов от PQA и двух протонов от молекул воды пластохинон PQB переходит в полностью восстановленную хинольную форму PQBH2. Уравнение этой индуцируемой светом реакции в фотосистеме II можно записать следующим образом:
4 Р680 + 4 Н+ + 2 PQB + 4 фотона —> 4 Р680+ + 2 PQBH2 (19-12)
Рис. 19-57. Строение фотосистемы II у цианобактерии Synechococcus elongates. Мономер представленного на схеме комплекса включает два главных белка D1 и D2, пронизывающих тилакоидную мембрану и содержащих набор кофакторов. Хотя обе субъединицы D1 и D2 почти симметричны, электроны переносятся только через одну из субъединиц — D1 (справа). Стрелками показан путь электронов от ионного кластера Мn4 (окрашен в красный цвет), расщепляющего воду на ионы Н+ и кислород, к хинону PQB(оранжевый). Последовательность фотохимических событий, происходящих в фотосистеме II, обозначена цифрами в кружочках. Расположение кофакторов совпадает с положением фотореакционных центров бактерий на рис. 19-55. Функции остатка Туr в фотосинтезе цианобактерий рассматриваются в последующих разделах.
В итоге, восстановленная форма пластохинона PQBH2 передает электроны цитохромному комплексу b6f, который препятствует фотосинтезу АТР (рис. 19-56). «Дырки» в реакционном центре Р680 фотосистемы II заполняются электронами, отщепляемыми от воды в процессе ее окисления, что обсуждается в следующих разделах. Фотофосфорилирование у растений можно разобщить с переносом электронов при помощи любых гербицидов, способных присоединяться к пластохинону и блокировать передачу электронов через цитохромный комплекс b6f, что приводит к гибели растения.
Аналогичным образом в фотосистеме I под действием квантов света реакционный центр Р700 переходит в возбужденное состояние Р700* и легко отдает электрон акцептору А0(полагают, что это особая форма хлорофилла), функции которого сходны с функциями феофитина в фотосистеме II. В результате этого процесса образуется A0- и «дырка» Р700+ (рис. 19-56, справа), т. е. энергия света вызывает разделение зарядов в фотохимическом реакционном центре. Молекула пигмента после потери электрона (Р700+) становится очень сильным окислителем и очень быстро присоединяет электрон от пластоцианина — растворимого медьсодержащего голубого белка, который служит непосредственным донором электронов для «дырок» в реакционном центре Р700 фотосистемы I. А0- — исключительно сильный восстановитель; он переносит свой электрон по цепи переноса электронов к NADP+. Первым переносчиком в цепи переноса электронов от А0- к NADP+ является филлохинонA1. Второй переносчик электронов — железосерный белок с тремя FeS- центрами. Третий — другой железосерный белок ферредоксинFd; у шпината Fd связан с тилакоидной мембраной. Молекулярная масса ферредоксина, полученного в кристаллическом виде из листьев шпината, около 10 700; его молекула содержит 2Fe-2S-центpa (рис. 19-5), которые вступают в окислительно-восстановительные реакции с переносом одного электрона. Роль четвертого переносчика электронов играет флавопротеин ферредоксин-NADР-оксиредуктаза. Этот фермент переносит электроны от восстановленного ферредоксина (Fdred) к NADP+, восстанавливая последний в NADPH.
2 (Fdred) + 2 Н+ + NADP+ —> 2 (Fdox) + NADPH + Н+
Этот фермент по своим функциям и строению аналогичен ферредоксин-NАD-редуктазе зеленых серных бактерий (рис. 19-54, б).
Антенные молекулы хлорофиллов образуют с переносчиками электронов функциональные комплексы
Кристаллографическими методами была установлена структура надмолекулярных ансамблей фотосистемы I, включающих переносящие электроны кофакторы, светопоглощающие комплексы, а также связанные с ними липиды (рис. 19-58, а). Белковые агрегаты таких систем содержат три идентичных комплекса, состоящих из 11 различных белков (рис. 19-58, б). Несколько сотен антенных молекул хлорофиллов и каротиноидов ориентированы определенным образом по отношению к реакционному центру (рис. 19-58, в). Кофакторы реакционного центра, осуществляющие перенос электронов, прочно связаны с антенными молекулами. В таких системах поглощенный одной из антенных молекул экситон быстро мигрирует по пигментным молекулам к реакционному центру. В отличие от фотосистемы II, в которой движение электронов происходит по одной ветви, индуцированный светом поток электронов в ФС I проходит через обе ветви переносчиков электронов.
Рис. 19-58. Надмолекулярный комплекс, образованный фотосистемой I и антенными молекулами хлорофиллов, а — белки и кофакторы в функциональной единице фотосистемы I. Огромное число антенных молекул хлорофиллов окружают реакционный центр и передают ему энергию поглощенных квантов (движение экситона показано красными стрелками), в результате чего пара молекул хлорофиллов в ансамбле Р700 переходит в возбужденное состояние и передает электрон через две соседние молекулы хлорофиллов к филлохинону QК, называемому также Восстановленный филлохинон QК вновь окисляется и его молекулы в обеих ветвях одновременно передают по одному электрону (всего два электрона) железо-серному белку Fх, расположенному на отрицательно заряженной стороне тилакоидной мембраны. От железосерного белка Fхэлектроны переносятся еще через два FеS-центра (FА и Fв) и попадают на железосерный белок ферредоксин, расположенный в строме. Ферредоксин в свою очередь направляет энергию к NADР+ (не показан), восстанавливая его до высокоэнергетического соединения NАDРН, в форме которого хлоропласта запасают энергию поглощенных фотонов. б — трехмерное строение фотосистемы I (РDВ ID 1JBO). Вид со стороны освещенной части тилакоидной мембраны, в перпендикулярном к ней направлении. В виде спиралей серого цвета изображены субъединицы белка. Расположение кофакторов показано на схеме (в), в — мономер функциональной единицы фотосистемы. Взаимное расположение антенных и принадлежащих реакционному центру молекул хлорофиллов (окрашены в зеленый цвет) с ионами Мg2+ в центре (темно-зеленые), а также каротиноидов (желтые) и FеS-центров (красные и оранжевые шарики), включенных в реакционный центр. Белковые комплексы, удерживающие хлорофиллы и каротиноиды в определенном положении, расположены оптимально для эффективной передачи экситонов в фотосистеме.
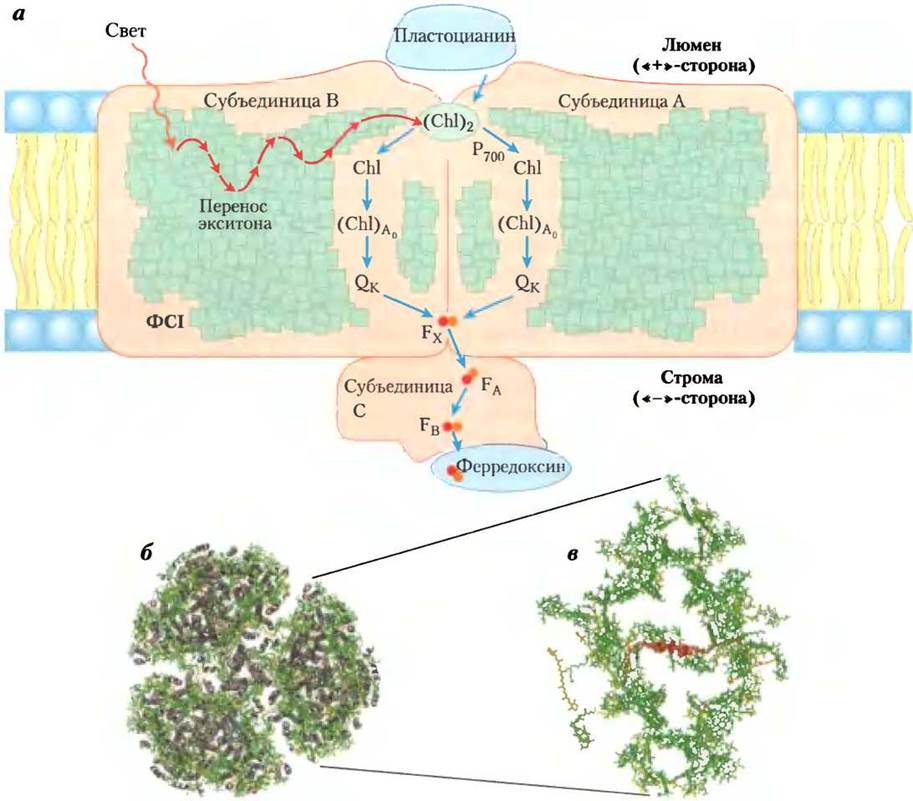
Цитохромный комплекс b6f связывает фотосистемы I и II
Электроны, вышедшие из реакционного центра Р680 в ФСII при возбуждении, на некоторое время задерживаются в пластохиноле и переносятся на реакционный центр Р700 в ФСI через цитохромный комплекс b6f и затем через водорастворимый белок пластоцианин (рис. 19-56, в центре). Цитохромный комплексе b6f — аналог митохондриального комплекса III (рис. 19-59) и включает цитохром b с двумя гемовыми группами (обозначаются как bH и bL), железосерный белок Риске (Мr = 20 000) и цитохром / (от лат. from — листья). В комплексе b6f электроны движутся от восстановленной формы пластохинона PQH2 к цитохрому f, затем к пластоцианину и, наконец, к реакционному центру Р700 в фотосистеме I, восстанавливая его.
Рис. 19-59. Путь электронов и протонов через цитохромный комплекс b6f, а — расположение кофакторов, участвующих в переносе электронов, в кристаллической структуре комплекса b6f (РDВ ID 1UМ3). Кроме гемовых групп цитохрома b — bH и bL (или b«-» и b«+» из-за их близости к отрицательно и положительно заряженным сторонам бислоя тилакоидных мембран) комплекс b6f содержит вблизи гема bH еще один гем — так называемый гем х — и β-каротин, о функции которого пока ничего не известно. Пластохинон включает два центра связывания электронов: РQН2 вблизи положительно заряженной стороны бислоя и РQ — вблизи отрицательно заряженной стороны. FеS-центры белка Риске находятся с внешней стороны положительно заряженной стороны люмена, гем цитохрома/расположен в белковом домене и встроен в люмен тилакоидной мембраны. б — в гомодимерном комплексе b6f находятся поры, по которым пластохинон может передвигаться между двумя центрами, принимая в них окисленную (РQ) или восстановленную (РQН2) форму. Аналогичные процессы протекают в митохондриальном комплексе III (см. рис. 19-12). в — окисление образовавшегося в ФСII пластохинона РQН2 цитохромным комплексом b6f и последующее восстановление РQ протекает по циклической схеме, аналогичной О-циклам в цитохромном комплексе bс1 митохондрий (см. рис. 19-11). Один из отщепленных от РQН2 электронов проходит через FеS-центр белка Риске (красного цвета), другой — через гем bL цитохрома b6 (зеленый). В результате такого процесса электроны поступают от РQН2 к водорастворимому белку пластоцианину, который переносит их в ФСI.
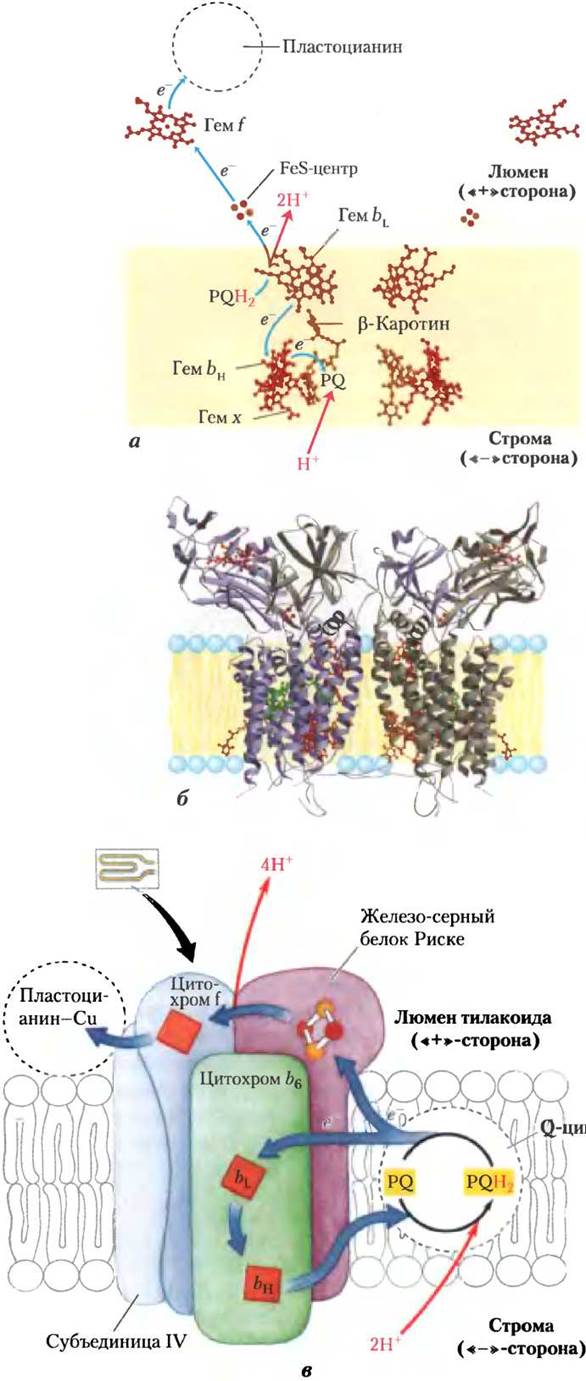
Аналогично митохондриальному комплексу III цитохромный комплекс b6f переносит электроны от восстановленного хинона PQB — подвижного жирорастворимого переносчика двух электронов, напоминающего убихинон Q дыхательной цепи митохондрий, к водорастворимому белку пластоцианину — одноэлектронному переносчику, подобному цитохрому с в митохондриях. В процессе циклического переноса комплексом b6f электроны по одному переходят от PQBH2 к цитохрому b6. Аналогом такого цикла в митохондриях является Q-цикл (рис. 19-12). Фотосинтетический перенос электронов в хлоропластах из ФСII в ФСI вызывает перекачивание протонов через мембрану из наружной (стромальной) среды во внутренний тилакоидный компартмент — по четыре протона на каждую пару перенесенных электронов, в результате чего возникает трансмембранный градиент Н+. Из-за малого объема уплощенных тилакоидных пузырьков в люмене поступление в них относительно небольшого числа протонов вызывает значительное изменение pH люмена. Экспериментально полученное различие значений pH = 8 для стромы и pH = 5 для люмена соответствует 1000-кратной разнице концентраций протонов, что и служит мощной движущей силой синтеза АТР.
Циклический поток электронов между ФСI и цитохромным комплексом б6f увеличивает продукцию АТР по сравнению с NADPH
Поток электронов от ФСII к цитохромному комплексу б6f и далее через ФСI к NADP+ иногда называют нециклическим потоком электронов, чтобы отличить его от циклического потока электронов, которые зависят главным образом от условий освещения. Нециклический поток создает протонный градиент, который расходуется на синтез АТР и NADPH, который используется в биосинтезе. В циклический поток электронов вовлекается только фотосистема I (рис. 19-56), ФСII не участвует. Циклическим этот поток называется потому, что электроны, выброшенные реакционным центром Р700 при освещении ФСI и присоединенные к ферредоксину, не переходят затем к NADP+, а возвращаются через цитохромный комплекс Ь6/к пластоцианину, как это происходит у зеленых серных бактерий (рис. 19-54, б).
Пластоцианин отдает электроны реакционному центру Р700, который их вновь перебрасывает ферредоксину. Таким образом, при освещении ФСI электроны могут совершать циклические переходы — покидать реакционный центр ФСI и вновь возвращаться в него. Энергия, необходимая для проведения одного электрона через такой цикл, обеспечивается поглощением одного кванта света. Циклический поток электронов не сопровождается образованием NADPH и выделением кислорода, однако ему сопутствует фосфорилирование ADP до АТР — так называемое циклическое фотофосфорилирование. Суммарное уравнение для циклического потока электронов и фотофосфорилирования имеет простой вид:
![]()
Нециклический поток электронов, направленный на восстановление NADP+, и циклическое фотофосфорилирование включаются в растительной клетке в зависимости от ее потребности в АТР и NADPH, необходимых для ассимиляции углерода и других биосинтетических процессов. Как показано в гл. 20, для успешной ассимиляции углерода растительная клетка должна быть обеспечена АТР и NADPH в соотношении 3 : 2.
Эта регуляция электронтранспортного пути является частью системы краткосрочной адаптации к изменениям цвета (длины волны) и количества (интенсивности) света, о чем будет сказано ниже.
Перестройка фотосинтетического аппарата изменяет распределение светопоглощающего комплекса II между двумя фотосистемами
Для возбуждения реакционного центра Р700 в фотосистеме I требуется свет с длиной волны 700 нм. Его энергия меньше, чем энергия излучения с длиной волны 680 нм для возбуждения центра Р680 в ФС II, поскольку более коротковолновое излучение несет больше энергии. Если фотосистемы I и II были бы физически связаны между собой, экситоны от антенных молекул системы ФСII поступали бы только на реакционный центр ФСI, возбуждение которого требует меньших затрат энергии. В та-
ком случае реакционный центр ФСII никогда не переходил бы в возбужденное состояние, и функциональная связь обеих фотосистем была бы нарушена. Дисбаланса в обеспечении фотосистем экситонами удается избежать благодаря пространственному разделению двух фотосистем на мембране тилакоидов (рис. 19-60).
Рис. 19-60. Локализация ФСI и ФСII в тилакоидных мембранах, а — строение комплексов и растворимых белков фотосинтетического аппарата сосудистых растений или водорослей. PDB ID для ФСII — 2АХТ; ФСI — 1QZV; цитохром b6f — 2Е74; пластоцианин — 1AG6; ферредоксин — 1А70; ферредоксин:NADР+-редуктаза — 1QG0. Изображенная здесь структура АТР-синтазы составлена из митохондриального фермента из дрожжей (PDB ID 1Q01) и митохондриального фермента из клеток быка (PDB ID 1BMF). б — светопоглощающий комплекс II и АТР-синтаза сосредоточены как в сжатых областях тилакоидных мембран (гранальные тилакоиды, в которых осуществляется контакт нескольких мембран), так и в области тилакоидов стромы (ламелл) и имеют доступ к ADP и NADP+в строме. ФСII присутствует почти исключительно в сжатых областях, а ФСI — почти исключительно в несжатых областях, экспонированных в область стромы. Светопоглощающий комплекс выполняет функцию «клея», удерживающего вместе сжатые области тилакоидных мембран (см. рис. 19-61).
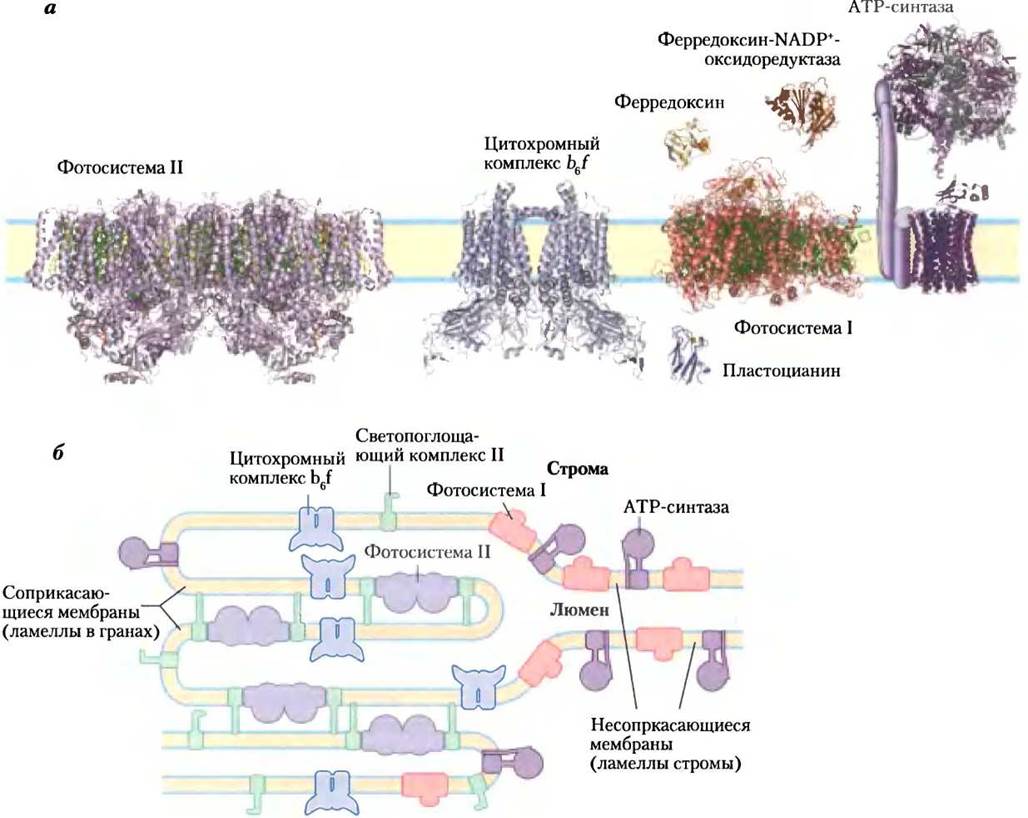
ФСII почти полностью расположена в сильносжатых слоях тилакодных гран (в ламеллах гран). Светопоглощающий комплекс прочно связывает соседние мембраны в гранах. ФСI и ферментный комплекс АТР-синтаза находятся только в свободных, несцепленных слоях тилакоидных мембран (в ламеллах стромы) и могут
использовать в своих молекулярных процессах содержимое стромы, включая соединения АТР и NADP+. Цитохромный комплекс b6f располагается в основном в гранах.
Взаимодействие светопоглощающего комплекса II с ФСI и ФСII зависит от интенсивности и энергии поглощаемого света, который может быстро изменяться, что приводит кперестройкам в хлоропласте. В состоянии 1 остаток Ser светопоглощающего комплекса не фосфорилирован, а сам комплекс сопряжен с ФСII. При освещении растения ярким солнечным светом, в спектре которого обычно преобладает голубая область, ФСII поглощает больше солнечной энергии и восстанавливает пластохинон до пластохинола PQH2быстрее, чем ФСI может его окислить. Накопление PQH2 в свою очередь активизирует протеинкиназу, которая вызывает переход в состояние 2, фосфорилируя остаток Thrв светопоглощающем комплексе II (рис. 19-61). Процессы фосфорилирования ослабляют взаимодействие светопоглощающего комплекса и остальных модулей ФСII, что приводит к частичной диссоциации светопоглощающего комплекса ФСII и перемещению его компонентов в ламеллы стромы. В строме частицы светопоглощающего комплекса II захватывают фотоны для ФСI, ускоряя тем самым процессы окисления РQН2 и уравнивая электронные потоки в фотосистемах I и II. При небольшой интенсивности освещения, например, если растение находится в тени и в поглощенном свете преобладают красные длины волн, процессы окисления РQН2 протекают в ФСI быстрее, чем в ФСII, — в результате увеличивается концентрация РQ, активизирующего процессы дефосфорилирования.
Рис. 19-61. Равновесие электронных потоков в ФСI и ФСII. Гидрофобный домен GGК2 одной тилакоидной мембраны внедряется в другую, в результате чего две мембраны оказываются тесно прижатыми друг к другу (состояние 1). Накопление пластохинола (не показан) стимулирует протеинкиназу, которая фосфорилирует остаток Туr в гидрофобном домене ССК2, что снижает сродство между мембранами и способствует переходу сжатого состояния в несжатое (состояние 2). Специфичная протеинфосфатаза осуществляет обратную реакцию, когда соотношение [РQ]/[РQН2] возрастает.
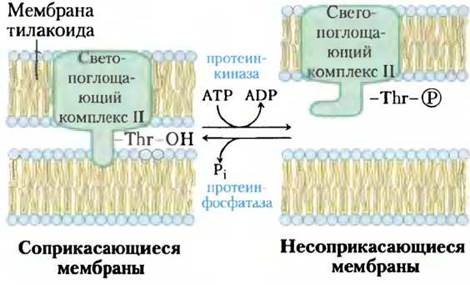
Перестройка в светопоглощающем комплексе II связана с переходом между циклическим и нециклическим фосфорилированием, описанным выше. В состоянии 1 путь электронов главным образом нециклический, а в состоянии 2 — циклический.
Вода расщепляется кислород-образующим комплексом
У фотосинтезирующих растений — продуцентов кислорода — главным источником электронов, поступающих к NАDРН, служит вода. После потери электрона молекулой Р680 в ФСII и восстановления им феофитина в молекуле пигмента остается «электронная дырка» Р680+, которая должна быть заполнена для возврата пигмента в основное электронное состояние и восстановления его способности к захвату фотона. Электрон для заполнения такой «дырки» может поступать как от органических, так и от неорганических соединений. Фотосинтезирующие бактерии в качестве доноров электронов могут использовать ацетат, сукцинат, малат или сульфиды в зависимости от вида синтезирующих организмов. Полагают, что 3 млрд лет назад в процессе эволюционного развития примитивных фотосинтезирующих бактерий (прародителей современных цианобактерий) возникла фотосистема, способная отщеплять электроны от наиболее доступного донора воды, что можно записать уравнением:
2 Н2O —> 4 Н+ + 4 е- + O2
При расщеплении двух молекул воды образуются четыре электрона, четыре протона и молекулярный кислород. Энергии одного фотона видимого света недостаточно для разрыва химических связей воды. Квантовая потребность этой фотолитической реакции расщепления равна четырем фотонам.
Отщепленные от воды четыре электрона попадают на окисленный реакционный центр Р680+ не сразу все и неодновременно, поскольку Р680+ способен присоединять одномоментно только один электрон. Эти четыре электрона по одному пересылаются на Р680+ замечательным молекулярным устройством — кислород-образующим, или водорасщепляющим, комплексом (рис. 19-62). Прямым донором электронов для пигмента Р680+ выступает остаток Туr, обозначаемый также символом Z или Туr2, в белковой субъединице D1, входящей в состав реакционного центра ФСII. Теряя протон и электрон, остаток Туr превращается в электрически нейтральный свободный радикал •Туrсогласно уравнению
4 Р680+ + 4 Туr —> 4 Р680 + 4 •Туr (19-13)
Рис. 19-62. Водорасщепляющая активность кислород-образующего комплекса. Показан процесс, при котором в водорасщепляющем комплексе ФСII образуется четырехэлектронный окислитель — многоядерный центр с несколькими ионами Мn. При каждом присоединении фотона (эксистона) Мn-центр теряет один электрон, последовательное связывание четырех фотонов приводит к образованию окислителя, который способен отщепить четыре электрона от молекулы воды с выделением O2. Электроны, уходящие от Мn-центра, один за другим передаются на остаток Туr в белке в составе ФСII, а затем на Р680.
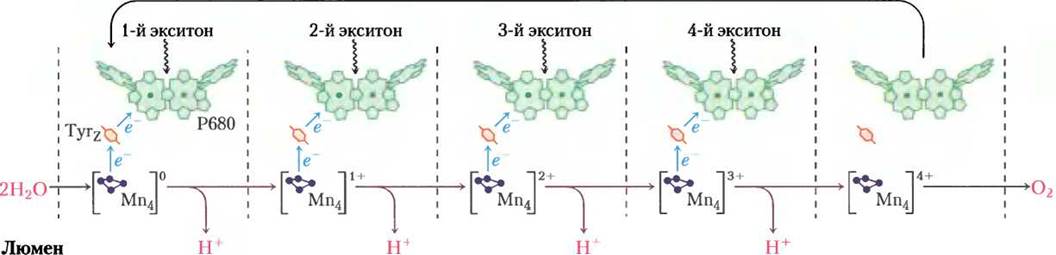
Потерю электрона и протона радикал •Туr восполняет при окислении четырехзарядного кластера марганца, входящего в состав водорасщепляющего комплекса. При каждой передаче одного электрона кластер марганца становится на единицу заряда более окисленным. После отщепления четырех электронов, на каждый затрачивается энергия одного поглощенного фотона, марганецсодержащий кластер приобретает заряд +4 (рис. 19-62).
4 •Туr + [Мn-комплекс]0 —> 4 Туr + [Мn-комплекс]4+ (19-14)
Потерю четырех электронов кластер [Мn]4+ восполняет, отщепляя их от двух молекул воды, распадающихся на четыре протона и молекулярный кислород согласно уравнению:
[Мn-комплекс]4+ + 2 Н2O —> [Мn-комплекс]0 + 4 Н+ + O2 (19-15)
Образовавшиеся в реакции 19-15 четыре протона перекачиваются в тилакоидный люмен кислород- образующим комплексом — протонным насосом, работающим за счет энергии переноса электронов. Суммарно уравнения с 19-12 по 19-15 можно записать следующим образом:
2 Н2O + 2 РQB + 4 фотона —> O2 + 2 QВН2 (19-16)
Кислород-образующий комплекс ассоциирован с периферическим мембранным белком (Мr = 33 000) на люменальной стороне тилакоидной мембраны, который стабилизирует кластер с четко заданной геометрией из четырех ионов Мn (в разных состояниях окисления), одного иона Са2+, пяти атомов кислорода и иона Сl-. Химические превращения, которые происходят в этом кластере, еще не до конца ясны, но именно эта химия лежит в основе жизни на Земле и благодаря биологическому значению очень интересна для изучения биоорганической химии. Для марганца устойчивы степени окисления от +2 до +7, поэтому кластер ионов Мn может и принимать, и отдавать электроны. Определение структуры полиметаллического центра способствовало появлению нескольких вполне обоснованных, но все еще проверяемых гипотез. Исследования в этом направлении еще находятся в самом разгаре.
Краткое содержание раздела 19.8 Основной фотохимический процесс — это индуцированный светом перенос электронов
■ У фотосинтезирующих бактерий есть только один из двух возможных типов фотосистем: у пурпурных бактерий — фотосистема феофитин-хинонового типа, у зеленых серных бактерий — FeS-типа.
■ Как показало изучение молекулярного строения фотосистемы пурпурных бактерий, индуцированный светом поток электронов переносится от возбужденной специализированной пары молекул хлорофилла через феофитин к хинону, от которого через цитохромный комплекс bc1 электроны вновь возвращаются в фотохимический реакционный центр.
■ У зеленых серных бактерий путь электронов другой — от хинона к NAD+.
■ В световых реакциях фотосинтеза цианобактерий и растений две фотосистемы функционируют совместно.
■ У растений фотосистема I направляет поток электронов от реакционного центра Р700 по цепи переносчиков к ферредоксину, который передает их на восстановление NADP+до NADPH.
■ Реакционный центр Р680 фотосистемы II растений высвобождает богатые энергией электроны и передает их пластохинону. Возникшая в ФСII электронная «дырка» заполняется — электрон поступает от Н2O. В качестве доноров электронов некоторые фотосинтезирующие организмы используют вместо воды другие соединения.
■ Поток электронов через фотосистемы приводит к образованию NADPH и АТР в соотношении примерно 2 : 3. Циклический поток электронов приводит только к образованию АТР и обеспечивает вариабельность соотношения образующихся NADPH и АТР.
■ Локализация ФСI и ФСII между гранами и ламеллами стромы может изменяться и косвенным образом регулируется интенсивностью света, оптимизируя распределение экситонов между ФСI и ФСII для эффективного поглощения энергии.
■ Индуцированная светом реакция расщепления Н2O, при которой выделяется кислород, катализируется Mn-содержащим белковым комплексом. Восстановленный пластохинон переносит электроны на цитохромный комплекс b6f, откуда они поступают на пластоцианин и затем на реакционный центр Р700, заполняя там «дырку», образовавшуюся в результате потери электрона вовремя фотовозбуждения.
■ Поток электронов через цитохромный комплекс b6f вызывает перекачивание протонов через плазматическую мембрану, в результате чего возникает протон-движущая сила, поставляющая энергию для синтеза АТР, катализируемого ферментным комплексом АТР-синтазой.