ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
13. ОСНОВЫ БИОЭНЕРГЕТИКИ. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
13.3. Перенос фосфатных групп и АТР
Познакомившись с некоторыми фундаментальными закономерностями изменений энергии в химических системах, мы теперь можем рассмотреть энергетический цикл в клетках и особую роль АТР как энергетического посредника, связывающего процессы катаболизма и анаболизма (см. рис. 1-28, т. 1). Гетеротрофные клетки получают свободную энергию в химической форме в процессе катаболизма молекул питательных веществ и используют эту энергию для синтеза АТР из ADP и неорганического фосфата Рi. Затем АТР отдает часть своей химической энергии в эндергонических процессах, таких как синтез промежуточных продуктов метаболизма и макромолекул из более мелких предшественников, перенос веществ через мембраны против градиента концентраций и молекулярная динамика. Такая передача энергии от АТР в конце концов приводит к распаду АТР на ADP и Рi, а в некоторых случаях до АМР и 2 Рi. Мы обсудим здесь химические основы больших изменений свободной энергии, которыми сопровождается процесс гидролиза АТР и других высокоэнергетических фосфатных соединений, и покажем, что в большинстве реакций передачи энергии от АТР происходит перенос групп, а не простой гидролиз АТР. Для иллюстрации энергетических превращений, в которых АТР поставляет энергию, рассмотрим синтез информационных макромолекул, транспорт растворов через мембраны и сокращение мышц.
При гидролизе АТР изменение свободной энергии выражается отрицательным числом, большим по абсолютной величине
Почему же при гидролизе АТР стандартная свободная энергия настолько отрицательна? Рассмотрим химические основы этого процесса, воспользовавшись рис. 13.11. Гидролитическое отщепление концевого фосфата с разрывом фосфоангидридной связи в АТР приводит к незначительному уменьшению электростатического напряжения в структуре молекулы АТР, обусловленного электростатическими взаимодействиями. Высвободившийся Pi (НРО42-) стабилизируется путем образования резонансных структур, существование которых невозможно в АТР. ADP2- — другой прямой продукт гидролиза АТР немедленно ионизируется, высвобождая в среду ионы водорода в очень низкой концентрации, [Н+] ≈ 10-7 М. Концентрации прямых продуктов гидролиза АТР в клетке значительно ниже их концентраций в равновесной системе (табл. 13-5); таким образом, по закону действующих масс в клетке имеются благоприятные условия для гидролиза АТР.
Рис. 13-11. Химические основы очень существенного изменения свободной энергии при гидролизе АТР. (1) Разрыв концевой фосфатной связи при гидролизе снимает электростатическое напряжение молекулы АТР с четырьмя отрицательными зарядами. (2) Продукт реакции неорганический фосфат Рi стабилизируется путем образования гибридной резонансной структуры, в которой каждая из четырех связей фосфор-кислород содержит некоторую степень двойной связи, а водородный ион не связан постоянно ни с одним из атомов кислорода. (Резонансная стабилизация происходит и в фосфатах, участвующих в эфирной, или ангидридной, связи, однако для них может реализоваться меньшее число резонансных форм, чем для Рi.) (3) Продукт ADP2- сразу же ионизируется, высвобождая в среду протоны в очень низкой концентрации (pH 7). Четвертый фактор (на рисунке не отражен), который благоприятствует гидролизу АТР, — это более высокая степень сольватации (в данном случае гидратации) продуктов Рi и ADP по сравнению с исходным АТР, из-за чего продукты реакции становятся устойчивее, чем исходные вещества.
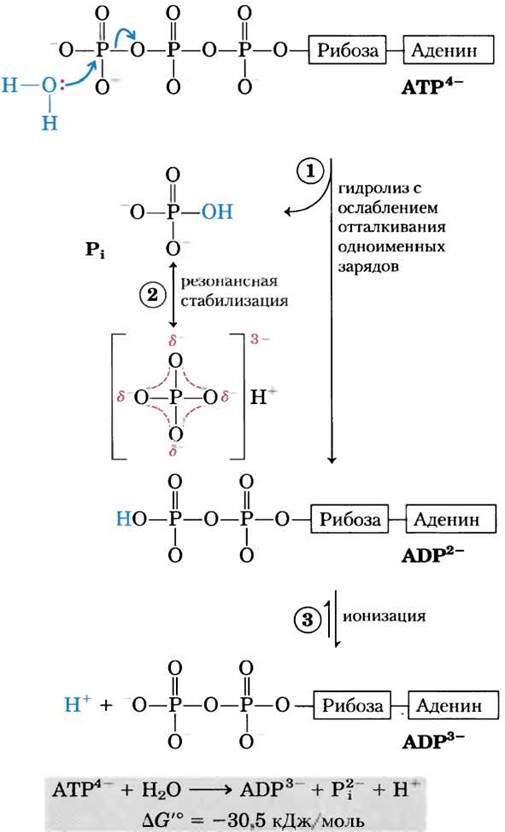
Для гидролиза АТР в стандартных условиях изменение свободной энергии составляет -30,5 кДж/моль, однако в живых клетках этот параметр существенно отличается от этой величины, поскольку клеточные концентрации АТР, ADP и Pi не равны между собой и гораздо ниже стандартных концентрации, равных 1,0 М (табл. 13-5). Более того, в цитозоле с АТР и ADP связываются ионы Mg2+ (рис, 13-12), и в большинстве ферментативных реакций, в которых АТР участвует в качестве донора фосфорильной группы, активной формой АТР является именно его комплекс с магнием MgATP2. Поэтому правильнее говорить о ∆G'° гидролиза MgATP2-. В доп. 13-1 приведен расчет ∆G гидролиза АТР в интактных эритроцитах с использованием данных, приведенных в табл. 13-5. В интактных клетках величина ∆G гидролиза АТР, обычно обозначается ∆Gp и называется потенциалом фосфорилирования.
Таблица 13-5. Концентрации адениновых нуклеотидов, неорганических фосфатов и креатинфосфатов в некоторых клетках
Клетки |
Концентрация (мМ) |
||||||||||
АТР |
ADP6 |
АМР |
Pi |
РСr |
|||||||
Гепатоциты крыс |
3,38 |
1,32 |
0,29 |
4,8 |
0 |
||||||
Миоциты крыс |
8,05 |
0,93 |
0.04 |
8.05 |
28 |
||||||
Нейроны крыс |
2,59 |
0,73 |
0,06 |
2,72 |
4,7 |
||||||
Эритроциты человека |
2,25 |
0,25 |
0,02 |
1,65 |
0 |
||||||
Клетки Е. соli |
7,90 |
1,04 |
0,82 |
7,9 |
0 |
||||||
а Для эритроцитов приведены концентрации в цитозоле (у эритроцитов человека нет ни ядра, ни митохондрий). Во всех других случаях имеется в виду общее содержание в клетке, концентрация ADP в цитозоле сильно отличается. РСr — креатинфосфат (обсуждается на с. 33).
б Приведена суммарная концентрация ADP; содержание свободного ADP может быть гораздо ниже (см. с. 30-31).
Поскольку в клетках разных типов концентрации АТР, ADP и Piварьируют (см. табл. 13-5), величины ∆Gp гидролиза АТР в них также различны. Более того, в любой клетке ∆Gpможет изменяться во времени в зависимости от условий метаболизма, на которые влияют концентрации АТР, ADP, Pi и Н+ (pH). Мы можем рассчитать ∆Gp любой реакции метаболизма в клетке, если известны концентрации всех исходных веществ и продуктов реакции, а также другие параметры (pH, температура и концентрация ионов Mg2+).
Расчеты усложняются тем, что суммарные концентрации АТР, ADP, Pi и Н+ могут быть существенно выше, чем соответствующие свободные концентрации, которые входят в термодинамические расчеты, ведь часть АТР, ADP, и Pi связано с клеточными белками. Например, по различным данным, в расслабленной мышце концентрация свободных молекул ADP варьирует от 1 до 37 мкМ. В примере 13-2, если использовать концентрацию 25 мкМ, получим ∆Gp= -64 кДж/моль. Возможно, этот расчет ∆Gp не столь уж поучителен; однако надо помнить наш вывод относительно изменений свободной энергии: in vivo энергия, высвобождаемая при гидролизе АТР, выше изменения стандартной свободной энергии ∆G'°.
Пример 13-2. Расчет ∆Gр
Вычислите свободную энергию гидролиза АТР (∆Gр) в эритроцитах человека. Стандартная свободная энергия гидролиза АТР равна -30,5 кДж/моль, а концентрации ATP, ADP и Piв эритроцитах приведены в табл. 13-5; pH 7,0, температура тела 37 °С. Что можно сказать о количестве энергии, необходимом для синтеза АТР в таких условиях?
Решение. В эритроцитах человека концентрации АТР, ADP и Piравны 2,25 мМ, 0,25 мМ и 1,65 мМ соответственно. Свободная энергия гидролиза АТР в эритроцитах при стандартных условиях (см. уравнение 13-4)
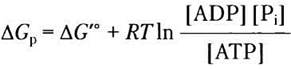
Подставляя численные значения, получаем
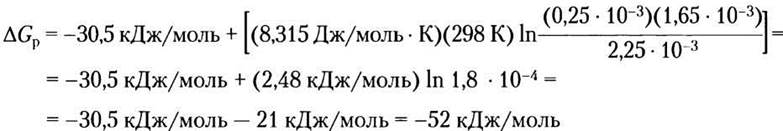
(Обратите внимание, что ответ округлен (52,5 округлили до 52) по правилам округления цифры 5 до ближайшего меньшего (а не большего) целого числа, чтобы избежать завышения значений.) Таким образом, в интактных эритроцитах ∆Gpгидролиза АТР (-52 кДж/моль) существенно выше, чем ∆G'° = -30,5 кДж/моль.
Итак, для синтеза АТР из ADP и Pi в эритроцитах требуется 52 кДж/моль.
В дальнейшем для гидролиза АТР мы будем приводить величину ∆G'°, так как это позволит сравнивать энергетику разных реакций в клетке. Но не забывайте, что в живой клетке ∆G гидролиза АТР, а также многих других реакций может очень сильно отличаться от ∆G'°.
Здесь следует сделать одно важное замечание, касающееся содержания АТР в клетках. Мы показали (и еще обсудим далее), какие химические свойства АТР делают эту молекулу удобным энергетическим ресурсом клетки. Однако АТР управляет реакциями метаболизма и другими энергозатратными процессами не только благодаря своим химическим свойствам. Более важную роль сыграло то, что в ходе эволюции выработались такие регуляторные механизмы, которые поддерживают внутриклеточную концентрацию АТР на значительно более высоком уровне, чем равновесные концентрации в реакциях гидролиза. При снижении концентрации АТР уменьшается не только количество топлива, но само топливо теряет свою мощность: снижается ∆G гидролиза этой молекулы (т. е. потенциал фосфорилирования, ∆Gр). Как мы увидим при обсуждении метаболических процессов, протекающих с образованием и расходованием АТР, живые клетки выработали тонкие механизмы (которые, как может показаться на первый взгляд, снижают эффективность процессов и противоречат здравому смыслу) для поддержания высокой концентрации АТР.
Свободная энергия других фосфорилированных соединений и тиоэфиров тоже велика
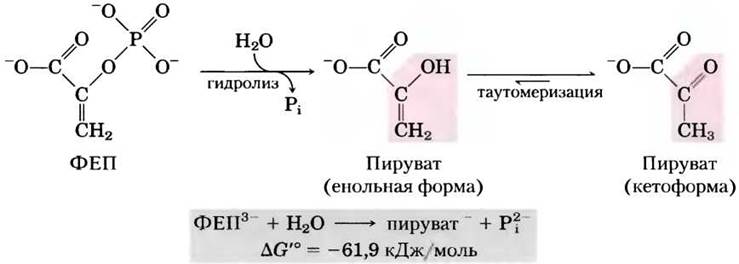
Фосфоенолпируват (ФЕП; рис. 13-13) содержит фосфоэфирную связь, которая подвергается гидролизу с образованием енольной формы пирувата, и этот прямой продукт реакции может сразу же в результате таутомеризации переходить в более устойчивую кетоформу. Благодаря тому, что исходный ФЕП имеет только одну форму
(енольную), а продукт (пируват) может существовать в двух формах (енольной и кетоформе), продукт реакции более стабилен по сравнению с исходным веществом. Это в основном и определяет большую величину стандартной свободной энергии гидролиза фосфоенолпирувата: ∆G′° = -61,9 кДж/моль.
Рис. 13-13. Гидролиз фосфоенолпирувата (ФЕП). Реакция катализируется пируваткиназой и сопровождается последующей таутомеризацией пирувата. Таутомеризация ФЕП невозможна, и поэтому продукты гидролиза более стабильны, чем исходные вещества. Как показано на рис. 13-11, происходит также резонансная стабилизация неорганического фосфата
Другое трехуглеродное соединение 1,3-бис- фосфоглицерат (рис. 13-14) содержит ангидридную связь между карбоксильной группой при С-1 и фосфатным остатком. Гидролиз этого ацилфосфата сопровождается значительным отрицательным изменением стандартной свободной энергии (∆G′° = -49,3 кДж/моль), что можно объяснить, исходя из структурных особенностей исходного вещества и продуктов реакции. Когда вода присоединяется по ангидридной связи 1,3-бисфосфоглицерата, один из прямых продуктов реакции 3-фосфоглицериновая кислота может быстро терять протон, образуя 3-фосфоглицерат (карбоксилат-ион), имеющий две одинаково возможные резонансные формы (рис. 13-14). Протеканию реакции в прямом направлении благоприятствует удаление прямого продукта реакции (3-фосфоглицериновой кислоты) и образование резонансно стабилизированного иона.
Рис. 13-14. Гидролиз 1,3-бисфосфоглицерата. Прямым продуктом гидролиза является 3-фосфоглицериновая кислота, содержащая неионизированную карбоксильную группу, которая, однако, тут же диссоциирует. Благодаря ионизации и образованию резонансных структур продукт реакции более стабилен по сравнению с исходными веществами. Кроме того, отрицательному изменению свободной энергии способствует резонансная стабилизация Рi.
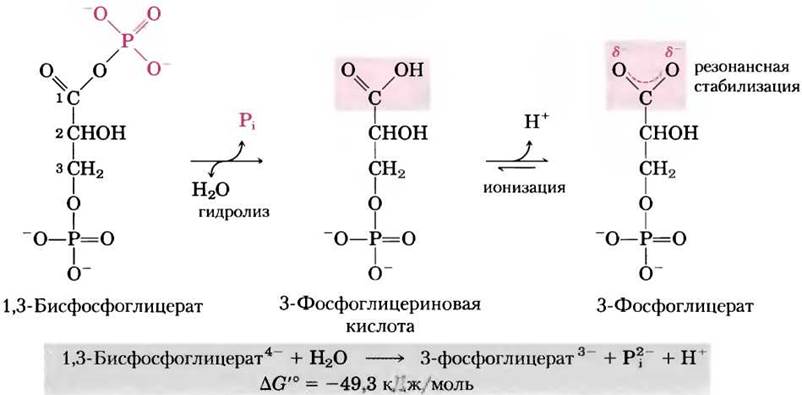
В креатинфосфате (рис. 13-15) связь Р—N может подвергаться гидролизу с образованием свободного креатина и Выделение Pi и резонансная стабилизация креатина способствуют протеканию реакции в прямом направлении. Изменение стандартной свободной энергии гидролиза креатинфосфата снова оказывается большим (-43,0 кДж/моль).
Рис. 13-15. Гидролиз креатинфосфата. Разрыв связи Р-N в креатинфосфате приводит к образованию креатина, который стабилизируется образованием гибридной резонансной структуры. Другой продукт реакции Рi также резонансно стабилизирован.
Во всех этих реакциях, где происходит выделение фосфата, образование нескольких резонансных форм Pi приводит к повышению устойчивости продукта реакции по сравнению с исходным веществом, что также является важной причиной большой отрицательной величины изменения свободной энергии. В табл. 13-6 приведена стандартная свободная энергия гидролиза нескольких фосфорилированных соединений.
Таблица 13-6. Стандартные свободные энергии гидролиза некоторых фосфорилированных соединений и ацетил-СоА (тиоэфир)
∆G′° |
||
кДж/моль |
ккал/моль |
|
Фосфоенолпируват |
-61,9 |
14,8 |
1,3-Бисфосфоглицерат (—> 3-фосфоглицерат + Рi) |
-49,3 |
-11,8 |
Креатинфосфат |
-43,0 |
-10,3 |
ADP (—> АМР + Рi) |
-32,8 |
-7,8 |
АТР (—> ADP + Рi) |
-30,5 |
-7,3 |
АТР (—> АМР + PPi) |
-45,6 |
-10,9 |
АМР (—> аденозин + Рi) |
-14,2 |
-3,4 |
РРi (—> 2 Pi) |
-19.2 |
-10 |
Глюкозо-1 -фосфат |
-20,9 |
-5,0 |
Фруктозо-6-фосфат |
-15,9 |
-3,8 |
Глюкозо-6-фосфат |
-13,8 |
-3,3 |
Глицерин-1 -фосфат |
-9,2 |
-2,2 |
Ацетил-СоА |
-31,4 |
-7,5 |
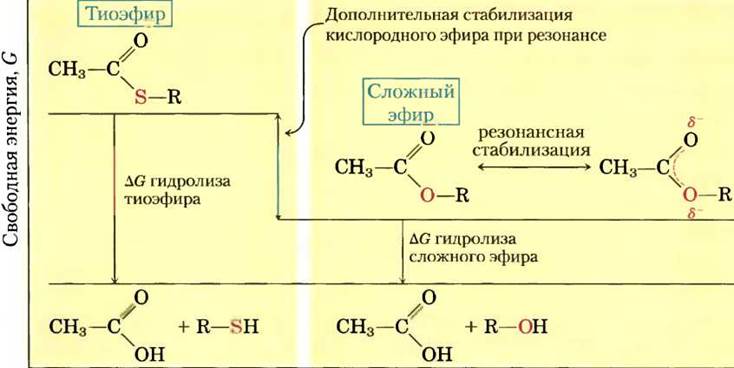
Тиоэфиры, в молекулах которых в эфирной связи вместо обычного кислорода содержится сера, также характеризуются большой отрицательной стандартной свободной энергией гидролиза. Ацетилкофермент А, или ацетил-СоА (рис. 13-16), — один из тиоэфиров, играющих важную роль в метаболизме. Ацильная группа этих соединений активируется в реакциях пере- ацилирования, конденсации или окислительновосстановительных реакциях. Тиоэфиры гораздо меньше подвержены резонансной стабилизации, чем кислородные эфиры. Поэтому разность свободных энергий исходных веществ и продуктов гидролиза, которые резонансно стабилизируются, в случае тиоэфиров еще больше, чем в случае аналогичных кислородных эфиров (рис. 13-17). В обоих случаях гидролиз эфира приводит к образованию карбоновой кислоты, которая может ионизироваться и давать несколько резонансных форм. Вместе оба этих фактора обусловливают большую отрицательную величину ∆G′° (-31,4 кДж/моль) гидролиза ацетил-СоА.
Рис. 13-16. Гидролиз ацетилкофермента А. Гидролиз тиоэфира ацетил-СоА характеризуется большой отрицательной стандартной свободной энергией. В тиоэфирах сера занимает место кислорода в сложноэфирной связи. Полная структурная формула кофермента А (СоА или СоАSН) приведена на рис. 8-41, т. 1.
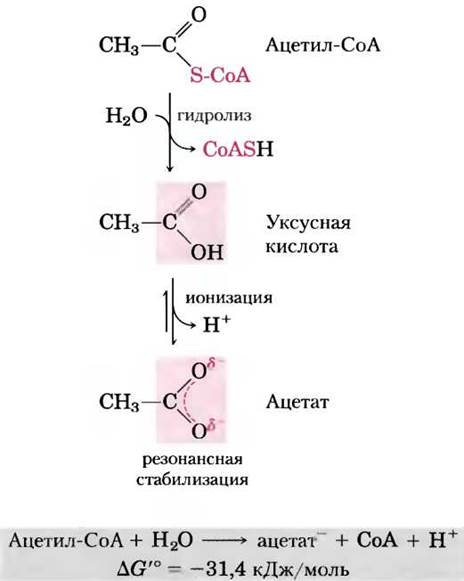
Рис. 13-17. Свободная энергия гидролиза сложных эфиров и тиоэфиров. Продукты реакций гидролиза этих эфиров характеризуются приблизительно одинаковой свободной энергией (G), однако свободная энергия тиоэфира выше, чем у «кислородного» эфира. Частичное перекрывание орбиталей атомов O и С обеспечивает резонансную стабилизацию кислородных эфиров; орбитали атомов S и С перекрываются плохо, что приводит к незначительной резонансной стабилизации тиоэфиров.
Подводя итог, отметим, что в реакциях гидролиза, которые характеризуются большими отрицательными величинами изменений стандартной свободной энергии, продукты реакций стабильнее, чем исходные вещества. Это обсуловлено одной или несколькими следующими причинами: (1) в реагентах вследствие электростатического отталкивания при разделении зарядов напряжение связи ослабевает, как в случае с АТР; (2) продукты реакции стабилизируются путем ионизации, как АТР, ацилфосфаты и тиоэфиры; (3)продукты реакции стабилизируются при изомеризации (таутомеризации), как фосфоенолпируват; и/или (4) продукты реакции стабилизируются благодаря существованию резонансных форм, как в случае креатина, высвобождаемого из фосфокреатина, карбоксилат-иона (из ацилфосфатов и тиоэфиров) и фосфата Ps (из ангидридных и эфирных соединений).
АТР поставляет энергию благодаря переносу групп, а не просто гидролиза
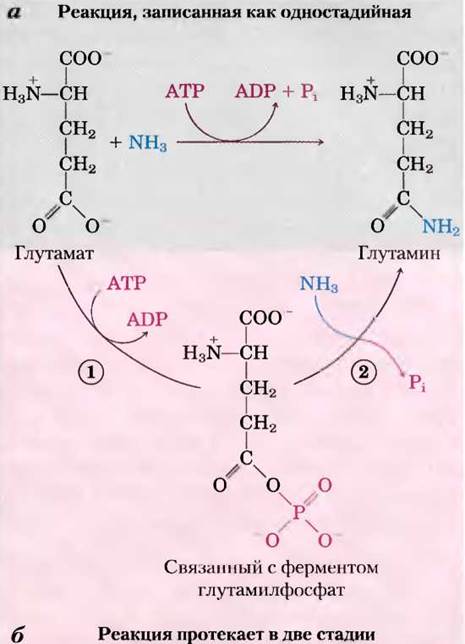
На протяжении всей книги будут встречаться реакции или процессы, где используется энергия АТР, и участие АТР в этих реакциях обычно обозначается, как на рис. 13-18, а, изогнутой стрелкой, показывающей превращение АТР в ADP и Pi (или в некоторых случаях АТР в АМР и пирофосфат PPi). При таком обозначении реакции кажутся простым гидролизом, при котором вода вытесняет Pi (или PPi), и хочется сказать, что ATP-зависимые реакции «протекают за счет гидролиза АТР». На самом деле, это не так. Гидролиз АТР обычно не приводит ни к чему иному, кроме выделения тепла, что не может управлять химическим процессом в изотермической системе. Одна-единственная стрелка в схеме реакции на рис. 13-18, а и в других схемах почти всегда обозначает двухстадийный процесс (рис. 13-18, б), в котором часть молекулы АТР, а именно фосфорильная или пирофосфорильная группа или аденилатный фрагмент (АМР) из АТР, вначале переносится на молекулу субстрата или на аминокислотный остаток в составе фермента, ковалентно с ним связываясь и увеличивая его свободную энергию. Затем на второй стадии фосфатсодержащий фрагмент, образованный на первой стадии, замещается с образованием Pi, PPi или АМР. Таким образом, АТР ковалентно участвует в ферментативной реакции, превнося свободную энергию.
Рис. 13-18. Две стадии гидролиза АТР. а — участие АТР в реакции часто изображается как одна стадия, однако этот процесс почти всегда двухстадийный, б — реакция, катализируемая ATP-зависимой глутаминсинтетазой. (1) Фосфорильная группа от АТР переносится к глутамату, затем (2) фосфорильная группа замещается на NH3 и высвобождается в виде Pi.
Однако в некоторых процессах действительно происходит прямой гидролиз АТР (или GTP). Например, нековалентное связывание АТР (или GTP) с последующим гидролизом до ADP (или GDP) и Р, может обеспечивать энергией цикл конформационных изменений некоторых белков, осуществляющих механическое движение. Это происходит при мышечном сокращении и при перемещении ферментов вдоль ДНК или смещении матричной РНК относительно рибосомы. Прямой гидролиз фосфоангидридных связей снабжает энергией также реакции, которые катализируются хеликазами, RесА-белками и некоторыми топоизомеразами (гл. 25). Действующие в сигнальных путях GТР-связывающие белки непосредственно гидролизуют GТР, что приводит к конформационным изменениям, блокируя сигналы, запускаемые гормонами или другими внеклеточными агентами (гл. 12).
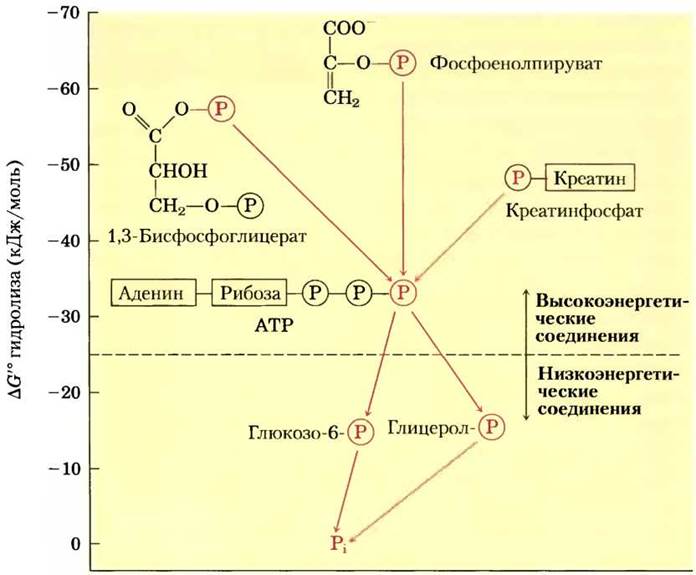
На основании величины стандартной свободной энергии гидролиза фосфатные соединения, обнаруженные в живых организмах, условно можно разделить на две группы (рис. 13-19). У «высокоэнергетических» соединений ∆G′° гидролиза меньше -25 кДж/моль; у «низкоэнергетических» ∆G'° выше. По этому критерию ATP (∆G'° гидролиза -30,5 кДж/моль = -7,3 ккал/моль) — высокоэнергетическое соединение; глюкозо-6-фосфат (∆G'° -13,8 кДж/моль = -3,3 ккал/моль) — низкоэнергетическое соединение.
Рис. 13-19. Оценка биологических фосфатных соединений на основании величин стандартной свободной энергии гидролиза. Показан перенос фосфорильных групп, обозначенных![]() от высокоэнергетических фосфорильных доноров через АТР к молекулам акцепторов (например, глюкозе и глицерину) с образованием их низко энергетических фосфатных производных. Во внутриклеточных условиях такой перенос фосфорильных групп, катализируемый ферментами киназами, происходит с потерей свободной энергии на каждой стадии. При гидролизе низкоэнергетических фосфатных соединений высвобождается Pi, который обладает еще более низким потенциалом передачи фосфорильной группы (см. текст).
от высокоэнергетических фосфорильных доноров через АТР к молекулам акцепторов (например, глюкозе и глицерину) с образованием их низко энергетических фосфатных производных. Во внутриклеточных условиях такой перенос фосфорильных групп, катализируемый ферментами киназами, происходит с потерей свободной энергии на каждой стадии. При гидролизе низкоэнергетических фосфатных соединений высвобождается Pi, который обладает еще более низким потенциалом передачи фосфорильной группы (см. текст).
Выражение «высокоэнергетическая фосфатная связь» давно используется биохимиками при описании связи Р—О, разрыв которой происходит в реакциях гидролиза; но это не совсем корректно — можно неправильно понять, что энергия заключена в самой связи. В действительности, разрыв любой химической связи требует затраты энергии. Свободная энергия, высвобождаемая при гидролизе фосфатных соединений, обязана своим происхождением не разрыву специфической связи, а тому, что продукты реакции обладают более низкой свободной энергией, чем реагенты. Для простоты мы иногда будем пользоваться выражением «высокоэнергетическое фосфатное соединение» применительно к АТР или другим фосфатным соединениям с большой отрицательной стандартной свободной энергией гидролиза.
Из аддитивности изменений свободной энергии последовательных реакций следует, что любое фосфорилированное соединение может быть образовано при сопряжении реакции синтеза с распадом другого фосфорилированного соединения с более низкой отрицательной свободной энергией гидролиза. Например, благодаря тому, что при отщеплении Pj от фосфоенолпирувата (ФЕП) освобождается больше энергии, чем необходимо для проведения конденсации Рi с ADP, термодинамически возможен прямой перенос фосфорильной группы от ФЕП на ADP:
∆G'°, (кДж/моль)
(1) ФЕП + Н2O —> пируват + Рi -61,9
(2) ADP + Pi —> АТР + Н2O +30,5
Итого: ФЕП + ADP —> пируват + АТР -31,4
Обратите внимание, что, хотя итоговая реакция и представлена в виде алгебраической суммы первых двух реакций, она по сути является третьей отдельной реакцией, которая не включает Pi; ФЕП передает фосфорильную группу непосредственно ADP. На основании величин стандартной свободной энергии гидролиза мы можем описать фосфорилированные соединения как соединения, имеющие высокий или низкий потенциал переноса фосфорильной группы (табл. 13-6). Потенциал переноса фосфорильной группы фосфоенолпирувата очень высокий, АТР — высокий, а глюкозо-6-фосфата — низкий (рис. 13-19).
Многие процессы катаболизма направлены на синтез высокоэнергетических фосфатных соединений, но их образование не является конечной целью как таковой. Эти соединения — лишь средство активирования множества разнообразных веществ с целью их дальнейших химических превращений. Перенос фосфорильной группы эффективно привносит свободную энергию, которая используется в последующих метаболических превращениях. Выше мы описывали, как происходит синтез глюкозо-6-фосфата с переносом фосфорильной группы от АТР. В следующей главе будет показано, как фосфорилирование глюкозы активирует глюкозу, т. е. система «заправляется» таким образом «горячим» для катаболических реакций, которые происходят в любой живой клетке. Благодаря своему промежуточному положению на шкале потенциала переноса групп АТР может передавать энергию от высокоэнергетических фосфатных соединений, которые образуются в процессах катаболизма, к таким соединениям, как глюкоза, превращая их в более реакционноспособные формы. Таким образом, АТР служит универсальным переносчиком энергии во всех живых клетках.
У АТР есть еще одна особенность, которая очень важна для его роли в метаболизме: хотя в водных растворах АТР термодинамически нестабилен и поэтому является хорошим донором фосфорильной группы, кинетически он стабилен. Из-за очень больших значений энергии активации (от 200 до 400 кДж/моль), необходимой для неферментативного расщепления фосфоангидридных связей, АТР не может спонтанно отдавать фосфорильные группы воде или сотням других потенциальных акцепторов, находящихся в клетке. Перенос фосфорильных групп от АТР происходит только при наличии специфических ферментов, понижающих энергию активации. Поэтому клетка способна управлять распределением энергии, переносимой молекулами АТР, путем регуляции ферментов, которые на них воздействуют.
АТР отдает фосфорильную, пирофосфорильную и аденильную группы
Реакции, в которых принимает участие АТР, — это, как правило, реакции нуклеофильного замещения SN2 (см. разд. 13-2), в которых в качестве нуклеофилов могут выступать, например, кислород спирта или карбоксилата либо азот креатина боковой цепи аргинина или гистидина. Каждый из трех атомов фосфора АТР подвержен нуклеофильной атаке (рис. 13-20), в результате чего образуются разные продукты реакции.
Нуклеофильная атака спиртом уфосфата (рис. 13-20, а) вытесняет ADP и приводит к образованию нового фосфоэфира. Опыты с реагентами, меченными 18O, продемонстрировали, что в новом соединении кислород эфирной связи происходит от спирта, а не от АТР, и, следовательно, от АТР переносится фосфорильная группа (-РO2-3), а не фосфатная (-ОРO2-3). При переносе фосфорильной группы от АТР к глутамату (рис. 13-18) или к глюкозе (т. 1, с. 308) происходит атака в y-положение молекулы АТР.
Рис. 13-20. Реакции нуклеофильного замещения АТР. Любой из трех атомов фосфора (α, β или y) может служить электрофильной мишенью для нуклеофильной атаки — в данном случае меченым нуклеофилом R-18O. В качестве нуклеофилов могут выступать спирт (ROH), карбоксильная группа (RCOO-) или фосфоангидрид (например, нуклеозидмонофосфат или нуклеозиддифосфат). а — когда кислород нуклеофила атакует y-положение, тогда в эфирной связи продукта реакции оказывается меченый кислород. Это свидетельствует о том, что с АТР переносится именно фосфорильная (-РO2-3), а не фосфатная группа (-OPO2-3). б — атака на β-положение вытесняет АМР и ведет к переносу пирофосфорильной (не пирофосфатной) группы на нуклеофил. в — при атаке в α-положение замещается PPi и нуклеофилу передается аденилильная группа. Три положения в молекуле АТР для атаки нуклеофилом R18O
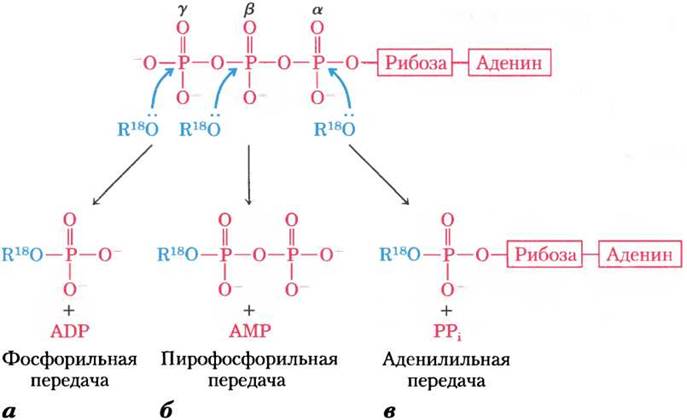
При атаке на β-фосфат в АТР происходит вытеснение АМР и перенос пирофосфорильной (не пирофосфатной) группы к атакующему нуклеофилу (рис. 13-20, б). Например, образование 5'-фосфорибозил-1-пирофосфата (с. 861), ключевого промежуточного продукта в синтезе нуклеотидов, происходит при атаке группой -ОН рибозы β-фосфата.
При нуклеофильной атаке в α-положение молекулы АТР происходит вытеснение PPi и перенос аденилата (5'-АМР) в виде аденилильной группы (рис. 13-20, в). Такая реакция называется реакцией аденилилирования (вероятно, самое неуклюжее слово в биохимическом языке). Обратите внимание, что при гидролизе α-β-фосфоангидридной связи освобождается значительно больше энергии (~ 46 кДж/моль), чем при гидролизе β-y-связи (-31 кДж/моль) (табл. 13-6). Более того, побочный продукт аденилилирования неорганический пирофосфат PPi затем гидролизуется при участии повсеместно распространенного фермента неорганической пирофосфатазы с образованием двух молекул неорганического ортофосфата Pi. При этом выделяется 19 кДж/моль энергии, что обеспечивает дальнейший энергетический «толчок» для реакции аденилилирования. В результате суммарной реакции разрываются обе фосфоангидридные связи АТР. Поэтому реакции аденилилирования термодинамически очень выгодны. В том случае, когда энергия АТР используется для проведения особенно невыгодных метаболических реакций, аденилилирование часто используется в качестве механизма сопряжения энергии. Хорошим примером такого способа сопряжения энергии может служить активация жирных кислот.
Первая стадия активации жирной кислоты, необходимой для окисления с выделением энергии или для синтеза более сложных липидов, — это образование тиолового эфира (см. рис. 17-5). Прямая конденсация жирной кислоты с коферментом А — эндергоническая реакция, однако при постадийном удалении двух фосфорильных групп от АТР образование СоА- производного жирной кислоты — экзергонический процесс. Сначала аденилат (АМР) переносится от АТР к карбоксильной группе жирной кислоты с образованием смешанного ангидрида (аденилатного производного жирной кислоты) и высвобождением PPi. Затем тиоловая группа кофермента А замещает аденилатную группу и образует тиоэфир с жирной кислотой. Сумма этих двух реакций энергетически эквивалентна экзергоническому гидролизу АТР до АМР и PPi (∆G'° = -45,6 кДж/моль) и эндергоническому образованию СоА-производного жирной кислоты (∆G'° = 31,4 кДж/моль). Образование СоА- производного жирной кислоты становится энергетически выгодным благодаря гидролизу PPi неорганической пирофосфатазой. Таким образом, при активации жирной кислоты разрываются обе фосфоангидридные связи АТР. В итоге, ∆G'° — это сумма ∆G'° разрыва этих связей, т. е. -45,6 кДж/моль + (-19,2) кДж/моль:
АТР + 2Н2O —> AMP +2Pi
∆G'° = -64,8 кДж/моль
Дополнение 13-1. ATP поставляет энергию для светляков
Для биолюминесценции требуются значительные количества энергии. Светляки используют АТР в ряде реакций, преобразующих химическую энергию в световую. В 1950-х гг. Уильям МакЭлрой с коллегами из Университета Джона Хопкинса выделил из нескольких тысяч светляков, собранных детьми в Балтиморе и его окрестностях, главных участников этих энергетических процессов: карбоновую кислоту люциферин и фермент люциферазу. Для генерации вспышки света требуется активация люциферина, при которой происходит пирофосфатное расщепление АТР и образование люцифериладенилата (рис. 1). В присутствии молекулярного кислорода и люциферазы люциферин подвергается многостадийному окислительному декарбоксилированию до (гидр)оксилюциферина, что сопровождается излучением света. Цвет световых вспышек различается в зависимости от вида светляков и, по-видимому, обусловлен различиями в структуре люциферазы. Люциферин регенерируется из гидроксилюциферина в серии последующих реакций.
Рис. 1. Важнейшие составляющие цикла биолюминисценции у светляка
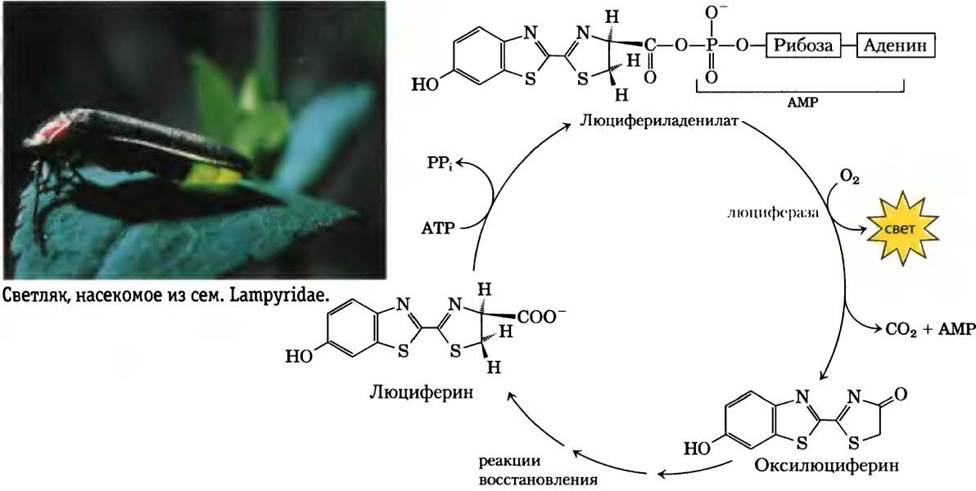
В лаборатории, очищенные люциферин и люцифераза светляков используются для измерения очень малых количеств АТР по интенсивности генерируемой световой вспышки; можно измерить количества АТР порядка нескольких пикомолей (10-12 моль). В углубленных исследованиях люциферазы было проведено клонирование соответствующего гена в растениях табака. Когда такие растения поливали раствором, содержащим люциферин, они светились в темноте (см. рис. 9-29).
Активация аминокислот перед их полимеризацией в белки (см. рис. 27-19) осуществляется аналогичным набором реакций, в которых кофермент А заменяет молекула транспортной РНК. Интересное использование расщепления АТР до АМР и PPi происходит у светляков, которые используют АТР в качестве источника энергии для генерации световых вспышек (доп. 13-1).
Для сборки информационных макромолекул необходима энергия
При сборке макромолекул ДНК, РНК, белков (т. е. биополимеров) из простых молекул-предшественников, о чем подробно говорится в третьем томе, необходима энергия как для конденсации мономерных единиц, так и для создания упорядоченных последовательностей. Предшественниками ДНК и РНК в биосинтезе служат нуклеозид- трифосфаты; при этом реакция полимеризации сопровождается расщеплением фосфоангидридной связи между α- и β-фосфатами и высвобождением PPi (рис. 13-21). В этих реакциях при синтезе РНК остатками, переносимыми на растущий биополимер, являются аденилат (АМР), гуанилат (GMP), цитидилат (СМР) или уридилат (UMP), а при синтезе ДНК их дезокси-аналоги (с ТМР вместо UMP). Как отмечалось выше, при активации аминокислот, необходимой для синтеза белка, происходит перенос аденилатных групп от АТР; кроме того, как мы увидим в гл. 27, эти несколько стадий белкового синтеза сопровождаются еще и гидролизом GTP. Во всех перечисленных случаях экзергонический распад нуклеозидтрифосфата сопряжен с эндергоническим синтезом биополимера с определенной последовательностью.
АТР обеспечивает энергию для активного транспорта и для сокращения мышц
АТР может поставлять энергию для переноса иона (или молекулы) через мембрану в другой водный компартмент, где его (ее) соответствующая концентрация выше (см. рис. 11-38). Процессы, связанные с транспортом веществ, являются главными потребителями энергии. Например, в почках и мозге человека две трети энергии, потребляемой в состоянии покоя, идет на перекачивание Na+ и К+ через плазматические мембраны с помощью Na+/K+-ATPaзы. Транспорт Na+ и К+ сопровождается циклическим фосфорилированием- дефосфорилированием транспортного белка, а в качестве донора фосфорильной группы участвует АТР (см. рис. 11-37). Na+-зависимое фосфорилирование Na+/K+-АТРазы вызывает изменение конформации белка, а К+-зависимое дефосфорилирование возвращает его в первоначальное состояние. Каждый цикл процесса транспорта сопровождается расщеплением АТР до ADP и Рi, при этом изменение свободной энергии гидролиза АТР приводит к циклическим изменениям конформации белка, в результате чего происходит электрогенное перекачивание ионов Na+ и К+. Заметим, что в этом случае фосфорильная группа от АТР переносится на молекулу фермента, а не субстрата.
В клетках сократительной системы скелетных мышц миозин и актин специализируются на преобразовании химической энергии АТР в механическую (движение) (см. рис. 5-31). АТР прочно связывается (но не ковалентными связями) с одной из конформаций миозина, удерживая белок в этом состоянии. Когда миозин катализирует гидролиз связанного с ним АТР, от белка отщепляются ADP и Pi; и это вновь приводит к изменению конформации белковой молекулы, в которой она и находится до присоединения другой молекулы АТР. Связывание и последующий гидролиз АТР (посредством миозин-АТРазы) поставляет энергию, которая вызывает циклические изменения конформации головки миозина. Изменение конформации многих отдельных молекул миозина приводит к скольжению миозиновых фибрилл вдоль актиновых филаментов (см. рис. 5-30), что и обеспечивает макроскопическое сокращение мышечного волокна.
Как мы уже отмечали ранее, при расходовании АТР осуществление механического движения — это один из немногих случаев, при которых источником химической энергии в сопряженном процессе скорее является сама реакция гидролиза АТР, а не перенос групп от АТР.
Во всех типах клеток происходит трансфосфорилирование между нуклеотидами
Хотя мы сосредоточили свое внимание на АТР как основном переносчике энергии в клетке и доноре фосфатных групп, все другие нуклеозидтрифосфаты (GTP, UTP, СТР) и все дезоксинуклеозидтрифосфаты (dATP, dGTP, dUTP, dCTP) энергетически эквивалентны АТР. Изменение свободной энергии при гидролизе фосфоангидридных связей этих соединений почти совпадает с величинами для АТР, приведенными в табл. 13-6. Для выполнения различных биологических функций эти нуклеотиды создаются и сохраняются в виде нуклеозидтрифосфатных форм (NTP) путем переноса фосфорильной группы на соответствующие нуклеозиддифосфаты (NDP) и монофосфаты (NMP).
ATP — важное высокоэнергетическое фосфатное соединение, которое образуется в процессах катаболизма, таких как гликолиз, окислительное фосфорилирование, а в фотосинтетических клетках — фотофосфорилирование. Затем с помощью некоторых ферментов осуществляется перенос фосфорильных групп от АТР к другим нуклеотидам. Нуклеозиддифосфаткиназы, обнаруженные во всех клетках, катализируют следующую реакцию:
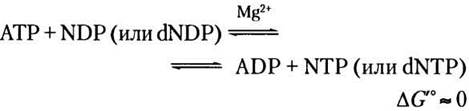
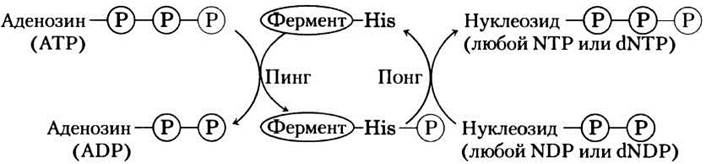
Хотя эта реакция обратима, относительно высокое значение отношения [ATP]/[ADP] в клетках в норме способствует протеканию реакции слева направо с образованием NTPи dNTP На самом деле фермент катализирует двухстадийный процесс передачи фосфорильной группы — классический механизм двойного замещения (механизм «пинг-понг»; рис. 13-21, см. также рис. 6-13, б). Сначала, происходит перенос фосфорильной группы от АТР к активному участку гистидинового остатка фермента с образованием промежуточного фосфорилированного фермента; затем фосфорильная группа от этого соединения переносится на акцептор NDP. Поскольку фермент неспецифичен к основанию в NDP и одинаково хорошо работает и с dNDP, и с NDP, в присутствии АТР он способен синтезировать все NTP и dNTP из соответствующих NDP.
Рис. 13-21. «Пинг-понг»-механизм работы нуклеозиддифосфаткиназы. Сначала фермент связывается с субстратом (АТР в нашем примере) и фосфорильная группа от АТР переносится на боковую цепь остатка гистидина. Происходит высвобождение ADP и его место занимает другой нуклеозиддифосфат (или дезоксинуклеозиддифосфат), который превращается в соответствующий трифосфат в результате переноса фосфорильной группы от фосфогистидинового остатка.
Переносы фосфорильных групп от АТР приводят к накоплению ADP. Например, при энергичном мышечном сокращении происходит накопление ADP, что препятствует АТР-зависимому сокращению. В периоды острой потребности АТР в клетках понижается концентрация ADP и в то же время под действием аденилаткиназы накапливается АТР.
![]()
Эта реакция обратима, поэтому после того как острая необходимость в АТР пропадает, фермент может снова превращать АМР в ADP, а последний затем может фосфорилироваться в митохондриях до АТР. Аналогичный фермент гуанилаткина- за превращает GMP в GDP за счет расходования АТР. Подобным образом энергия, запасенная в процессе катаболического образования АТР, используется для обеспечения клетки необходимым количеством NTP и dNTP.
Готовым источником фосфорильных групп для быстрого синтеза АТР из ADP служит креатинфосфат (рис. 13-15). Концентрация креатинфосфата (РСr) в скелетных мышцах составляет приблизительно 30 мМ, что почти в 10 раз превышает концентрацию АТР. В других тканях, таких как гладкая мускулатура, мозг и почки, концентрация РСг составляет от 5 до 10 мМ. Обратимая реакция переноса фосфорильной группы от креатинфосфата к ADP катализируется креатинкиназой
![]()
Креатинфосфат служит резервуаром фосфорильных групп в тех случаях, когда из-за неожиданной потребности в энергии истощаются запасы АТР; при этом восстановление АТР происходит значительно быстрее, чем при катаболическом синтезе. Когда же потребность в энергии ослабевает, образуемые в процессах катаболизма молекулы АТР используются для пополнения запасов РСr в обратной креатинкиназной реакции. У низших в филогенетическом отношении организмов в качестве резервуаров фосфорильных групп служат другие РСr- подобные молекулы, которые носят общее название фосфагенов.
Неорганические полифосфаты — потенциальные доноры фосфорильных групп
Неорганические полифосфаты polyP (или (роlуР)n, где n — число ортофосфатных групп) представляют собой линейные полимеры, состоящие из многих десятков или сотен остатков Pi, связанных друг с другом фосфоангидридными связями. Эти вещества, присутствующие во всех организмах, в некоторых клетках могут накапливаться в больших количествах. Например, у дрожжей концентрация polyP, аккумулирующихся в вакуоли, при равномерном распределении по всей клетке составила бы 20 мМ. (Ср. с концентрациями других доноров фосфорильных групп, см. табл. 13-5.)
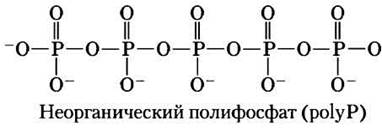
Потенциальная роль polyP заключается в том, что он может служить в качестве фосфагена, т. е. резервуара фосфорильных групп для производства молекул АТР, так же, как креатинфосфат используется в мышцах. PolyP обладает примерно таким же потенциалом (энергией) переноса фосфорильной группы, как и PPi. Самый короткий полифосфат PPi (n = 2) служит в качестве источника энергии для активного транспорта в вакуолях растений. У растений пирофосфат PPi служит донором фосфатной группы, по крайней мере для одного фермента — фосфофруктокиназы, т. е. он играет ту же роль, что АТР у животных и микроорганизмов (с. 73). Обнаружение высоких концентраций ро1уР в вулканических конденсатах и выбросах пара наводит на мысль, что он мог служить источником энергии в добиологической и ранней клеточной эволюции.
У бактерий фермент полифосфаткиназа-1 (РРК-1) катализирует обратимую реакцию

по механизму, в котором в качестве промежуточного продукта принимает участие связанный с ферментом фосфогистидин (вспомните механизм действия нуклеозиддифосфаткиназы, описанный выше). Другой фермент полифосфаткиназа-2 (РРК-2) катализирует обратимый синтез GTP (или АТР) из полифосфата и GDP (или ADP)
![]()
Полагают, что РРК-2 действует главным образом в направлении синтеза GTP и АТР, а РРК-1 — в направлении синтеза полифосфатов. Киназы РРК-1 и РРК-2 присутствуют в клетках различных бактерий, включая многие патогенные виды.
Как было показано, у бактерий повышенный уровень polyP стимулирует экспрессию ряда генов, отвечающих за адаптацию организма к условиям голодания и другим угрожающим жизни условиям. Например, у Escherichia coli polyP накапливаются, когда клеткам не хватает аминокислот или Pi, и этот запас способствует их выживанию в этих неблагоприятных условиях. Делении генов полифосфаткиназ снижают способность некоторых патогенных бактерий к поражению тканей животных. Поэтому фермент может оказаться уязвимой мишенью при разработке новых противомикробных лекарственных препаратов.
У дрожжей нет гена, кодирующего РРК- подобный белок, однако есть четыре гена (не имеющие отношения к генам РРК у бактерий), которые необходимы для синтеза полифосфатов. По-видимому, механизм полифосфатного синтеза у эукариот совершенно иной, чем у прокариот.
Краткое содержание раздела 13.3 Перенос фосфорильных групп и АТР
■ Аденозинтрифосфат (АТР) связывает процессы катаболизма и анаболизма. Это химическое соединение — энергетическая «валюта» живой клетки. Экзергоническое превращение АТР в ADP и Pi или в АМР и PPi сопряжено со многими эндергоническими реакциями.
■ Гидролиз АТР служит источником энергии для конформационных изменений, приводящих к сокращению мышц. Однако обычно не гидролиз молекулы АТР, а перенос фосфорильной, пирофосфорильной или аденилильной группы от АТР к молекуле субстрата или фермента участвует в энергетическом сопряжении распада АТР и эндергонических превращений субстратов.
■ Благодаря этим реакциям переноса групп АТР обеспечивает энергией анаболические реакции, включая синтез информационных молекул, а также транспорт молекул и ионов через мембраны против градиента концентраций и градиента электрического потенциала.
■ Для поддержания способности к переносу фосфатных групп концентрация АТР должна быть намного выше равновесной концентрации, что достигается в реакциях катаболизма, сопровождающихся производством энергии.
■ В клетках содержатся и другие метаболиты, имеющие большие по абсолютной величине отрицательные свободные энергии гидролиза, в их числе фосфоенолпируват, 1,3-бис-фосфоглицерат и креатинфосфат. Эти высокоэнергетические соединения с высоким потенциалом переноса фосфорильной группы, подобные АТР, — хорошие доноры фосфорильных групп. Тиоэфиры также характеризуются высокими свободными энергиями гидролиза.
■ Неорганические полифосфаты, присутствующие во всех клетках и имеющие высокий потенциал переноса групп, могут служить в качестве резервуара фосфорильных групп.