ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
19. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ И ФОТОФОСФОРИЛИРОВАНИЕ
19.10. Эволюция оксигенного фотосинтеза
Появление на Земле оксигенного фотосинтеза 2,5 млрд лет тому назад было ключевым событием в эволюции биосферы. До этого времени Земля практически не имела молекулярного кислорода и озонового слоя, защищающего живые организмы от ультрафиолетового излучения Солнца. Оксигенный фотосинтез служит практически неисчерпаемым источником восстанавливающих агентов, осуществляющих образование органических соединений в ходе восстановительных реакций биосинтеза. Соответствующие механизмы реакций позволяют организмам использовать O2 в качестве конечного акцептора электронов в высокоэнергетических реакциях с электронным переносом от органических веществ, а энергию окисления — для поддержания собственного метаболизма. Сложный фотосинтетический аппарат современных сосудистых растений — это высшее достижение эволюции; позднее установились связи между эукариотическими клетками и цианобактериями в качестве эндосимбионтов.
Хлоропласты возникли в результате эволюционного развития эндосимбиоза бактерий
Хлоропласты современных организмов по некоторым свойствам напоминают митохондрии; считается, что они были образованы в результате действия того же механизма, что привел к появлению митохондрий, а именно, эндосимбиоза. Подобно митохондриям, хлоропласты имеют свой собственный набор генов в молекулах ДНК и белоксинтезирующую систему. Некоторые белки хлоропластов кодируются хлоропластными генами и синтезируются в хлоропластах, другие — кодируются генами ядерной ДНК, синтезируются за пределами хлоропластов и затем переносятся в хлоропласты. Подробно эти вопросы рассматриваются в гл. 27 (т. 3). Рост и деление клеток растения вызывает деление хлоропластов, вовремя которого происходит репликация ДНК и распределение ее между дочерними клетками хлоропластов. Молекулярный аппарат и механизм поглощения энергии света, система для переноса потока электронов и синтеза АТР у фотосинтезирующих бактерий и хлоропластов во многом очень похожи. На основании этих данных возникла получившая в настоящее время широкое распространение гипотеза эндосимбиотического происхождения хлоропластов, согласно которой современные клетки растений происходят от фотосинтезирующих бактерий, проникших когда-то в эукариотические клетки и закрепившихся в них в процессе эволюции (см. рис. 1-36, т. 1).
Не менее половины всего фотосинтеза на Земле осуществляется микроорганизмами — водорослями, низшими формами эукариот и фотосинтезирующими бактериями. У цианобактерий кислород-образующая система сходна с той, которая есть у зеленых растений, — это согласованно работающие фотосистемы II и I, одна из которых включает водорасщепляющий комплекс. У всех остальных фотосинтезирующих бактерий одна фотосистема, они не расщепляют воду и не образуют кислород. Более того, многие фотосинтезирующие бактерии — облигатные анаэробы, т. е. вообще не переносят кислорода, а в качестве донора электронов (водорода) вместо воды используют неорганические соединения. Например, у зеленых серных бактерий донором водорода служит сероводород
![]()
Эти бактерии выделяют вместо молекулярного кислорода элементную серу — продукт окисления Н2S. Сера затем окисляется до SО2-4. Другие фотосинтезирующие бактерии используют в качестве донора электронов (водорода) органические соединения, например, лактат:
![]()
Накопленный фактический материал свидетельствует о том, что у растений и бактерий процессы фотосинтеза в основе своей одинаковы, хотя в них используются разные доноры водорода. Сходство это становится явным, если написать уравнение фотосинтеза в более общей форме:
![]()
где H2D — донор водорода, D — окисленная форма этого донора. Роль H2D могут играть вода, сероводород, лактат или другие органические соединения в зависимости от вида фотосинтезирующего организма. Наиболее вероятно, что на Земле первыми фотосинтезирующими организмами были бактерии, которые использовали H2S как донор электронов.
Древние родственники современных цианобактерий, возможно, возникли в результате комбинации генетического материала от двух видов фотосинтезирующих бактерий, которые сохранились до наших дней — у пурпурных бактерий (с электронным транспортом, как в ФСII) и зеленых серных бактерий (с электронным транспортом, как в ФСI). Бактерии с двумя независимыми фотосистемами могут использовать одну из них при одних условиях, а другую — при других. Со временем появился механизм, связывающий две фотосистемы и позволяющий использовать обе системы одновременно; система, подобная ФСII, у современных цианобактерий способна расщеплять молекулу воды.
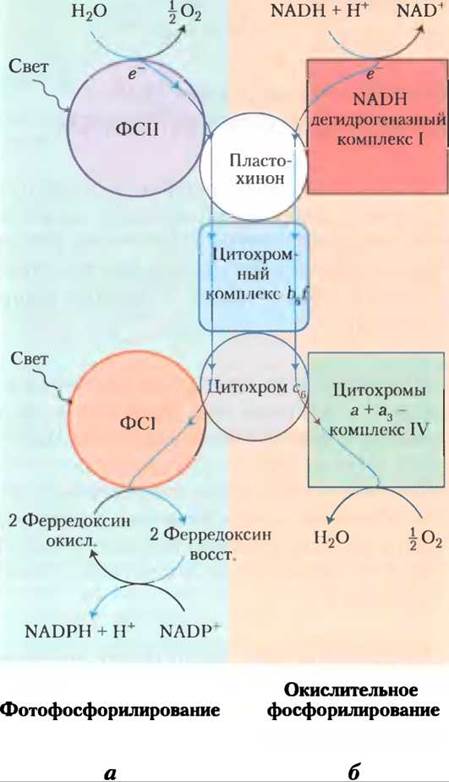
Современные цианобактерии могут синтезировать АТР в процессе окислительного фосфорилирования или в процессе фотофосфорилирования, хотя у них нет ни митохондрий, ни хлоропластов. Ферментативный аппарат, необходимый для осуществления обоих процессов, сосредоточен в сильноизвитой плазматической мембране (см. рис. 1-6, т. 1). В обоих случаях функционируют три белковых компонента, что указывает на общее эволюционное происхождение этих процессов (рис. 19-65). Во-первых, цитохромный комплекс b6f прокачивает протоны от пластохинона на цитохром с6 в процессе фотосинтеза, а также от убихинона на цитохром с6 в процессе окислительного фосфорилирования (в митохондриях эту роль выполняет цитохром bс1). Во-вторых, цитохром с6, гомологичный митохондриальному цитохрому с, переносит электроны от комплекса III к комплексу IV у цианобактерий; он также может переносить электроны от цитохромного комплекса b6f к ФСI (в растениях эту роль выполняет пластоцианин). Таким образом, наблюдается функциональная гомология между цитохромным комплексом b6f цианобактерий и митохондриальным цитохромным комплексом bс1, а также между цитохромом с6 цианобактерий и пластоцианином растений. Третий консервативный компонент системы — это ATP-синтаза, которая принимает участие в окислительном фосфорилировании и фотофосфорилировании цианобактерий, и присутствует в митохондриях и хлоропластах фотосинтезирующих эукариот. Строение и удивительный механизм действия этого фермента полностью сохранились в процессе эволюции.
Рис. 19-65. Двоякая роль цитохрома b6f и цитохрома сб у цианобактерий отражает их эволюционное происхождение. Цианобактерии используют цитохром b6f, цитохром с6 и пластохинон как для окислительного фосфорилирования, так и для фотофосфорилирования. а — при фотофосфорилировании электроны переходят (сверху вниз) от воды к NADР+. б — при окислительном фосфорилировании электроны переходят от NADР к O2. Оба процесса сопровождаются переносом протонов через мембрану в реакциях Q-цикла.
У галофильных бактерий один и тот же белок поглощает энергию солнечного света и перекачивает протоны из клетки, создавая движущую силу для синтеза АТР
У некоторых современных архей реализуется несколько иной механизм превращения энергии света в электрохимический градиент. Древняя сохранившаяся в ходе эволюционного развития галофильная (любящая соль) бактерия Halobacterium salinarum запасает энергию солнечного света совершенно иным способом, нежели это делают истинные фотосинтезирующие организмы. Эта своеобразная бактерия обитает только в водоемах с соленой водой (прудах и соляных озерах, например, в Большом Солёном озере и в Мёртвом море), т. е. там, где из-за испарения воды концентрация соли может превышать 4 М. Эти бактерии вообще не способны существовать при концентрациях NaCl ниже 3 М. Будучи аэробами, они обычно используют для окисления своего органического «топлива» кислород. Однако в воде соляных водоемов растворимость кислорода очень низкая. Поэтому галофильным бактериям иногда приходится использовать другой источник энергии — солнечный свет.
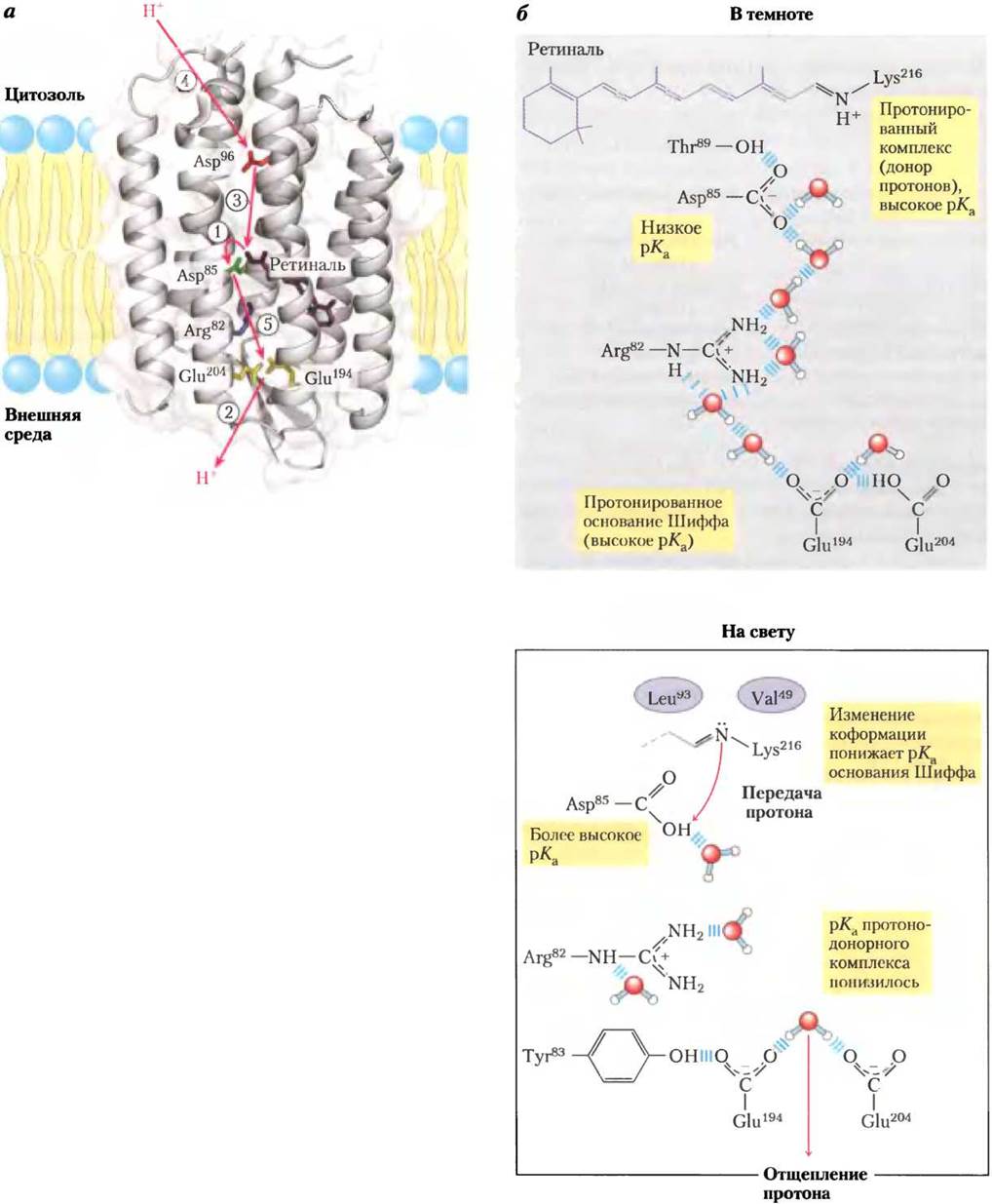
В цитоплазматической мембране бактерии Н. salinarum имеются скопления светопоглощающих пигментов, состоящие из молекул белка бактериородопсина, содержащего в качестве простетической группы остаток ретиналя — альдегида витамина А (см. рис. 10-21, т. 1). При освещении полностью транс-ретиналь, связанный с бактериородопсином, поглощает фотон и претерпевают фотоизомеризацию в 13-цис- ретиналь. При возвращении в первоначальную полностью транс-конфигурацию выделяется энергия, которая используется на перекачивание протонов из клетки в наружную среду. Молекула бактериородопсина состоит всего лишь из 247 аминокислотных остатков и выполняет функцию простейшего белкового насоса, который под действием света выкачивает протоны наружу. На рис. 19-66, а изображена трехмерная структура бактериородопсина в темноте и на свету и показан путь протонов через мембрану путем последовательности согласованных «прыжков». В бактериородопсине хромофор ретиналь присоединен к ε-аминогруппе остатка Lys через шиффово основание. В темноте атом азота в шиффовом основании протонируется. На свету происходит фотоизомеризация ретиналя, в результате чего рКашиффова основания понижается и от атома N отщепляется протон, который присоединяется к соседнему остатку Asp. Происходит серия протонных «прыжков» — в результате протон переходит с внешней поверхности мембраны в наружную среду, что приводит к возникновению трансмембранного градиента pH с более кислой средой снаружи (рис. 19-66, в).
Рис.19-66. Эволюция второго механизма перекачивания протонов за счет энергии света у галофильных архей. а — бактериородопсин (Мr = 26 000) Halobacterium halobiumсодержит семь а-спиралей, пронизывающих мембрану (PDB ID 1C8R). Хромофор полностью транс- ретиналь (окрашен в пурпурный цвет) соединен с ε-аминогруппой остатка Lys, образуя шиффово основание внутри мембраны. Остатки Asp и Glu в α-спиралях и несколько координированных молекул воды обеспечивают скачки протонов при транспорте через мембрану (показано красными стрелками). В стадиях от (1) до (5) происходит перемещение протонов, что обсуждается далее. б — в темноте (справа верху) шиффово основание, связывающее хромофор бактериородопсина с остатком Lys, протонируется. На свету (справа внизу) в результате фотоизомеризации ретиналя происходят небольшие конформационные изменения белка — меняются расстояния между шиффовым основанием и ближайшими к нему аминокислотными остатками, что вызывает понижение рКа шиффова основания и отщепление от него протона, который передается на карбонильную группу соседнего остатка Asp85. Этот процесс ((1) на рис. а) индуцирует перенос протона «прыжками» по молекулам воды, координированным внутри белка, и в итоге (стадия (2)) приводит к отщеплению протона от двух аминокислотных остатков Glu194-Glu204 на внешней поверхности клетки. Далее (стадия (3)) шиффово основание вновь присоединяет протон, отщепленный от Asp96, который в свою очередь получает протон из цитозоля (стадия (4)). Наконец Asp85 отдает протон паре аминокислотных остатков Glu204-Glu194 (стадия (5)), и в системе начинается новый цикл перекачивания протонов через мембрану в наружную среду.
Поскольку концентрация ионов Н+ снаружи оказывается выше, чем внутри, эти ионы стремятся диффундировать обратно в клетку через находящиеся в мембране молекулы фермента АТР-синтазы, похожей на АТР-синтазу митохондрий и хлоропластов. Проходя через эту бактериальную АТРазу, ионы Н+ отдают свою энергию, которая используется для синтеза АТР из ADP и фосфата. Таким способом галофильные бактерии при отсутствии О2 запасают световую энергию в форме АТР в дополнение к АТР, синтезированному путем окислительного фосфорилирования при наличии кислорода. Однако галофильные бактерии не выделяют кислород и не осуществляют фотовосстановление NADP+. Процессы светозависимого преобразования энергии у галофильных бактерий проще, чем у цианобактерий или растений. Можно надеяться, что знакомство с молекулярной структурой и механизмом действия бактериородопсина — самого простого из всех известных белковых насосов, перекачивающих ионы Н+ за счет энергии света, позволит лучше понять работу более сложных Н+-насосов. Бактериородопсин
Краткое содержание раздела 19.10 Эволюция оксигенного фотосинтеза
■ Современные цианобактерии произошли от древнего организма, обладавшего двумя фотосистемами: систему одного типа сегодня можно обнаружить в пурпурных бактериях, систему другого типа — в зеленых серных бактериях.
■ Многие фотосинтезирующие организмы получают электроны для фотосинтеза не из воды, а от других доноров, таких как H2S.
■ Цианобактерии с двумя сопряженными фотосистемами и способностью расщеплять молекулу воды с выделением кислорода в атмосферу появились на Земле около 2,5 млрд лет назад.
■ Хлоропласты, как и митохондрии, произошли в результате эволюционного развития эндосимбиоза с бактериями, внедрившимися когда-то в клетки древних эукариот. Поэтому у бактерий, цианобактерий, митохондрий и хлоропластов есть общий предшественник ATP-синтазного ферментативного комплекса и, следовательно, общий механизм каталитического действия.
■ Совершенно другой механизм превращения световой энергии в градиент протонов возник у современных архей, у которых функцию светопоглощающего пигмента выполняет ретиналь.