ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
...открытие Самуэлем Рубеном и Мартином Каменом в 1940 г. долгоживущего изотопа углерода 14С дало идеальный метод для отслеживания маршрута, который совершает углекислый газ, проходя свой путь до углевода.
Мелвин Кальвин, Нобелевская речь, 1961
20. БИОСИНТЕЗ УГЛЕВОДОВ У РАСТЕНИЙ И БАКТЕРИЙ
Сейчас мы достигли поворотной точки в изучении клеточного метаболизма. До сих пор в этой части книги (часть II) мы описали, как углеводы, жирные кислоты и аминокислоты — главное метаболическое топливо — распадаются в сходящихся катаболических путях для того, чтобы попасть в цикл трикарбоновых кислот и передать свои электроны в дыхательную цепь; и как этот экзотермический поток электронов к кислороду сопряжен с эндотермическим синтезом АТР. Теперь рассмотрим анаболические пути, которые используют химическую энергию в форме АТР и NADH или NADPH для синтеза клеточных компонентов из простых молекул-предшественников. Анаболические пути в целом восстановительные, а не окислительные. Катаболизм и анаболизм происходят одновременно, поэтому в динамиче
ски устойчивом состоянии распад с выделением энергии соединений, содержащихся в клетке, уравновешен биосинтетическими процессами, которые создают и поддерживают упорядоченность живых клеток.
Растения должны быть самыми универсальными живыми системами в метаболизме углеводов по нескольким причинам. Во-первых, как автотрофы растения способны превращать неорганический углерод (такой, как СO2) в органические соединения. Во-вторых, биосинтез происходит в основном в пластидах — ограниченных мембраной органеллах, свойственных растениям, а передвижение интермедиатов между компартаментами клетки — важный аспект метаболизма. В-третьих, растения неподвижны: они не могут передвигаться в поисках более доступной воды, солнечного света или нитратов. Они должны иметь достаточную метаболическую лабильность, которая позволила бы им адаптироваться к изменяющимся условиям того места, где они растут. Наконец, у растений многослойная клеточная стенка состоит из высокомолекулярных углеводов (природных биополимеров); она должна собираться с наружной стороны плазматической мембраны, причем на нее приходится значительная часть всех углеводов клетки.
Мы начнем главу с описания процессов, благодаря которым СO2 превращается в триозы и гексозы, затем рассмотрим фотодыхание — важную побочную реакцию в процессе фиксации СO2, а также пути, по которым некоторые растения избегают этой побочной реакции. Затем мы посмотрим, как биосинтез сахарозы (для транспорта сахаров) и крахмала (для запасания энергии) совершается по механизмам, аналогичным тем, что животные используют при синтезе гликогена. Следующая обсуждаемая тема — синтез целлюлозы растительной клеточной стенки и пептидогликана бактериальной клеточной стенки — иллюстрирует проблемы энергетически зависимого биосинтеза с наружной стороны плазматической мембраны. В заключение, мы обсудим, как различные пути, использующие пулы общих интермедиатов, разделенных в пределах органелл, в итоге объединяются друг с другом.
20.1. Фотосинтез углеводов
Для синтеза углеводов в животной клетке всегда используются предшественники, имеющие хотя бы три атома углерода, которые окислены менее, чем углерод в СO2. В отличие от этого, растения и фотосинтезирующие микроорганизмы могут синтезировать углеводы из СO2 и воды, восстанавливая СO2 с расходом энергии АТР и NADPH, получаемых в результате светозависимых реакций фотосинтеза (рис. 20-1). Растения (и другие автотрофы) могут использовать СO2 в качестве единственного источника атомов углерода, необходимых для биосинтеза целлюлозы и крахмала, липидов, белков, и многих других органических компонентов растительной клетки. В отличие от них, гетеротрофы не могут осуществлять реакции восстановления СO2 для синтеза глюкозы.
Рис. 20-1. Включение СO2 в биомассу растений. Светозависимый синтез NADPH и АТР, описанный в гл. 19, поставляет энергию и восстановительный потенциал для фиксации СO2 в триозы, из которых синтезируются все углеродсодержащие соединения растительной клетки. Этот процесс (показан красными стрелками) подробно обсуждается в данной главе.
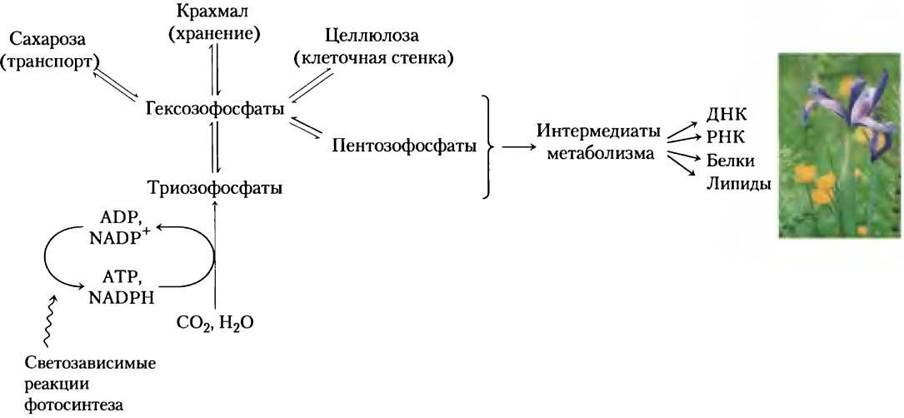
Зеленые растения содержат в своих хлоропластах уникальный ферментный комплекс, катализирующий превращение СO2 в простые (восстановленные) органические соединения. Этот процесс называется ассимиляцией СO2, фиксацией СO2 или фиксацией углерода. Мы будем использовать эти термины для специфической реакции, в которой СO2 включается (фиксируется) в трехуглеродное — триозофосфат-3-фосфоглицерат. Этот простой продукт фотосинтеза — предшественник более сложных биомолекул (сахаров, полисахаридов и метаболитов), которые синтезируются в метаболических путях, похожих на аналогичные в животных тканях. Диоксид углерода СO2 ассимилируется через циклический путь; его ключевые интермедиаты постоянно возобновляются. Этот путь был расшифрован в начале 1950-х гг. Мелвином Кальвином, Эндрю Бенсоном и Джеймсом А. Басшамом, и часто называется циклом Кальвина или, более описательно, циклом фотосинтетического восстановления углерода.
Мелвин Кальвин, 1911-1997

Метаболизм углеводов в растительных клетках более сложен, чем в животных клетках или нефотосинтезирующих микроорганизмах. В дополнение к общим путям гликолиза и глюконеогенеза растения осуществляют уникальную последовательность реакций для восстановления СO2 до триозофосфатов и связанный с ней восстановительный пентозофосфатный путь; все эти реакции должны согласованно регулироваться с целью правильного распределения атомов углерода между реакциями, продуцирующими энергию, и реакциями синтеза крахмала и сахарозы. Как мы увидим, ключевые ферменты регулируются (1) путем восстановления дисульфидных связей электронами, поступающими из фотосистемы I и (2) путем изменения pH и концентрации ионов магния, что происходит под действием света. Если посмотреть на другие аспекты метаболизма углеводов у растений, мы также найдем ферменты, которые управляются (3) путем обычного аллостерического регулирования одним или более метаболическими интермедиатами и (4) путем ковалентной модификации (фосфорилированием).
Пластиды — уникальные органеллы растительных клеток и водорослей
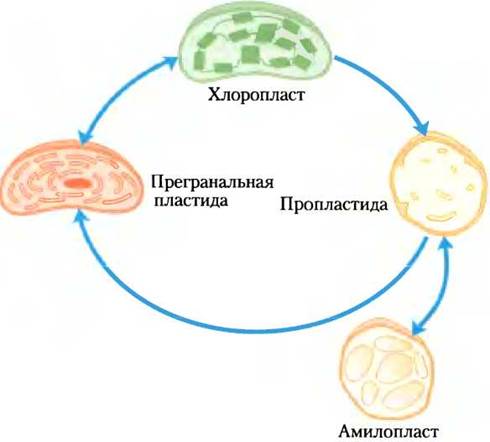
Большинство процессов биосинтеза растений (включая ассимиляцию СO2) происходит в пластидах — семействе самовоспроизводящихся органелл, ограниченных двойной мембраной и содержащих небольшой геном, который кодирует некоторые белки пластид. Белки, предназначенные для пластид, как правило, закодированы в ядерных генах, которые транскрибируются и транслируются, как другие ядерные гены; затем эти белки транспортируются в пластиды. Пластиды воспроизводятся делением надвое, реплицируя свой геном (единственную циклическую молекулу ДНК) и используя свои собственные ферменты и рибосомы для синтеза белков, кодированных в этом геноме. Хлоропласты(см. рис. 19-45) служат центрами ассимиляции СO2. Белки, необходимые для этого процесса, содержатся в строме — растворимой фазе, ограниченной внутренней мембраной хлоропласта. Амилопласты — это неокрашенные пластиды (в них нет хлорофилла и других пигментов, найденных в хлоропластах). У них нет внутренних мембранных аналогов фотосинтетических мембран (тилакоидов) хлоропластов, и в растительных тканях, богатых крахмалом, эти пластиды наполнены крахмальными зернами (рис. 20-2). Хлоропласты могут терять внутренние мембраны и хлорофилл и превращаться в пропластиды, а пропластиды могут переходить в амилопласты (рис. 20-3). В свою очередь и амилопласты, и пропластиды могут преобразоваться в хлоропласты. Относительное содержание пластид зависит от типа растительной ткани и интенсивности освещения. Клетки зеленых листьев богаты хлоропластами, а в нефотосинтезирующих тканях, таких как картофельные клубни, доминируют амилопласты, которые содержат большое количество крахмала.
Рис. 20-2. Крахмал (темные гранулы), окрашенный иодом, в амилопластах клеток корня лютика (Ranunculus). Диаметр гранул крахмала в различных клетках варьирует от 1 до 100 мкм.
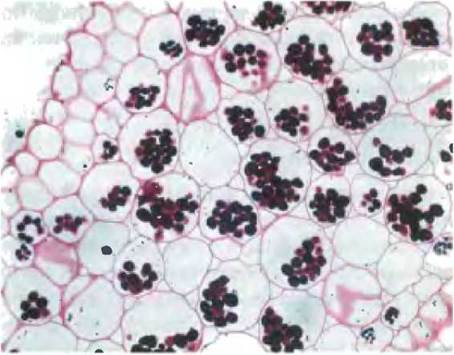
Рис. 20-3. Пластиды: происхождение и взаимопревращение. Пластиды всех типов ограничены двойной мембраной, а некоторые (особенно зрелые хлоропласта) несут дополнительные внутренние мембраны. Внутренние мембраны могут теряться (когда зрелый хлоропласт переходит в пропластиду) и синтезироваться вновь (как в пропластиде, которая становится прегранальной пластидой, а затем зрелым хлоропластом). Пропластиды в нефотосинтезирующих тканях (таких, как корень) превращаются в амилопласты, которые накапливают большое количество крахмала. Все растения содержат пластиды; в этих органеллах проходят такие важные процессы, как синтез аминокислот, тиамина, пиродоксальфосфата, флавинов и витаминов А, С, Е и К.
Внутренняя мембрана всех типов пластид непроницаема для полярных и заряженных молекул. Перенос через мембрану управляется набором специфических транспортеров.
Ассимиляция углекислого газа происходит в три стадии
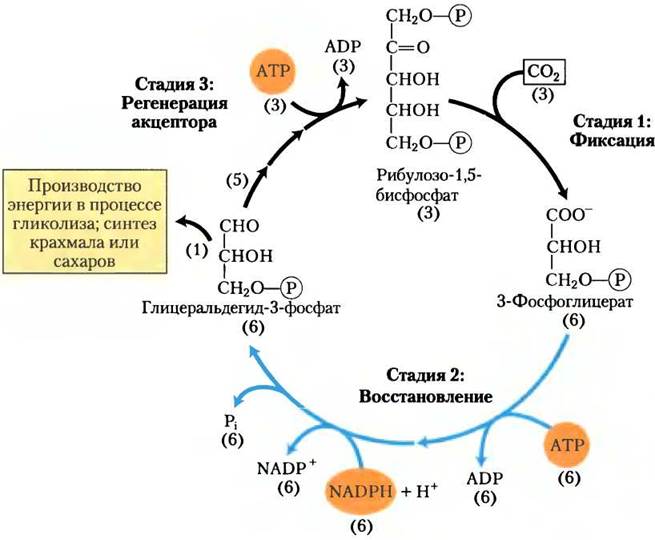
Первая стадия ассимиляции СO2 в биомолекулы (рис. 20-4) — реакция фиксации углерода: конденсация СO2 с пятиуглеродным акцептором рибулозо-1,5-бисфосфатом с образованием двух молекул 3-фосфоглицерата. На второй стадии 3-фосфоглицерат восстанавливается до триозо- фосфатов. В итогетри молекулы СO2 фиксируются в трех молекулах рибулозо-1,5-бисфосфатов, образуются шесть молекул глицеральдегид-3-фосфата (18 атомов углерода) в равновесии с дигидроксиацетонфосфатом. На третьей стадии пять из шести молекул триозофосфата (15 атомов углерода) используются для восстановления трех молекул рибулозо-1,5-бисфосфата (15 атомов), стартового соединения. Шестая молекула триозофосфата, конечного продукта фотосинтеза, может использоваться в синтезе гексоз — топливных и строительных материалов, сахарозы — для транспорта в нефотосинтезирующие ткани или крахмала — для запасания. Таким образом, весь процесс циклический, с постоянным превращением СO2 в триозо- или гексозофосфаты. Фруктозо- 6-фосфат — ключевой интермедиат на третьей стадии ассимиляции СO2; он находится в точке разветвления, ведущей либо к регенерации рибулозо-1,5-бисфосфата, либо к синтезу крахмала. Путь от гексозофосфата до пентозобисфосфата включает множество тех же самых реакций, которые используются в животных клетках для превращения пентозофосфатов в гексозофосфаты в неокислительной стадии пентозофосфатного пути (см. рис. 14-22). При фотосинтетической ассимиляции СO2 многие реакции идут в обратном направлении, превращая гексозофосфаты в пентозофосфаты. Этот восстановительный пентозофосфатный путьиспользует те же ферменты, что и окислительный путь, и несколько других ферментов, которые делают восстановительный цикл необратимым. Все 13 ферментов этого пути находятся в строме хлоропласта.
Рис. 20-4. Три стадии ассимиляции СO2 у фотосинтезирующих организмов. Стехиометрия (цифры в круглых скобках) трех ключевых интермедиатов определяет судьбу атомов углерода, которые входят в цикл и покидают его: три молекулы СO2 включены в углеродную цепь одной молекулы глицеральдегид-3-фосфата. Этот цикл называется циклом фотосинтетического восстановления углерода, или циклом Кальвина.
Стадия 1. Фиксация СO2 на 3-фосфоглицерате.
Главный секрет природы механизмов ассимиляции СO2 в фотосинтетических организмах был разгадан в конце 1940-х гг. Кальвин и его коллеги освещали суспензию зеленых водорослей в присутствии радиоактивно меченного диоксида углерода (14СO2) всего несколько секунд, затем быстро разрушали клетки, выделяли их содержимое, и хроматографическими методами определяли метаболиты, в которых впервые появлялся меченый углерод. Первым соединением, в котором обнаруживалась радиоактивная метка, был 3-фосфоглицерат, главным образом с 14С- карбоксилом. Эти эксперименты убедительно показывали, что именно 3-фосфоглицерат оказывается одним из первых интермедиатов в фотосинтезе. Растения, в которых это трехуглеродное соединение — первый интермедиат, называют С3- растениями, чтобы отличить их от С4-растений, которые описаны ниже.
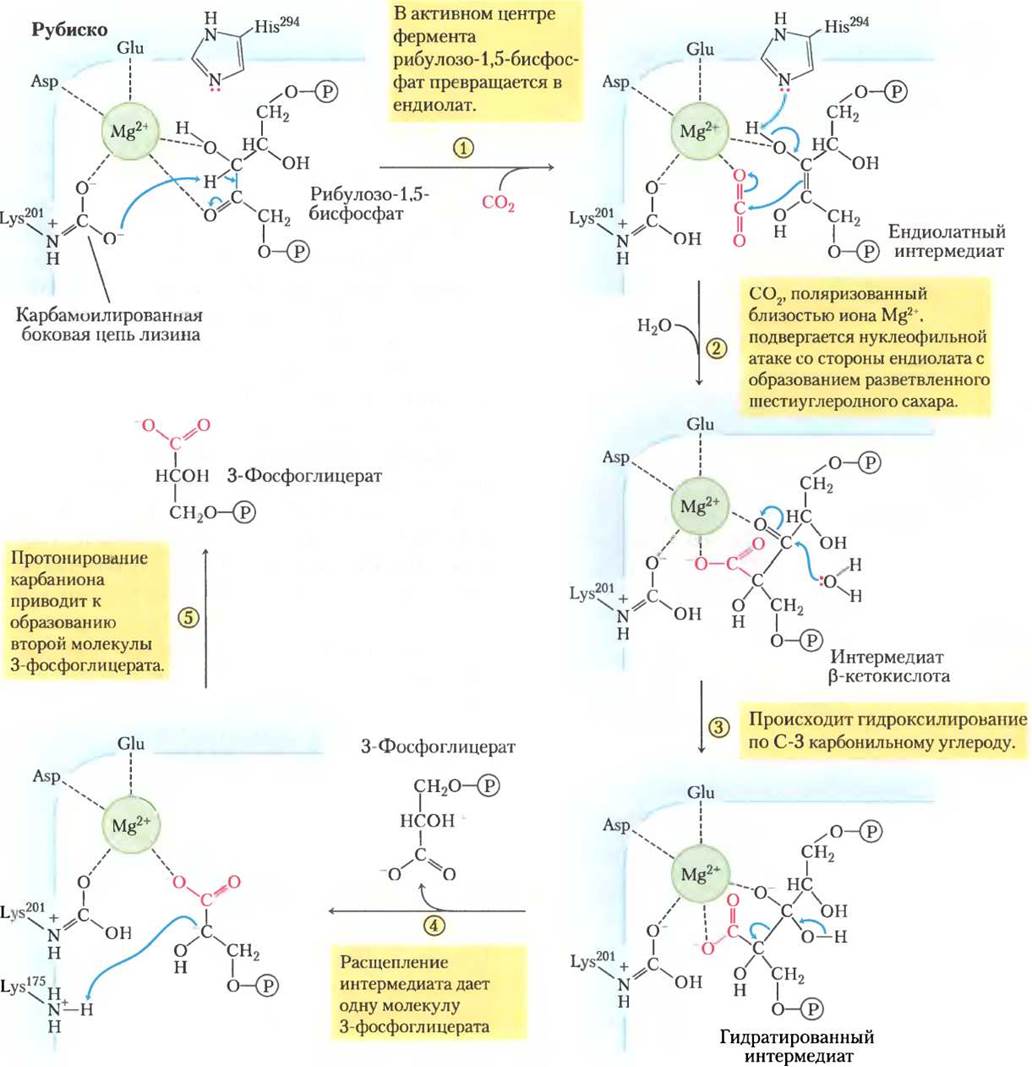
Включение СO2 в органические соединения катализирует фермент рибулозо-1,5-бис- фосфаткарбоксилаза/оксигеназа, сокращенно рубиско. Как карбоксилаза, рубиско катализирует ковалентное присоединение СO2 к пятиуглеродному сахару рибулозо-1,5-бисфосфату и расщепляет нестабильный шестиуглеродный интермедиат с образованием двух молекул 3-фосфоглицерата, одна из которых несет углерод, введенный как СO2 в карбоксигруппу (рис. 20-4). Оксигеназная активность фермента обсуждается в разд. 20.2.
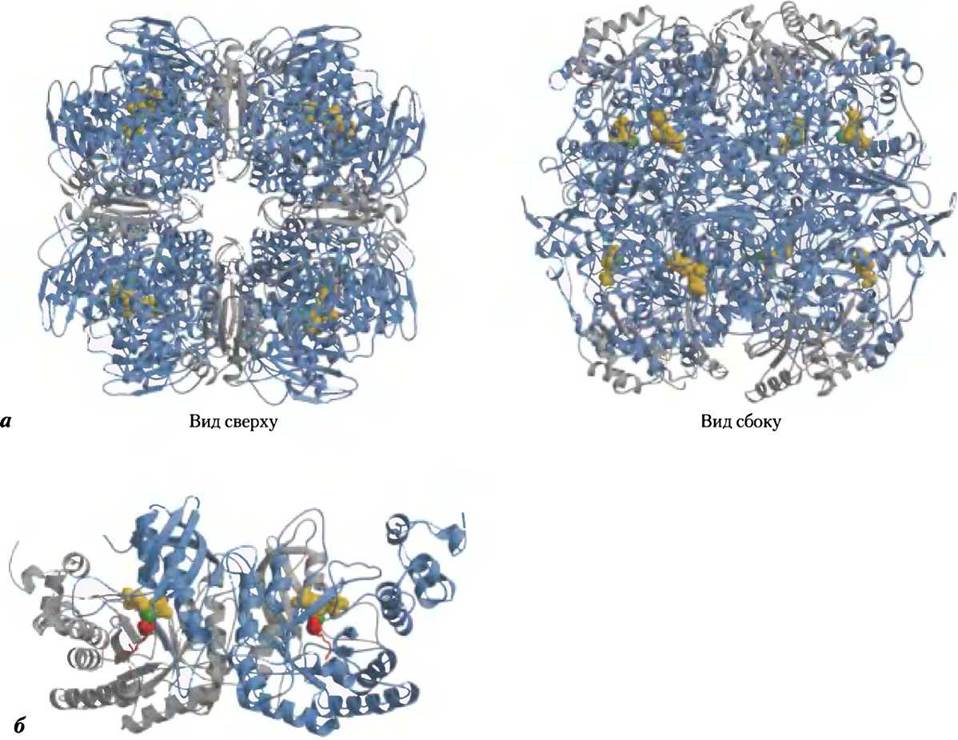
Существуют две разные формы рубиско. Форму I содержат сосудистые растения, водоросли и цианобактерии, а форма II есть только у фотосинтезирующих бактерий. Рубиско растений — ключевой фермент при образовании биомассы из СO2, он представлен формой I (рис. 20-5, а) — восемь идентичных больших субъединиц (Мг = 53 000; закодированы в геноме хлоропластов, или пластоме; каждая субъединица содержит каталитический центр) и восемь одинаковых малых субъединиц (Мr = 14 000; закодированы в ядерном геноме) с неопределенной функцией. Форма II рубиско фотосинтезирующих бактерий устроена проще; она содержит две субъединицы, которые во многом напоминают большие субъединицы растительного фермента (рис. 20-5, б). Это сходство согласуется с эндобиосинтетической гипотезой происхождения хлоропластов (с. 59, т. 1). Особенность этого растительного фермента — низкое число оборотов: только три молекулы СO2 в секунду фиксируются рубиско при 25 °С. Для достижения высокой скорости фиксации СO2 растения нуждаются в большом количестве этого фермента. Рубиско составляет почти 50% растворимых белков в хлоропластах, и, вероятно, это один из самых распространенных белков в биосфере.
Рис 20-5. Структура рибулозо-1,5-бисфосфаткарбоксилазы (рубиско). а — вид сверху и сбоку ленточной модели формы I рубиско из шпината (PDB ID 8RUC). Фермент содержит восемь больших субъединиц (синие) и восемь малых субъединиц (серые), компактно упакованных в структуру с Мr = 550 000. Концентрация рубиско в строме хлоропластов около 250 мг/мл, что соответствует необычно высокой концентрации активных центров (~4 мМ). Аминокислотные остатки активного центра показаны желтым, ионы Мg2+ — зеленым, б — ленточная модель формы II рубиско из бактерии Rhodospirillum rubrum (PDB ID 9RUB). Субъединицы показаны серым и синим. Остаток Lys в активном центре, который у активного фермента карбоксилирован до карбамата (показан красным). Субстрат — рибулозо-1,5-бисфосфат выделен желтым, ионы магния — зеленым.
В предполагаемом механизме с участием растительного рубиско центральную роль играет карбамоилированная боковая цепь Lys и связанный с ней Mg2+. Ион Mg2+способствует правильной ориентации реагентов в активном центре (рис. 20-6) и поляризует СO2, открывая его для нуклеофильной атаки пятиуглеродным ендиолатным активным интермедиатом, образующимся на ферменте (рис. 20-7). Получающееся шестиуглеродное промежуточное соединение распадается с образованием двух молекул 3-фосфоглицерата.
Рис. 20-6. Центральная роль иона Мg2+ в каталитическом механизме с участием рубиско (из PDB, ID 1RXO). Мg2+ координирован шестью атомами кислорода, находящимися в вершинах октаэдрического комплекса: кислород карбамата Lys201, два атома кислорода карбоксильных групп Glu204и Asp203, два кислорода на атомах С-2 и С-3 субстрата рибулозо-1,5-бисфосфата и один атом кислорода второго субстрата — СO2. В этой кристаллической структуре в СO2-связывающем центре находится молекула воды. (Номера остатков соответствуют ферменту из шпината.)
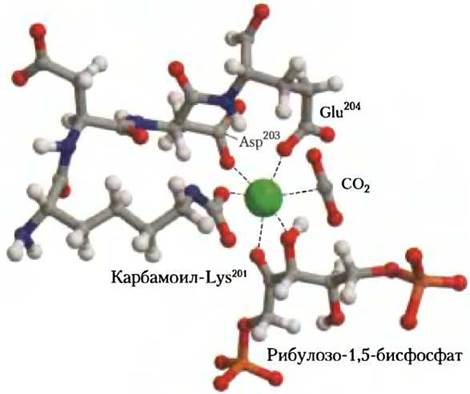
Рис. 20-7. Механизм реакции. Первая стадия ассимиляции СO2: карбоксилазная активность рубиско. Реакция фиксации СO2 катализируется рибулозо-1,5-бисфосфаткарбокси- лазой/оксигеназой (рубиско): одна молекула СO2 соединяется с одной молекулой рибулозо-1,5-бисфосфата и образуются две молекулы 3-фосфоглицерата, одна из которых содержит атом углерода СO2 (красный). Дополнительная передача протона (не показана) задействует Lys201, Lys175и His294 и проходит в несколько стадий. Механизм работы рубиско
Как катализатор первой стадии фотосинтетической ассимиляции СO2 рубиско выступает главной мишенью для регуляции. Фермент неактивен, пока ε-группа Lys201некарбамоилирована (рис. 20-8). Рибулозо-1,5-бисфосфат ингибирует карбамоилирование, прочно связываясь с активным центром и блокируя фермент в «закрытой» конформации, в которой Lys201недоступен. Рубиско-активаза снимает ингибирование посредством АТР-зависимого высвобождения рибулозо-1,5-бисфосфата, экспонируя аминогруппу Lys для неферментативного карбамоили- рования с помощью СO2; этот процесс следует за связыванием Mg2+, которое активирует рубиско. У некоторых видов рубиско-активаза активируется светом по окислительно-восстановительному механизму (см. рис. 20-19).
Рис. 20-8. Роль рубиско-активазы в карбамоилирова- нии остатка Lys201 активного центра рубиско. Когда субстрат рибулозо-1,5-бисфосфат связан с активным сайтом, Lys201не доступен. Рубиско-активаза гидролизует АТР и выталкивает сахаробисфосфат, таким образом экспонируя Lys201наружу; этот остаток Lys теперь может быть карбамоилирован молекулой СO2 (по-видимому, неферментативная реакция). Ион Мg2+ притягивается к отрицательно заряженному карбамоил-Lys и связывается с ним, что приводит к активации фермента.

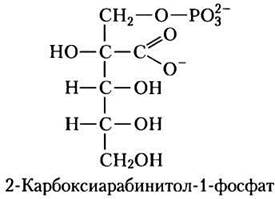
Другой регуляторный механизм вовлекает «темновой ингибитор» 2-карбоксирабинитол-1- фосфат, природный аналог переходного состояния (см. доп. 6-3, т. 1) со структурой, похожей на β-кетокислоту — интермедиат в реакции рубиско (рис. 20-7; см. также рис. 20-20). Это соединение, синтезирующееся некоторыми растениями в темноте, — мощный ингибитор карбамоилированной рубиско. Оно либо распадается при освещении, либо вытесняется рубиско-активазой, активируя рубиско.
Стадия 2. Превращение 3-фосфоглицерата в глицералъдегид-3-фосфат.
3-Фосфоглицерат, образовавшийся на первой стадии, превращается в глицеральдегид-3-фосфат в две стадии, которые по сути есть обратные реакции соответствующих стадий гликолиза с одним отличием: в качестве нуклеотидного кофактора для восстановления 1,3-бисфосфоглицерата вместо NАDН используется NАDРН (см. рис. 20-9). Строма хлоропласта содержит все гликолитические ферменты, кроме фосфоглицератмутазы. Стромальные и цитозольные ферменты — изозимы: оба набора ферментов катализируют одинаковые реакции, но продуцируются разными генами.
Рис. 20-9. Вторая стадия ассимиляции СO2. 3-Фосфоглицерат превращается в глицер- альдегид-3-фосфат (красные стрелки). Показаны также альтернативные пути, в которых участвует фиксированный углерод глицеральдегид-3-фосфата (синие стрелки). Глицеральдегид-3-фосфат в основном превращается обратно в рибулозо-1,5-бисфосфат, как показано на рис. 20-10. Небольшие количества «дополнительного» глицеральдегид- 3-фосфата может быть немедленно использована в качестве источника энергии, но весь остальной глицеральдегид-3-фосфат превращается в сахарозу для транспорта или запасается в хлоропластах в виде крахмала. В последнем случае он конденсируется в строме с дигидроксиацетонфосфатом, образуя фруктозо-1,6-бисфосфат, предшественник крахмала. В других ситуациях глицеральдегид-3-фосфат превращается в дигидроксиацетонфосфат, который покидает хлоропласт через специфический транспортер (см. рис. 20-15) и может с высвобождением энергии расщепляться в процессе гликолиза в цитозоле или использоваться для образования фруктозо-6-фосфата и, следовательно, сахарозы.

В первой реакции второй стадии стромальный фермент 3-фосфоглицераткиназа катализирует перенос фосфорильной группы с АТР на 3-фосфоглицерат, превращая его в 1,3-бисфосфоглицерат. Затем, хлоропласт-специфичный изозим глицеральдегид-3-фосфатдегидрогеназа восстанавливает 1,3-бисфосфат, окисляя NАDРН, с образованием глицеральдегид- 3-фосфата и фосфата Рi. Триозофосфат- изомераза осуществляет взаимопревращение глицеральдегид-3-фосфата и дигидроксиацетонфосфата. Большинство молекул триозофосфата, которые получаются таким образом, затем используется для регенерации рибулозо-1,5-
бисфосфата; остальные либо превращаются в крахмал в хлоропластах и хранятся для дальнейшего использования, либо немедленно экспортируются в цитозоль и превращаются в сахарозу для транспорта к растущим органам растения. В развивающихся листьях значительная доля триозофосфата может расщепляться в гликолизе, высвобождая энергию.
Стадия 3. Регенерация рибулозо-1,5-бисфосфата из триозофосфатов.
В результате первой реакции ассимиляции СO2 в триозофосфаты расходуется рибулозо-1,5-бисфосфат, и для непрерывного превращения СO2 в углеводы рибулозо-1,5- бисфосфат должен постоянно регенерироваться. Это выполняется в серии реакций (рис. 20-10), что вместе со стадиями (1) и (2) составляет циклический путь, показанный на рис. 20-4. Продукт первой реакции (3-фосфоглицерат) процесса ассимиляции подвергается различным превращениям, в результате которых образуется рибулозо-1,5-бисфосфат. Интермедиаты этого пути представляют собой трех-, четырех-, пяти-, шести- и семиуглеродные сахара. В последующем обсуждении номера стадий соответствуют рис. 20-10.
Рис. 20-10. Третья стадия ассимиляции СO2. Показано взаимопревращение триозофосфатов и пентозофосфатов. Черными точками обозначены атомы углерода. Исходными веществами служат глицеральдегид-3-фосфат и дигидроксиацетонфосфат. Реакции синтеза пентозофосфатов катализируются трансальдолазой ((1) и (4)), транскетолазой ((3) и (6)), затем образуется рибулозо-1,5-бисфосфат из рибозо-5-фосфата под действием рибозо- 5-фосфатизомеразы ((7)) и из ксилулозо-5-фосфата под действием рибулозо-5-фосфат- эпимеразы ((8)). На стадии (9) рибулозо-5-фосфат фосфорилируется и образуется рибулозо-1,5-бисфосфат. Реакции, изображенные синими стрелками (стадии (2) фруктозо- 1,6-бисфосфатазы, (5) седогептулозо-бисфосфатазы и (9) рибулозо-5-фосфаткиназы), эндотермические, поэтому весь процесс в целом необратим.

Стадии (1) и (4) катализируются одним и тем же ферментом — альдолазой. Сначала этот фермент катализирует обратимую конденсацию глицеральдегид-3-фосфата с дигидроксиацетон- фосфатом, образуя фруктозо-1,6-бисфосфат; на стадии (2) это соединение расщепляется фруктозо- 1,6-бисфосфатазой (ФБФаза-1) на фруктозо-6- фосфат и Рi. Эта реакция сильно экзотермична и по сути необратима. Стадия (3) катализируется транс- кетолазой, которая содержит тиаминпирофосфат (ТРР) в качестве простетической группы (см. рис. 14-14, а) и для функционирования которой требуется Mg2+. Транскетолаза катализирует обратимый перенос двухуглеродной кетольной группы (СН2ОН-СО-) с кетозофосфатного донора фруктозо-6-фосфата на альдозофосфатный акцептор глицеральдегид-3-фосфат (рис. 20-11, а, б), образуя пентозу ксилулозо-5-фосфат и тетрозу эритрозо-4-фосфат. На стадии (4) снова действует трансальдолаза, конденсируя эритрозо-4-фосфат с дигидроксиацетонфосфатом с образованием семиуглеродного сахара седогептулозо-1,7-бисфосфата. Фермент, седогептулозо-1,7-бисфосфатаза, уникальный для пластид, превращает этот бис- фосфат в седогептулозо-7-фосфат (стадия (5)); в данном пути, это вторая необратимая реакция. Теперь снова работает транскетолаза, превращая на стадии (6) (рис. 20-11, в) седогептулозо-7-фосфат и глицеральдегид-3-фосфат в два пентозофосфата. На рис. 20-12 показано, как на стадии (6) двухуглеродный фрагмент временно переносится на транскетолазный кофактор ТРР и конденсируется с тремя атомами углерода глицеральдегид-3- фосфата.
Рис. 20-11. Реакции цикла Кальвина, катализируемые транскетолазой. а — реакция, катализируемая транскетолазой; происходит перенос двухуглеродной группы, которую временно несет связанный с ферментом ТРР, от кетодонора к альдоакцептору. б — превращение гексозы и триозы в четырехуглеродный и пятиуглеродный сахар (стадия (3) на рис. 20-10). в — превращение семиуглеродного и трехуглеродного сахара в пентозы (стадия (6) на рис. 20-10).
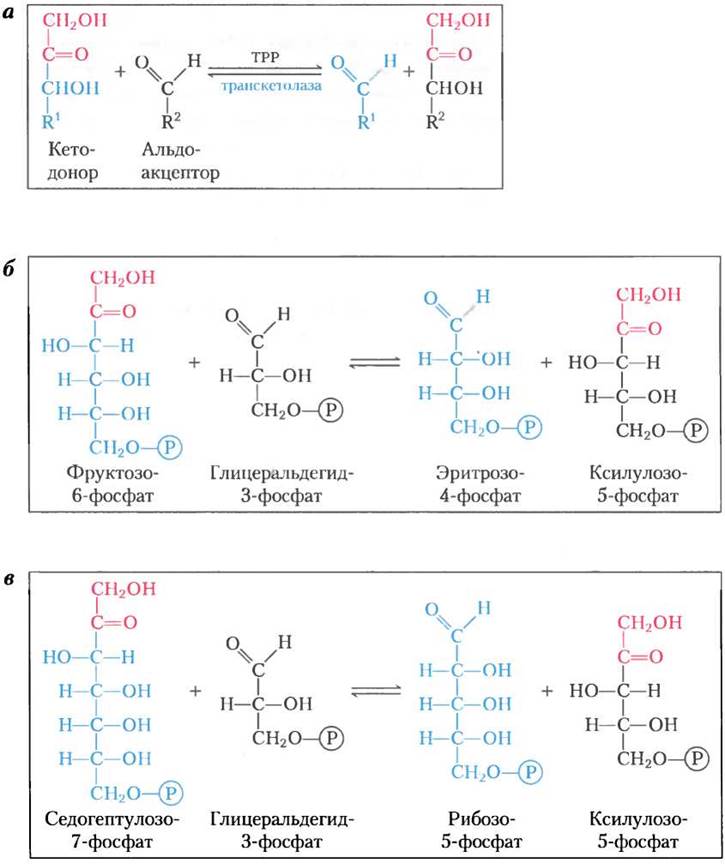
Рис. 20-12. Тиаминпирофосфат (ТРР) служит кофактором для транскетолазы. Транскетолаза переносит двухуглеродную группу с седогептулозо-7-фосфата на глицеральдегид-3- фосфат, образуя два пентозофосфата (стадия (6) на рис. 20-10). Тиаминпирофосфат облегчает взаимодействие, временно выступая в качестве переносчика двухуглеродной структуры и стабилизируя электрон (см. рис. 14-14).
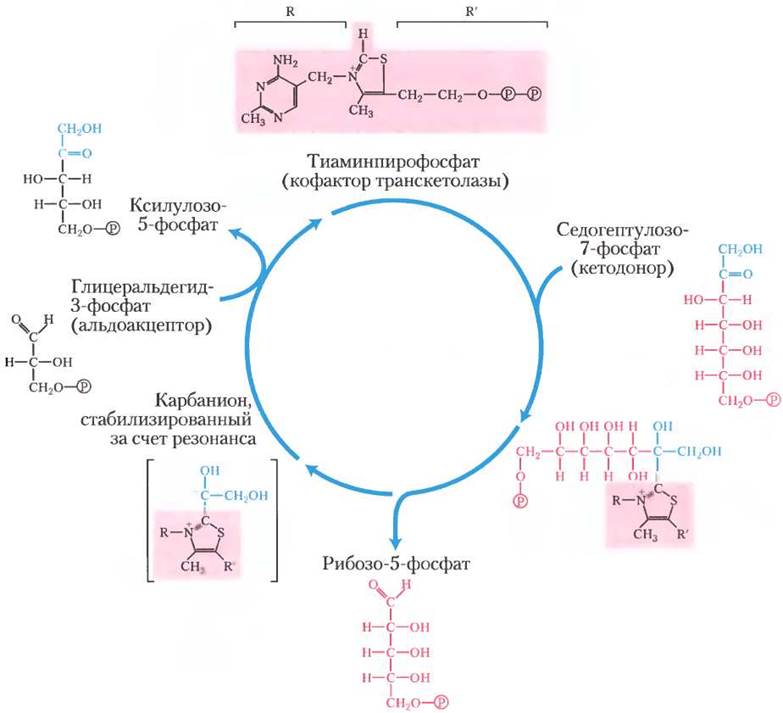
Рис. 20-13. Регенерация рибулозо-1,5-бисфосфата. Рибулозо- 1,5-бисфосфат (исходный материал для цикла Кальвина) получается из двух пентозофосфатов, образующихся в цикле. В этих реакциях участвуют изомеразы и эпимеразы, затем происходит фосфорилирование киназой, а АТР используется в качестве донора фосфатной группы (стадии (7), (8) и (9) на рис. 20-10).

Пентозофосфаты рибозо-5-фосфат и ксилулозо-5-фосфат, образованные в транскетолазных реакциях, переходят в рибулозо-5-фосфат (стадии (7) и (8)), который на последней стадии цикла ((9)) фосфорилируется до рибулозо- 1,5-бисфосфата рибулозо-5-фосфаткиназой (рис. 20-13). Это третья экзотермическая реакция данного пути, поскольку происходит «замена» высокоэнергетической фосфоангидридной связи АТР на фосфоэфирную связь в рибулозо- 1,5-бисфосфате.
Синтез каждого триозофосфата из СO2 требует шесть NADРН и девять АТР
В результате трех оборотов циклов Кальвина из трех молекул СO2 и одной молекулы фосфата образуется одна молекула триозофосфата. Стехиометрия полного пути от СO2до триозофосфата с регенерацией рибулозо-1,5- бисфосфата показана на рис. 20-14. Три молекулы рибулозо-1,5-бисфосфата (всего 15 атомов углерода) конденсируются с тремя молекулами СO2 (три атома углерода) с образованием шести молекул 3-фосфоглицерата (18 атомов углерода). Эти шесть молекул 3-фосфоглицерата восстанавливаются до шести молекул гли- церальдегид-3-фосфата (или дигидроксиацетонфосфата) с расходом шести АТР (при синтезе 1,3-бисфосфоглицерата) и шести NADРН (при восстановлении 1,3-бисфосфоглицерата до глицеральдегид-3-фосфата). Изозим глицераль- дегид-3-фосфатдегидрогеназа, присутствующий в хлоропластах, может использовать NАDР+ в качестве переносчика электронов и обычно функционирует в направлении восстановления 1,3-бисфосфоглицерата. Цитозольный изозим использует NАD+ как гликолитический фермент у животных и других эукариот — в темноте этот изозим работает в гликолизе, окисляя глицеральдегид-3-фосфат. Оба изозима глицеральдегид-3-фосфатдегидрогеназы, как все ферменты, катализируют реакцию в обоих направлениях.
Рис. 20-14. Стехиометрия ассимиляции СO2 в цикле Кальвина. На каждые три фиксированные молекулы СO2 образуется одна молекула триозофосфата (глицеральдегид-3-фосфат) и потребляется девять молекул АТР и шесть молекул NADPH.
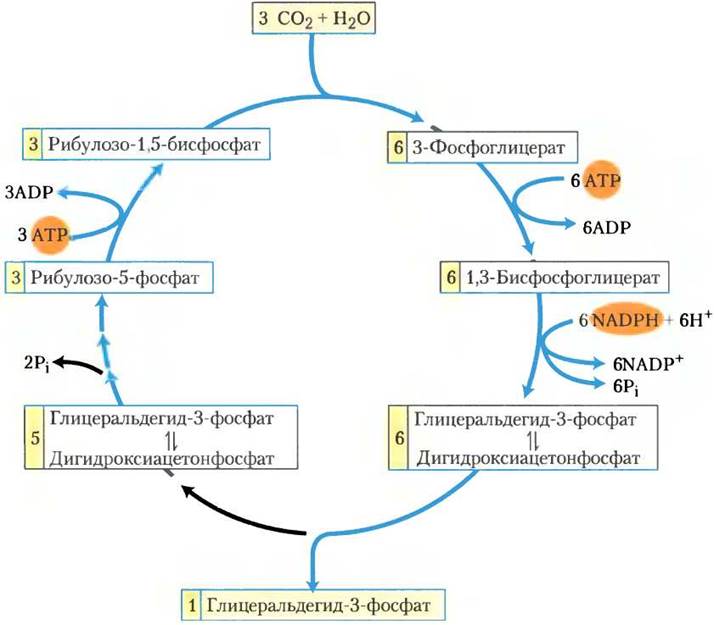
Одна молекула глицеральдегид-3-фосфата является итоговым продуктом пути ассимиляции углерода. Другие пять молекул триозофосфата (15 атомов углерода) перегруппировываются (изображено на стадиях (1)-(9) рис. 20-10) с образованием трех молекул рибулозо-1,5-бисфосфата (15 атомов углерода). Последняя стадия требует одну молекулу АТР на одну молекулу рибулозо- 1,5-бисфосфат, т. е. всего 3 АТР. В итоге, на каждую молекулу триозофосфата, полученную при фотосинтетической ассимиляции СO2, приходится шесть NADPH и девять АТР.
NADPH и АТР производятся в светозависимых реакциях фотосинтеза примерно в том же соотношении (2 : 3), в котором они потребляются в цикле Кальвина. Девять молекул АТР превращаются в ADP и фосфат при синтезе молекулы триозофосфата; восемь фосфатов высвобождаются в виде Рi и конденсируются с восемью молекулами ADP, регенерируя АТР. Девятый фосфат включается в триозофосфат. Для превращения девятой молекулы ADP в АТР, как мы увидим дальше, фосфат должен быть импортирован из цитозоля.
В темноте синтез АТР и NADPH фотофосфорилированием, а также включение СO2 в триозофосфаты (так называемые темновые реакции) прекращаются. «Темновые реакции» фотосинтеза были так названы для того, чтобы отличать их от первичных светоиндуцированных реакций электронного переноса к NADP+ и синтеза АТР (см. гл. 19). Фактически, в темноте их скорости не значимы, таким образом, более подходящее название для них — реакции ассимиляции углерода. Позднее в этом разделе мы опишем регуляторные механизмы, которые включают ассимиляцию углерода на свету и выключают ее в темноте.
Строма хлоропластов содержит все ферменты, необходимые для превращения триозофосфатов (глицеральдегид-3-фосфата и дигидроксиацетонфосфата), получающихся при ассимиляции СO2 в крахмал, который временно хранится в хлоропласте в виде нерастворимых гранул. Альдолаза конденсирует триозы до фруктозо-1,6- бисфосфата; фруктозо-1,6-бисфосфатаза синтезирует фруктозо-6-фосфат; фосфогексозоизоме- раза образует глюкозо-6-фосфат; а фосфоглюкомутаза производит глюкозо-1-фосфат, исходный материал в синтезе крахмала (см. разд. 20.3).
Все реакции цикла Кальвина, кроме катализируемых рубиско, седогептулозо-1,7-бис- фосфатазой и рибулозо-5-фосфаткиназой, также происходят в животных тканях. Но без этих трех ферментов животные не могут осуществлять цепь превращений из СO2 в глюкозу.
Транспортная система выводит триозофосфаты из хлоропласта и импортирует фосфат
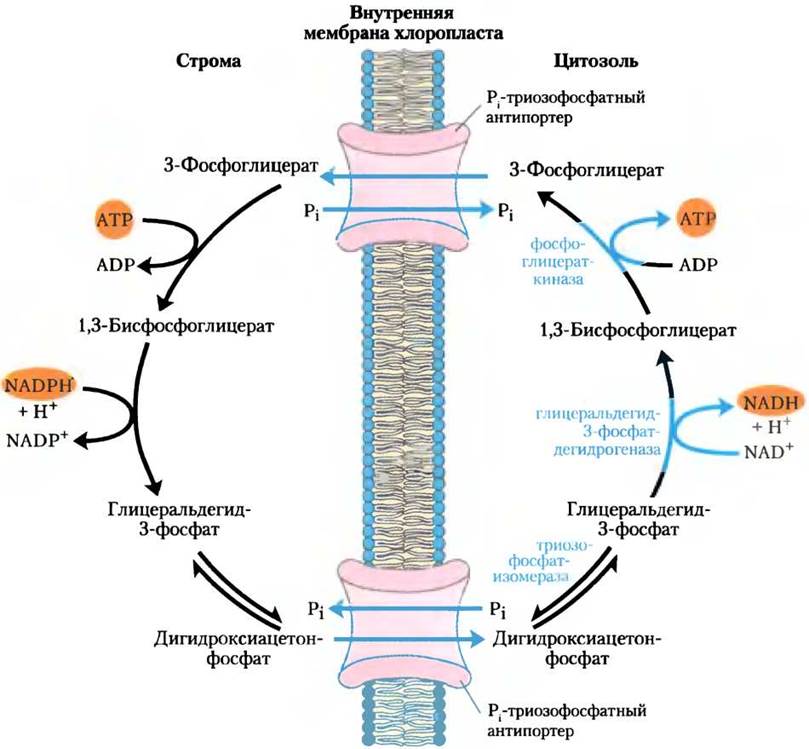
Внутренняя мембрана хлоропластов не проницаема для многих фосфорилированных соединений, включая фруктозо-6-фосфат, глюкозо-6-фосфат и фруктозо-1,6-бисфосфат. Она содержит, однако, специфический антипортер, катализирующий обмен Рi с триозофосфатом дигидроксиацетонфосфатом или фосфоглицератом (рис. 20-15, см. также рис. 20-9). Этот антипортер одновременно перемещает фосфат в хлоропласт, где он используется в фотофосфорилировании, а триозофосфат в цитозоль, где он может идти на синтез сахарозы (именно в этой форме фиксированный углерод транспортируется в удаленные растительные ткани).
Рис. 20-15. Рi-триозофосфатная антипортерная система внутренней мембраны хлоропластов. Этот транспортер способствует обмену Рi из цитозоля на дигидроксиацетонфосфат стромы. Продукты фотосинтетической ассимиляции углерода перемещаются в цитозоль, где служат исходными веществами для биосинтеза сахарозы, а Рi, необходимый для фотофосфорилирования, перемещается в строму. Этот же антипортер может транспортировать 3-фосфоглицерат и участвовать в экспорте АТР и восстановительных эквивалентов (см. рис. 20-16).
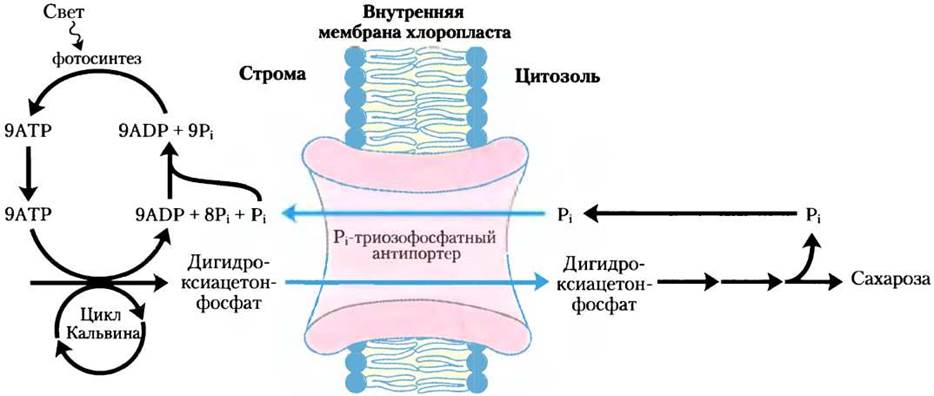
Синтез сахарозы в цитозоле и синтез крахмала в хлоропласте — главные пути, в которых потребляется избыток триозофосфата, получающийся при фотосинтезе. Синтез сахарозы (описанный ниже) высвобождает четыре фосфата Pi из четырех триозофосфатов, необходимых для синтеза одной молекулы сахарозы. На каждую молекулу удаляемого триозофосфата в хлоропласт транспортируется один фосфат Pi, обеспечивая при регенерации АТР девятый Рi (упоминавшийся ранее). Если этот обмен блокировать, синтез триозофосфата быстро исчерпает доступный фосфат в хлоропласте, замедлив синтез АТР и подавив включение СО2 в крахмал.
Эта Рi-триозофосфат-антипортерная система обладает дополнительной функцией. Для различных синтетических и энергозависимых реакций в цитозоле необходимы АТР и восстановительные эквиваленты. Пока еще неясно, в какой степени митохондрии пополняют этот запас, но второй потенциальный ресурс энергии — это АТР и NADPH, которые продуцируются в световых реакциях в строме хлоропласта. Однако ни АТР, ни NADPH не могут пересекать мембрану хлоропластов. На процессы транспорта влияет Рi-триозофосфат-антипортерная система, обеспечивая передвижение АТР и восстановительных эквивалентов из хлоропласта в цитозоль (рис. 20-16). Дигидроксиацетонфосфат, синтезированный в строме, транспортируется в цитозоль, где гликолитическими ферментами превращается в 3-фосфоглицерат, в результате чего образуются АТР и NADH. 3-Фосфоглицерат возвращается в хлоропласт, замыкая цикл.
Рис. 20-16. Роль Рi-триозофосфатного антипортера в транспорте АТР и восстановительных эквивалентов. Дигидроксиацетонфосфат покидает хлоропласт и в цитозоле превращается в глицеральдегид-3-фосфат. Затем в результате проходящих в цитозоле глицеральдегид- 3-фосфатдегидрогеназной и фосфоглицераткиназной реакций образуются NADH, АТР и 3-фосфоглицерат. Возвращение 3-фосфоглицерата в хлоропласт и его восстановление до дигидроксиацетонфосфата завершают цикл, эффективно перемещающий АТР и восстановительные эквиваленты (NADH/NADPH) из хлоропласта в цитозоль.
Четыре фермента цикла Кальвина косвенно активируются светом
Восстановительная ассимиляция СO2 требует большого количества АТР и NADPH, и при освещении хлоропластов их концентрация в строме увеличивается (рис. 20-17). Индуцированный светом транспорт протонов через тилакоидную мембрану (гл. 19) также увеличивает pH стромы от 7 до -8, и это сопровождается утечкой Mg2+ из тилакоидного пространства в строму, увеличивая концентрацию Mg2+ от 1-3 мМ до 3-6 мМ. Эволюция некоторых стромальных ферментов привела к тому, что они активируются при освещении, когда АТР и NADPH легко доступны. Ферменты также более активны в щелочной среде и при высокой концентрации Mg2+. Например, активация рубиско благодаря образованию карбамоиллизина происходит быстрее при щелочном pH, а высокая стромальная концентрация Mg2+ благоприятству
ет образованию ферментативно активного магниевого комплекса. Фруктозо-1,6-бисфосфатаза требует наличия Mg2+ и сильно зависит от pH (рис. 20-18); ее активность увеличивается более чем в 100 раз, когда pH и концентрация Mg2+ возрастают при освещении хлоропластов.
Рис. 20-17. Источники АТР и NADPH. Образовавшиеся в световых реакциях АТР и NADPH — необходимые субстраты для восстановления СO2. Реакции фотосинтеза, в результате которых образуются АТР и NADPH, сопровождаются переносом протонов (показаны красным) из стромы в тилакоид, создавая в строме щелочные условия. Ионы магния проходят из тилакоида в строму, увеличивая в строме концентрацию Мg2+.
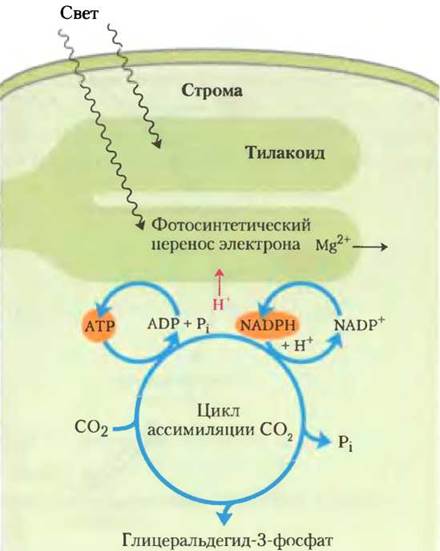
Рис. 20-18. Активация фруктозо-1,6-бисфосфатазы хлоропластов. Неактивная фруктозо-1,6-бисфосфатаза (ФБФаза-1) активируется светом при высоких значениях pH и высокой концентрации Мg2+ в строме, которые возрастают при освещении.
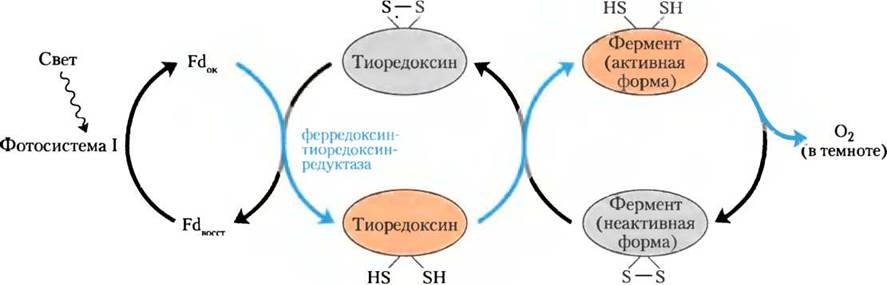
Четыре фермента цикла Кальвина являются предметом особого типа регуляции светом. Рибулозо-5-фосфаткиназа, фруктозо-1,6- бисфосфатаза, седогептулозо-1,7-бисфосфатаза и глицеральдегид-3-фосфатдегидрогеназа активируются путем восстановления дисульфидных связей между двумя остатками СуБ, что необходимо для их каталитической активности, наступающей при освещении. Когда остатки Суs связаны дисульфидной связью (окислены), ферменты неактивны; так обычно происходит в темноте. При освещении электроны транспортируются из фотосистемы I к ферредоксину (см. рис. 19-56), который передает электроны на небольшой, водорастворимый, содержащий дисульфидные связи белок, называемый тиоредоксином (рис. 20-19), в реакции, катализируемой ферредоксин-тиоредоксинредуктазой. Восстановленный тиоредоксин переносит электроны на дисульфидные связи светоактивируемых ферментов, и эти восстановительные реакции разрыва связей сопряжены с конформационными изменениями, в результате которых увеличиваются активности ферментов. В сумеречных условиях остатки Cys этих четырех ферментов снова окисляются до дисульфидных форм и ферменты инактивируются, а АТР не тратится в ассимиляции СO2. Вместо этого крахмал, синтезированный и запасенный в дневное время суток, расщепляется на мономеры, которые ночью служат топливом в гликолизе.
Рис. 20-19. Световая активация некоторых ферментов цикла Кальвина. Световая активация опосредуется тиоредоксином, небольшим белком, содержащим дисульфидные связи. На свету тиоредоксин восстанавливается электронами, движущимися из фотосистемы I через ферредоксин (Fd) (синие стрелки), затем тиоредоксин восстанавливает ключевые дисульфидные связи каждого из ферментов: седогептулозо-1,7-бисфосфатазы, фруктозо- 1,6-бисфосфатазы, рибулозо-5-фосфаткиназы и глицеральдегид-3-фосфатдегидрогеназы, активируя эти ферменты. В темноте -SH-группы вновь подвергаются окислению до дисульфидных связей, что инактивирует ферменты.
Глюкозо-6-фосфатдегидрогеназа, первый фермент в окислительном пентозофосфатном пути, также регулируется этим управляемым светом механизмом, но в обратную сторону. В течение дня, когда в процессе фотосинтеза производится много NADPH, этот фермент не нужен для образования NADPH. Фермент инактивирует восстановление ключевой дисульфидной связи электронами от ферредоксина.
Краткое содержание раздела 20.1 Фотосинтез углеводов
■ У сосудистых растений фотосинтез происходит в хлоропластах. В реакциях ассимиляции СO2 (цикле Кальвина) АТР и NADPH используются для восстановления СO2 до триозофосфатов. Эти реакции происходят в три стадии: собственно, реакция фиксации, катализируемая рубиско; восстановление образовавшегося 3-фосфоглицерата до глицеральдегид-3-фосфата; и регенерация рибулозо-1,5-бисфосфата из триозофосфатов.
■ Рубиско конденсирует СO2 с рибулозо-1,5- бисфосфатом, образуя неустойчивый гексозобисфосфат, который распадается на две молекулы 3-фосфоглицерата. Рубиско активируется путем ковалентной модификации (карбамоилированием Lys201), катализируемой рубиско-активазой, и ингибируется природным аналогом переходного состояния, концентрация которого возрастает в темноте и уменьшается в дневное время суток.
■ Стромальные изозимы гликолитических ферментов катализируют восстановление 3-фосфоглицерата до глицеральдегид-3-фосфата; на восстановление каждой молекулы 3-фосфоглицерата тратится одна молекула АТР и одна молекула NADPH.
■ Стромальные ферменты, включая транс- кетолазу и трансальдолазу, перестраивают углеродный скелет триозофосфатов, синтезируя интермедиаты из трех, четырех, пяти, шести и семи атомов углерода, и в итоге образуют пентозофосфаты. Пентозофосфаты превращаются в рибулозо-5-фосфат, который затем фосфорилируется до рибулозо-1,5-бисфосфат для завершения цикла Кальвина.
■ «Стоимость» трех фиксированных в триозо- фосфате СO2 — девять молекул АТР и шесть молекул NADPH, которые синтезируются в световых реакциях фотосинтеза.
■ Антипортер во внутренней мембране хлоропласта обменивает Pi из цитозоля на 3З-фосфоглицерат или дигидроксиацетонфосфат, образующиеся в строме в процессе ассимиляции СO2. При окислении дигидроксиацетонфосфата в цитозоле образуются АТР и NADH; таким образом, АТР и восстановительные эквиваленты из хлоропласта перемещаются в цитозоль.
■ Четыре фермента цикла Кальвина косвенно активируются светом; они неактивны в темноте, поэтому синтез гексоз не конкурирует с гликолизом, который необходим для получения энергии в темноте.