ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 2. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ - 2014
ЧАСТЬ II. БИОЭНЕРГЕТИКА И МЕТАБОЛИЗМ
13. ОСНОВЫ БИОЭНЕРГЕТИКИ. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
Вопросы и задачи
1. Изменения энтропии при развитии яйца.
Рассмотрим систему, состоящую из яйца в инкубаторе. В яичном белке и желтке содержатся белки, углеводы и липиды. При оплодотворении яйца из одной клетки развивается сложный организм. Обсудите этот необратимый процесс и дайте качественную оценку изменений энтропии в системе, ее окружении и во всем пространстве. Прежде всего следует правильно определить систему и ее окружение.
2. Вычисление ∆G'° из константы равновесия.
Найдите изменения стандартной свободной энергии в следующих катализируемых ферментами метаболически важных реакциях при 25 °С и pH 7,0, используя данные по константам равновесия.
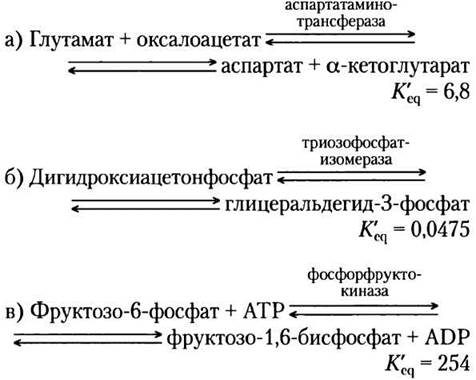
3. Расчет константы равновесия из ∆G'°.
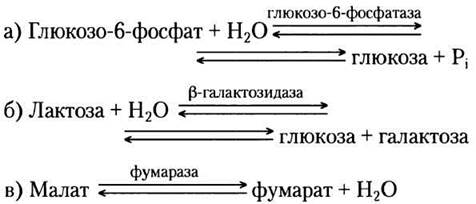
Рассчитайте константы равновесия К'eq реакций при pH 7,0 и 25 °С, используя значения ∆G'° из табл. 13-4.
4. Экспериментальное определение K'eq и ∆G'°.
Если 0,1 М раствор глюкозо-1-фосфата инкубировать с фосфоглюкомутазой в каталитическом количестве, глюкозо-1-фосфат превращается в глюкозо-6-фосфат. Концентрации компонентов указаны для равновесной реакции
![]()
Рассчитайте К'eq и ∆G'° для этой реакции при 25 °С.
5. Экспериментальное определение ∆G'° гидролиза АТР.
Требуется осуществить прямое измерение изменения стандартной свободной энергии при гидролизе АТР, поскольку в равновесной реакции трудно определить количество АТР, гидролизуемое за 1 мин. Однако ∆G′° можно рассчитать косвенно из констант равновесия двух других ферментативных реакций, которые обладают менее благоприятными константами равновесия:
Глюкозо-6-фосфат + Н2O —> глюкоза + Pi
К'eq = 270
АТР + глюкоза —> ADP + глюкозо-6-фосфат
К'eq = 890
Найдите стандартную свободную энергию гидролиза АТР при 25 °С.
6. Различие между ∆G′° и ∆G.
Рассмотрим следующее превращение, происходящее при гликолизе (гл. 14):
Фруктозо-6-фосфат ⇄ глюкозо-6-фосфат
К’eq = 1,97
а) Найдите ∆G′° реакции (при 25 °С).
б) Если концентрацию фруктозо-6-фосфата довести до 1,5 М, а глюкозо-6-фосфата до 0,50 М, чему равно ∆G?
в) Почему ∆G′° и ∆G не совпадают по величине?
7. Свободная энергия гидролиза СТР.
Сравните структуру нуклеозидтрифосфата СТР со структурой АТР.
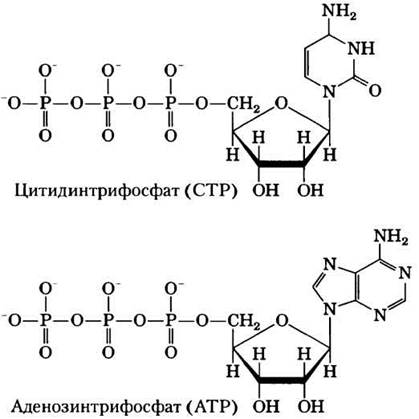
Предскажите значения К'еq и ∆G′° для следующей реакции:
АТР + CDP —> ADP + СТР
8. Зависимость ∆G от pH.
Свободная энергия, выделяющаяся при гидролизе АТР в стандартных условиях (при pH 7,0), равна -30,5 кДж/моль. Больше или меньше выделится свободной энергии, если гидролиз АТР происходит в стандартных условиях, но при pH 5,0? Объясните. Используйте физиологический график для объяснения этой зависимости.
9. ∆G'° сопряженных реакций.
Глюкозо-1-фосфат превращается во фруктозо-6-фосфат в двух последовательных реакциях:
Глюкозо-1-фосфат —> глюкозо-6-фосфат
Глюкозо-6-фосфат —> фруктозо-6-фосфат
Основываясь на величинах ∆G'° из табл. 13-4, рассчитайте константу равновесия К'eq суммарной реакции при 25 °С:
Глюкозо-1-фосфат —> фруктозо-6-фосфат
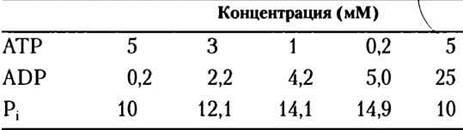
10. Влияние отношения [ATP]/[ADP] на величину свободной энергии гидролиза АТР.
Используя уравнение 13-4, изобразим зависимость A G от In Q (отношение действующих масс) при 25 °С для указанных в таблице концентраций АТР, ADP и Pi. Для данной реакции ∆G'° = -30,5 кДж/моль. Используя полученный график, объясните, почему регуляция метаболизма направлена на поддержание высокого значения отношения [АТР]/[АDР].
11. Способ преодоления невыгодности реакций: АТР-зависимое химическое сопряжение.
Фосфорилирование глюкозы до глюкозо-6-фосфата является начальным шагом в катаболизме глюкозы. Непосредственное фосфорилирование глюкозы Pi описывается уравнением
Глюкоза + Рi —> глюкозо-6-фосфат + Н2O
∆G'° = 13,8 кДж/моль
а) Рассчитайте константу равновесия приведенной реакции. В гепатоцитах крысы физиологическая концентрация глюкозы и Pi составляет ~4,8 мМ. Какова равновесная концентрация глюкозо-6-фосфата, полученного непосредственным фосфорилированием глюкозы неорганическим фосфатом? Приемлима ли эта реакция как стадия метаболизма при катаболизме глюкозы? Объясните.
б) В принципе, по крайней мере один из способов увеличения концентрации глюкозо-6- фосфата заключается в смещении равновесия реакции вправо увеличением внутриклеточных концентраций глюкозы и Рi. Предполагая, что концентрация Pi не меняется и равна 4,8 мМ, найдите, какой должна быть внутриклеточная концентрация глюкозы, чтобы равновесная концентрация глюкозо-6-фосфата составила 250 мкМ (это обычная физиологическая концентрация)? Будет ли такой способ физиологически приемлемым, если известно, что максимальная растворимость глюкозы меньше 1 М?
в) Фосфорилирование глюкозы в клетке сопряжено с гидролизом АТР; т. е. часть свободной энергии гидролиза АТР идет на фосфорилирование глюкозы:
(1) Глюкоза + Pi —> глюкозо-6-фосфат + Н2O
∆G′° = 13,8 кДж/моль
(2) АТР + Н2O —> ADP + Рi
∆G′° = -30,5 кДж/моль
Итого: глюкоза + АТР —> глюкозо-6-фосфат + ADP
Рассчитайте К'eq суммарной реакции. При АТР- зависимом фосфорилировании глюкозы какая ее концентрация необходима для получения 250 мкМ внутриклеточной концентрации глюкозо-6-фосфата, если концентрации АТР и ADP равны 3,38 и 1,32 мМ соответственно? Дает ли такое сопряжение в принципе осуществимый способ фосфорилирования глюкозы в клетке? Объясните.
г) Хотя сопряжение гидролиза АТР с фосфорилированием глюкозы термодинамически разумно, пока остается невыясненным, каким образом это должно происходить. Раз установлено, что для сопряжения необходим общий посредник, возможный способ состоит в использовании гидролиза АТР для повышения внутриклеточной концентрации Pi и, таким образом, стимулировании им невыгодного фосфорилирования глюкозы. Разумен ли такой путь? (Подумайте о результатах растворимости метаболических посредников.)
д) ATP-сопряженное фосфорилирование глюкозы в гепатоцитах катализируется ферментом глюкокиназой. Этот фермент связывается с АТР и глюкозой с образованием глюкозо-АТР- ферментного комплекса, а фосфорильная группа переносится непосредственно с АТР на глюкозу. Объясните преимущества такого пути.
12. Расчет ∆G′° ATP-сопряженных реакций.
Из данных табл. 13-6 найдите ∆G′° реакций
а) Креатинфосфат + ADP —> креатин + АТР
б) АТР + фруктоза —> ADP + фруктозо-6-фосфат
13. Сопряжение разрыва АТР с энергетически невыгодными реакциями.
Для исследования результатов сопряжения гидролиза АТР в физиологических условиях с термодинамически невыгодной биохимической реакцией рассмотрим гипотетическое превращение X —> Y, для которого ∆G′° = 20 кДж/моль.
а) Чему равно отношение [Y]/[X] в состоянии равновесия?
б) Пусть X и Y участвуют в последовательности реакций, в ходе которых происходит гидролиз АТР до ADP и Pi. Суммарная реакция
X + АТР + Н2O —> Y + ADP + Pi
Вычислите [Y]/[X] для этой реакции в состоянии равновесия. Примите, что равновесные концентрации АТР, ADP и Рi равны 1 М.
в) Известно, что в физиологических условиях [АТР], [ADP] и [Pi] не равны 1 М. Вычислите [Y]/[X] для ATP-сопряженной реакции со значениями [АТР], [ADP] и [Pi], взятыми для миоцитов крыс.
14. Расчеты ∆G при физиологических концентрациях.
Найдите физиологическое ∆G (а не ∆G′°) реакции
Креатинфосфат + ADP —> креатин + АТР
при 25 °С для цитозоля нейронов с концентрацией креатинфосфата 4,7 мМ, креатина 1,0 мМ, ADP 0,73 мМ и АТР 2,6 мМ.
15. Свободная энергия, необходимая для синтеза АТР в физиологических условиях.
В цитозоле гепатоцитов крыс коэффициент действующих масс Q равен
![]()
Найдите свободную энергию, необходимую для синтеза АТР в гепатоцитах крыс.
16. «Химическая» логика.
В ходе гликолиза шестиуглеродный сахар фруктозо-1,6-бисфосфат расщепляется с образованием двух трехуглеродных сахаров, которые подвергаются дальнейшим метаболическим превращениям (см. рис. 14-5). При этом за две стадии до реакции расщепления происходит изомеризация глюкозо-6-фосфата во фруктозо-6-фосфат (см. ниже) (промежуточная стадия представляет собой фосфорилирование фруктозо-6-фосфата с образованием фруктозо- 1,6-бисфосфата) (с. 73)).
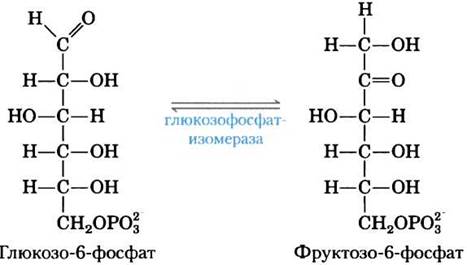
В чем смысл стадии изомеризации в ходе данного процесса? Подсказка. Подумайте, что могло бы произойти при расщеплении связи С—С без предварительной изомеризации.
17. Механизм ферментативной реакции I.
Лактатдегидрогеназа — один из ферментов, использующих в качестве кофермента NАDН. Фермент катализирует превращение пирувата в лактат
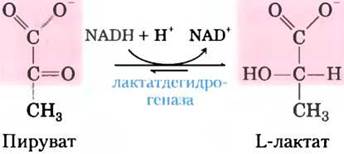
Изобразите механизм данной реакции (стрелками покажите направление передачи электронов).
Подсказка. Механизм этой реакции аналогичен механизму любой другой реакции, катализируемой NАDН-зависимой дегидрогеназой, например, алкогольдегидрогеназой.
18. Механизм ферментативной реакции II.
Биохимические реакции часто кажутся более сложными, чем они есть на самом деле. В пентозофосфатном пути (гл. 14) седогептулозо-7-фосфат реагирует с глицеральдегид-3-фосфатом с образованием эритрозо-4-фосфата и фруктозо-6-фосфата при участии фермента трансальдолазы.
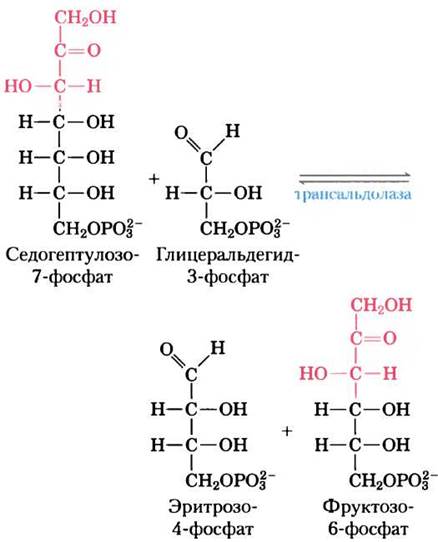
Изобразите механизм данной реакции (стрелками покажите направление передачи электронов). Подсказка. Взгляните на реакцию альдоль- ной конденсации и учтите название данного фермента.
19. Организм взрослого человека ежедневно использует АТР.
а) Для синтеза АТР из ADP и Pi при условии, что реагенты взяты в концентрациях 1 М (стандартное состояние), требуется всего 30,5 кДж/моль свободной энергии. Поскольку истинные физиологические концентрации АТР, ADP и Pi не равны 1 М, свободная энергия, необходимая для синтеза АТР в физиологических условиях, отличается от ∆G'°. Найдите свободную энергию, необходимую для синтеза АТР в гепатоцитах человека, если физиологические концентрации АТР, ADP и Pi составляют 3,5, 1,50 и 5,0 мМ соответственно.
б) Взрослому человеку с массой тела 68 кг (150 фунтов) требуется 2000 ккал (8,360 кДж); эту энергию человек получает с пищей за сутки (24 ч). Пища усваивается, а свободная энергия используется для синтеза АТР. Затем АТР предоставляет организму энергию для выполнения ежедневной химической и механической работы. Предположив, что эффективность превращения энергии пищи в АТР составляет 50%, найдите массу АТР, которая используется организмом взрослого человека за 24 ч. Какой процент от массы тела составляет АТР?
в) Несмотря на то что в организме человека каждый день синтезируются огромные количества АТР, при синтезе АТР масса человека по своему строению и составу не претерпевает значительных изменений. Объясните это кажущееся противоречие.
20. Скорости обновления y- и β-фосфатов в АТР.
Если небольшое количество АТР с радиоактивной меткой на месте последнего атома фосфора [y-32Р] АТР добавить в экстракт дрожжей, то через несколько минут примерно половина 32Р окажется в Рi; при этом концентрация АТР остается неизменной. Объясните это. Если выполнить такой же эксперимент, используя [β-32Р] АТР, меченный 32Р в центральном положении, то в течение такого же короткого промежутка времени 32Р в Pis не появляется. Почему?
21. Распад АТР до АМР и PPi в ходе метаболизма.
Синтез активированной формы ацетата (ацетил-СоА) является ATP-зависимым процессом:
Ацетат + СоА + АТР —> ацетил-СоА + АМР + PPi
а) ∆G'° гидролиза ацетил-СоА до ацетата и СоА составляет -32,2 кДж/моль, а гидролиза АТР до АМР и РРi -30,5 кДж/моль. Найдите ∆G'° ATP-зависимого синтеза ацетил-СоА.
б) Почти в каждой клетке есть фермент неорганическая пирофосфатаза, катализирующая гидролиз PPi до Pi. Какой эффект оказывает присутствие данного фермента на синтез ацетил- СоА? Объясните.
22. Энергия переноса Н+.
Париетальные клетки желудка содержат мембранные «насосы», которые обеспечивают транспорт ионов водорода из цитозоля этих клеток (pH 7,0) в желудок, обеспечивая кислотность желудочному соку (pH 1,0). Найдите свободную энергию, необходимую для транспорта 1 моль ионов водорода с помощью этого насоса. Подсказка. См. гл. 11. Температура 25 °С.
23. Стандартные восстановительные потенциалы.
Стандартный восстановительный потенциал Е'° любой редокс-пары определяется для реакции полуячейки:
Окислитель + n электронов —> восстановитель
Для сопряженных редокс-пар NAD+/NADH и пируват/лактат Е'° = -0,32 В и -0,19 В соответственно.
а) Какая сопряженная пара обладает большей склонностью к потере электронов? Поясните.
б) Какой окислитель более сильный? Поясните.
в) Если начальная концентрация каждого реагента и продукта при pH 7 составляет 1 М, в каком направлении пойдет реакция?
Пируват + NADH + Н+⇄ лактат+ - NAD+
г) Каково изменение стандартной свободной энергии ∆G′° превращения пирувата в лактат при 25 °С?
д) Какова константа равновесия К'eq этой реакции?
24. Энергетический спектр дыхательной цепи.
Перенос электронов в дыхательной цепи митохондрий можно представить суммарным уравнением
NADH + Н+ + 1/2 O2 ⇄ Н2O + NAD+
а) Найдите ∆Е'° для суммарной реакции переноса электронов в митохондриях. Используйте значения Е'° из табл. 13-7.
б) Найдите ∆G'° этой реакции.
в) Сколько молекул АТР может образоваться теоретически в этой реакции, если в клетке свободная энергия синтеза АТР 52 кДж/моль?
25. Зависимость электродвижущей силы от концентрации.
Найдите электродвижущую силу (в вольтах), регистрируемую электродом, который погружен в раствор, содержащий следующие смеси NAD+ и NADH при pH 7,0 и 25 °С относительно полуячейки с Е'° 0,00 В:
а) 1,0 мМ NAD+ и 10 мМ NADH;
б) 1,0 мМ NAD+ и 1,0 мМ NADH;
в) 10 мМ NAD+ и 1,0 мМ NADH.
26. Электронное сродство соединений.
Расположите следующие вещества в порядке увеличения стремления получать электроны: а) α-кето-глутарат + СO2 (с образованием изоцитрата); б) оксалоацетат; в) O2; г) NADP+.
27. Направление окислительно-восстановительных реакций.
Какая из следующих реакций (по вашему мнению) должна идти в прямом направлении в стандартных условиях, если предположить, что имеются соответствующие ферменты, катализирующие их?
а) Малат + NAD+ —> оксалоацетат + NADH + Н+
б) Ацетоацетат + NADH + Н+ —> β-гидроксибутират + NAD+
в) Пируват + NADH + Н+ —> лактат + NAD+
г) Пируват + β-гидроксибутират —> лактат + ацетоацетат
д) Малат + пируват —> оксалоацетат + лактат
е) Ацетальдегид + сукцинат —> этанол + фумарат
Анализ экспериментальных данных
28. «Хитрая» термодинамика.
Термодинамика — один из самых интересных разделов науки, однако интерпретация ее законов не всегда правильна. В качестве забавного примера рассмотрим фрагмент работы, выполненной Робинсоном, Хэмпсоном, Манро и Вани и опубликованной в журнале Science в 1993 г. В работе изучалась миграция небольших молекул между соседними клетками нервной системы через синаптическую щель. Выяснилось, что красители люцифер желтый (небольшая отрицательно заряженная молекула) и биоцитин (небольшой цвиттер-ион) перемещались между клетками глии двух типов (между вспомогательными клетками нервной системы) только в одном направлении. После инъекции красителей в астроциты они быстро проникали в соседние астроциты, олигодендроциты или клетки Мюллера, однако после инъекции красителей в олигодендроциты или клетки Мюллера они лишь слабо и медленно проникали в астроциты. Все эти типы клеток разделены между собой синаптическими щелями.
Хотя это и не было основной целью работы, авторы все же предложили молекулярную модель такого однонаправленного транспорта (см. рис.).
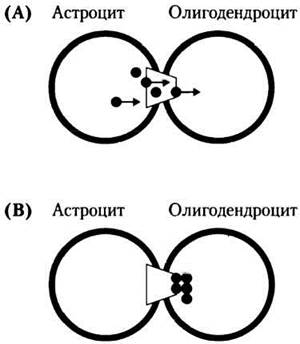
Подпись к этому рисунку гласит: «Модель однонаправленной диффузии красителей между соседними олигодендроцитами и астроцитами, основанная на различии диаметров пор. Подобно рыбе в ловушке, молекулы красителя (черные кружки) могут проходить из астроцитов в олигодендроциты (А), но не в обратном направлении (Б)».
Хотя эта статья и прошла рецензирование перед публикацией в этом авторитетном журнале, в 1994 г. редакция журнала получила несколько писем, в которых указывалось, что утверждения Робинсона с соавторами нарушают второе начало термодинамики.
а) Объясните, почему предложенная модель нарушает второе начало термодинамики. Подсказка. Рассмотрите, что было бы с энтропией системы, если бы в астроцитах и олигодендроцитах, разделенных синаптической щелью типа «ловушки для рыбы», в начальный момент времени была бы одинаковая концентрация красителя.
б) Объясните, почему данная модель непригодна для описания поведения малых молекул, хотя хорошо описывает рыбную ловлю.
в) Объясните, почему рыба попадает в ловушку, но не может из нее выбраться.
г) Предложите два возможных механизма для объяснения однонаправленного транспорта молекул красителя между клетками, которые бы не нарушали второго начала термодинамики.