Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Фибриллярные белки
Коллаген обладает как обычными, так и необычными свойствами
При кипячении в воде волокнистый, нерастворимый и неперевариваемый коллаген превращается в желатину - растворимую смесь полипептидов, которую в кулинарии используют для приготовления желе. В ходе этого превращения происходит гидролиз некоторых ковалентных связей коллагена - одна из главных причин, по которой мясо приходится подвергать тепловой обработке, так как именно коллаген соединительной ткани и кровеносных сосудов делает мясо жестким. Имеющиеся в продаже специальные препараты для размягчения мяса содержат смесь растительных ферментов, способных гидролизовать некоторые пептидные связи коллагена, в результате чего он превращается в растворимые, легко усваиваемые полипептиды.
Коллагены содержат около 35% остатков глицина и примерно 11% остатков аланина (необычно большие количества этих аминокислот). Еще более характерным отличительным признаком коллагена служит высокое содержание пролина и 4-гидроксипролина (рис. 7-13) - аминокислоты, которая, за исключением коллагена и эластина, редко встречается в белках. В сумме на долю пролина и гидроксипролина приходится около 21% всех аминокислотных остатков коллагена. Необычный аминокислотный состав коллагена с значительным преобладанием четырех аминокислот над всеми другими определяет относительно низкую питательную ценность желатины как пищевого белка. Самые лучшие пищевые белки содержат все 20 аминокислот, и в частности 10 аминокислот, образующих группу так называемых незаменимых аминокислот, которые должны присутствовать в пище большинства животных.
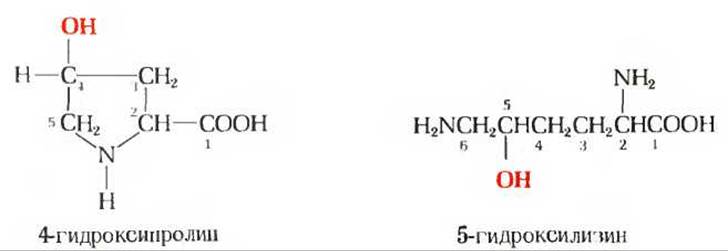
Рис. 7-13. Две нестандартные аминокислоты, присутствующие в коллагене. Они образуются из стандартных аминокислот про лина и лизина путем их гидроксилирования (введенные гидроксильные группы выделены красным цветом).
Напомним, что пролин и гидроксипролин образуют изгибы в полипептидных цепях, и потому их присутствие в белках несовместимо с существованием а-спиральной структуры.