Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Фибриллярные белки
Структура эластина придает особые свойства эластической ткани
К основным типам соединительной ткани, богатой эластином, но содержащей также небольшое количество коллагена, относятся желтая эластическая ткань связок и эластический слой соединительной ткани в стенках крупных артерий. Упругие артериальные стенки помогают распределять нагнетаемую сердцем кровь по кровеносным сосудам и сглаживать пульсовые колебания давления крови, создаваемые сокращениями сердца. В состав эластической соединительной ткани входит фибриллярный белок, который по ряду свойств напоминает коллаген, но по некоторым свойствам сильно от него отличается. Основная субъединица фибрилл эластина - тропоэластин - имеет молекулярную массу, равную приблизительно 72000, и содержит около 800 аминокислотных остатков. Подобно коллагену, эластин богат глицином и аланином. Тропоэластин отличается от тропоколлагена тем, что содержит много остатков лизина, но мало остатков пролина. Тропоэластин образует спираль особого типа, отличающуюся как от а-спирали, так и от коллагеновой спирали. Молекула тропоэластина состоит из богатых остатками глицина спиральных участков, разделенных более короткими участками, содержащими остатки лизина и аланина.

Рис. 7-15. Один из типов поперечных связей между параллельными цепями коллагена. Такие связи образуются ферментативным путем при соединении двух остатков лизина, принадлежащих соседним цепям.

Рис. 7-16. Остаток десмозина - особой аминокислоты, обнаруженной только в эластине. Ее центральная циклическая структура образуется путем взаимодействия R-групп (выделены красным цветом) четырех остатков лизина, что приводит к возникновению поперечных связей между полипептидными цепями эластина (см. рис. 7-17).
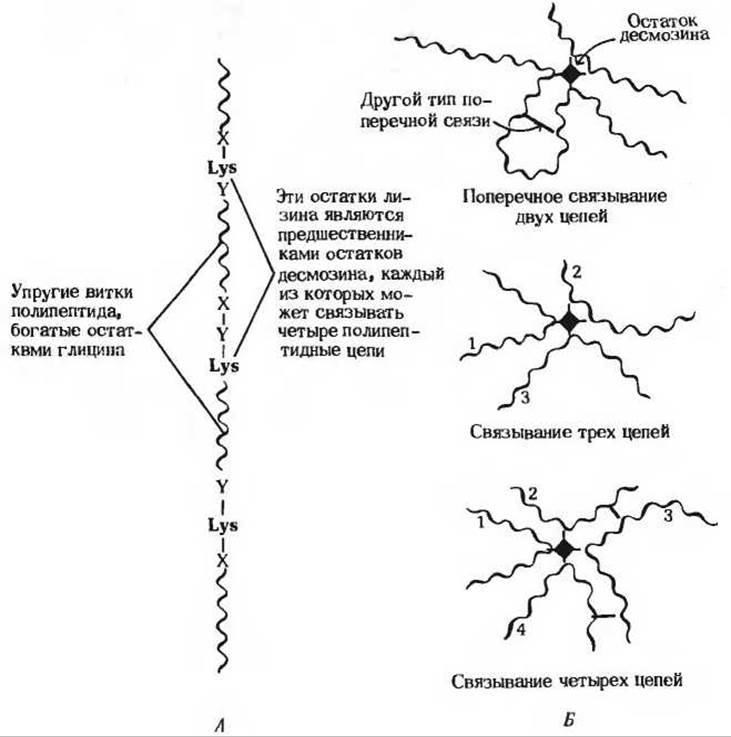
Рис. 7-17. Молекулы тропоэластина, из которых формируется сеть связанных между собой полипептидных цепей эластина.
А. Сегмент молекулы тропоэластина. Б. Точная структура эластина не установлена. Известно, однако, что молекулы тропоэластина соединены поперечными связями и образуют единую двумерную или трехмерную сеть, обладающую высокой степенью эластичности. Помимо остатков десмозина (выделенных цветом), связывающих между собой две, три или четыре молекулы тропоэластина, как показано на рисунке, в эластине имеются и другие виды поперечных связей (тоже выделенных красным цветом).
Спиральные участки растягиваются при натяжении, но возвращаются к исходной длине при снятии нагрузки. Области, содержащие остатки лизина, принимают участие в формировании ковалентных поперечных связей. Четыре R-группы лизина сближаются друг с другом и ферментативным путем превращаются в десмозин (разд. 5.10), структура которого показана на рис. 7-16, или в сходный по структуре изодесмозин. Таким путем полипептидные цепи тропоэластина могут объединяться в системы, способные обратимо растягиваться во всех направлениях (рис. 7-17).