Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Фибриллярные белки
Краткое содержание главы
Существуют четыре типа фибриллярных белков, выполняющих в животных организмах защитную или структурную роль: а-кератин, ß-кератин, коллаген и эластин. При их изучении были получены важные сведения о соотношении между структурой и функцией молекул белков. а-Кератины - это нерастворимые и плотные белки, входящие в состав волос, шерсти, перьев, чешуи, рогов и копыт, а также панцыря черепахи. Рентгеноструктурный анализ показывает, что фибриллы а-кератина имеют период повторяемости около 0,54 нм и что их полипептидные цепи скручены в спираль. Данные рентгеноструктурного анализа свидетельствуют также о жесткости и плоской конфигурации пептидных групп. Это обусловлено тем, что С—N-связи полипептидного остова частично имеют характер двойных связей. На основе этих наблюдений был сделан вывод, что полипептидные цепи а-кератина существуют в форме правых а-спиралей, на каждый виток которых приходится 3,6 аминокислотных остатков, при этом шаг спирали составляет 0,54 нм. Все пептидные группы участвуют в образовании внутрицепочечных водородных связей, стабилизирующих а-спираль. Дестабилизирующее действие на а-спираль оказывают расположенные по соседству R-группы, несущие электрический заряд одного и того же знака или имеющие большие размеры, а также остатки пронина, которые изгибают цепь и искажают а-спираль. Волосы представляют собой скрученные наподобие каната многожильные структуры, образованные а-спиральными полипептидными цепями, обвитыми одна вокруг другой в виде суперспирали. В а-кератинах имеется много поперечных связей, в образовании которых участвуют остатки цистина.
ß-Кератины (наиболее типичным примером может служить фиброин шелка) имеют периодичность около 0,70 нм. Такую же периодичность приобретает обработанный паром и растянутый а-кератин. В ß-кератинах полипептидная цепь вытянута вдоль одной оси в виде зигзагообразной структуры. Соседние полипептидные цепи ß-кератинов соединены между собой водородными связями; они антипараллельны, т.е. ориентированы в противоположных направлениях, и образуют складчатый слой, по обе стороны которого выступают R-группы. ß-Кератины содержат много остатков глицина и аланина.
Коллаген - наиболее распространенный из всех белков, обнаруженных у позвоночных. Он содержится в сухожилиях, волокнистой соединительной ткани кожи, кровеносных сосудах, костях и хрящах. Фибриллы коллагена состоят из трех навитых друг на друга полипептидных цепей, каждая из которых образует изломанную спираль особого типа, содержащую около 21% остатков пролина и гидроксипролина. Фибриллы коллагена нерастяжимы и имеют очень большую прочность на разрыв. При частичном гидролизе коллаген превращается в желатину - растворимую и перевариваемую смесь полипептидов. Эластин, специфический белок эластической соединительной ткани, существует в виде сети полипептидных цепей, поперечносвязанных остатками десмозина. Он обладает большой упругостью. Миозин, актин и тубулин представляют собой примеры внутриклеточных нитевидных белков, участвующих в зависимых от энергии АТР процессах мышечного сокращения и перемещения клеток.
ЛИТЕРАТУРА
Книги
См. также библиографию к главам 6 и 8 Cantor С. R., Schimmel P.R., Biophysical Chemistry, р. I. The Conformation of Biological Macromolecules, Freeman, San Francisco, 1980.
Dickerson R.E., Geis I. Proteins: Structure, Function, and Evolution, Benjamin/Cummings, Menlo Park, Calif., 1983.
Schultz G. E., Schirmer R. H, Principles of Protein Structure, Springer-Verlag, New York, 1979.
Некоторые интересные статьи
Eyre D. R. Collagen: Molecular Diversity in the Body’s Protein Scaffold, Science, 27, 1315, March (1980).
Fraser R. D. B. Keratins, Sсi. Am., 221, 86-96. August (1969).
Gross J. Collagen, Sсi. Am., 204, 120-130, May (1961).
Вопросы и задачи
1. Свойства пептидной связи. При рентгено-структурном исследовании кристаллических пептидов Лайнус Полинг и Роберт Кори обнаружили, что С—N-связь пептидной группы по длине (0,132 нм) занимает промежуточное положение между типичными одинарными С—N-связями (0,149 нм) и двойными C=N-связями (0,127 нм). Кроме того, они установили, что пептидная группа имеет плоскую конфигурацию, т.е. все четыре атома, присоединенные к С—N-группе, лежат в одной плоскости, причем два а-атома углерода, связанные с С—N-группой, всегда находятся в транс-положении, т.е. по разные стороны от пептидной связи.
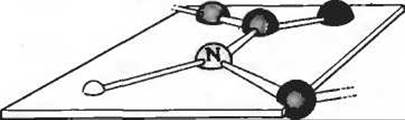
а) Какой вывод можно сделать исходя из длины С—N-связи в пептидной группе относительно прочности этой связи и ее кратности (т. е. является ли она одинарной, двойной или тройной)?
б) Продолжив ответ на предыдущий вопрос, объясните, почему такая С—N-связь занимает по своей длине промежуточное положение между двойными и одинарными связями.
в) Что можно сказать на основе данных Полинга и Кори о возможности вращения вокруг пептидной С—N-связи?
2. Ранние данные о структуре шерсти. Уильям Астбери первым заметил, что рентгенограмма шерсти указывает на присутствие структурной единицы, повторяющейся вдоль волокна с интерналом около 0,54 нм. После растяжения шерсти, подвергнутой действию пара, на рентгенограмме появлялись признаки изменения периодичности структуры: новая структурная единица повторялась через каждые 0,70 нм. После того как обработанная паром шерсть укорачивалась, на рентгенограмме снова возникала периодичность около 0,54 нм. Хотя эти наблюдения послужили ключом к пониманию молекулярной структуры шерсти, Астбери не смог в то время их интерпретировать. Исходя из современных данных о структуре шерсти, объясните эти наблюдения.
3. Скорость синтеза а-кератина волос. По нашим меркам волос растет относительно медленно - со скоростью 15-20 см в год. Зона роста находится у основания волоса, где в клетках эпидермиса синтезируются а-кератиновые нити, скручивающиеся затем наподобие канатов (см. рис. 7-9). Основным структурным элементом cc-кератина является а-спираль, шаг которой составляет 0,54 нм, а на виток приходится 3,6 аминокислотных остатков (см. рис. 7-6). В предположении, что фактором, лимитирующим рост волос, служит биосинтез а-спиральных цепей кератина, рассчитайте скорость образования пептидных связей в цепях «-кератина (число пептидных связей в 1 с), которая могла бы обеспечить наблюдаемое удлинение волос за 1 год.
4. Влияние pH на конформацию полиглутаминовой кислоты и полилизина. Развертывание полипептидной цепи, имеющей а-спиральную конформацию, с образованием беспорядочного клубка сопровождается резким понижением удельного оптического вращения. Полиглутаминовая кислота - полипептид, состоящий только из остатков глутаминовой кислоты-при pH 3 имеет а-спиральную конформацию. Однако при повышении pH до 7 величина удельного оптического вращения раствора сильно понижается. Аналогичная картина наблюдается в случае полилизина, который при pH 10 имеет а-спиральную конформацию, но при понижении pH до 7 его удельное оптическое вращение сильно уменьшается, как показано на графике.

Как объяснить подобное влияние pH на конформацию полиглутаминовой кислоты и полилизина? Почему переход из одной конформации в другую происходит в таком узком интервале значений pH?
5. Содержание цистина определяет механические свойства многих белков. В молекулах целого ряда природных белков содержится большое число остатков цистина. При этом наблюдается корреляция между механическими свойствами белков (прочностью на разрыв, вязкостью, твердостью и т.д.) и содержанием цистина. Например, глутенин (богатый цистином белок пшеницы) определяет вязкость и эластичность теста, приготовленного из пшеничной муки. Точно так же твердый и прочный панцирь черепахи обязан этими свойствами высокому содержанию цистина в а-кератине, из которого он состоит. Какова молекулярная основа наблюдаемой корреляции между содержанием цистина и механическими свойствами белка?
6. Почему шерсть садится? Если шерстяной свитер или шерстяные носки постирать в горячей воде, а затем высушить в электросушилке, они становятся меньше. Исходя из того, что известно о структуре а-кератина, как объяснить это явление? Вместе с тем шелк при тех же условиях не дает такой усадки. Объясните, почему.
7. Устойчивость цистин-содержащих белков к нагреванию. Большинство глобулярных белков при кратковременном нагревании до 65°С денатурирует (претерпевает процесс разворачивания цепей) с полной потерей активности. Однако те глобулярные белки, в которых содержится много остатков цистина, денатурируют только при более длительном нагревании до более высоких температур. Одним из таких белков является рибонуклеаза, содержащая 124 аминокислотных остатка в единственной полипептидной цепи, в которой имеется четыре поперечные дисульфидные связи, образованные остатками цистина. Чтобы полипептидная цепь рибонуклеазы развернулась, необходимо нагреть содержащий ее раствор до высокой температуры; если затем быстро охладить его, то ферментативная активность восстанавливается. Можете ли вы указать молекулярную основу такого поведения?
8. Разрыв цистиновых поперечных связей. Поперечные —S—S-связи образуются в белках в тех случаях, когда два остатка цистеина в одной и той же цепи или в разных цепях подвергаются действию окислителя. При определении аминокислотной последовательности белка по ряду практических соображений сначала следует разорвать все —S—S-связи. Поскольку это процесс, обратный окислению, его проводят при помощи восстановителя.
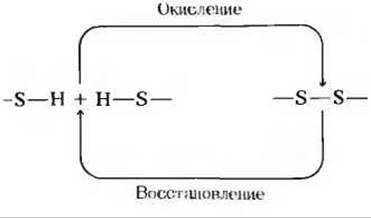
а) Один из стандартных способов разрыва дисульфидных мостиков состоит в обработке белка избытком 2-меркаптоэтанола (HSCH2CH2OH). Объясните, на чем основан этот способ.
б) Один из недостатков указанного способа заключается в том, что после разрыва поперечных цистиновых связей они могут образоваться вновь. Почему это происходит?
9. Периодичность расположения ß-слоев в нитях шелка. Химическое исследование продукта, полученного в результате частичного гидролиза фиброина шелка, вырабатываемого гусеницами шелкопряда Bombyx mori. показало, что в полипептидной цепи этого белка много раз повторяется сегмент из шести остатков
(—Gly—Ser—Gl) —Ala— Gly—Ala—)n.
Вместе с тем из данных ренті еноструктурного анализа следует, что основная структурная единица повторяется в фиброине с интервалом 0,70 нм (см. текст). Однако при этом были выявлены еще две повторяющиеся единицы с периодами 0,35 и 0,57 нм, соответствующие расстояниям между ß-слоями. Предложите схему расположения указанных сегментов из шести остатков, из которой бы следовали эти расстояния между ß-слоями в фиброине шелка.
10. Бактериородопсин белок пурпурной мембраны. При благоприятных внешних условиях бактерия Halobacterium halobium, растущая в среде, содержащей высокие концентрации солей, синтезирует мембранный белок (мол. масса 26 000), известный под названием бактериородопсин. Молекулы этого белка, имеющего пурпурный цвет, обусловленный присутствием в них ретиналя, образуют в клеточной мембране агрегаты в виде пурпурных «заплаток». Бактериородопсин действует как активируемый светом протонный насос и таким образом снабжает клетки энергией. Было показано, что этот белок состоит из семи параллельных а-спиральных сегментов, пронизывающих мембрану бактериальной клетки толщиной 4,5 нм. Рассчитайте минимальное число аминокислот, которое должно содержаться в одном сегменте а-спирали, чтобы он мог полностью пронизывать мембрану. Оцените, какая доля аминокислотных остатков бактериородопсина участвует в образовании а-спиральных сегментов (средняя молекулярная масса одного аминокислотного остатка равна 110). Приведите обоснование ваших расчетов.
11. Биосинтез коллагена. Коллаген, количественно преобладающий над всеми другими белками в организме млекопитающих, имеет необычный аминокислотный состав. В отличие от большинства других белков он очень богат пролином и гидроксипролином (см. рис. 7-13). Поскольку гидроксипролин не входит в число 20 аминокислот, обычно присутствующих в белках, eго включение в коллаген может идти двумя путями: 1) путем ферментативного гидроксилирования пролина в гидроксипролин перед его включением в коллаген и 2) путем гидроксилирования пролина, уже включенного в состав коллагена. Для того чтобы сделать выбор между этими двумя возможностями, были выполнены следующие эксперименты. Сначала в организм крысы с пищей вводили 14С-пролин и из хвоста выделяли коллаген. При этом оказалось, что новосинтезированный коллаген радиоактивен. Затем точно так же вводили 14С-гидроксипролин. но в этом случае в новосинтезированном коллагене радиоактивности не было обнаружено. Как на основе этих экспериментов сделать выбор между двумя рассматриваемыми возможностями?
12. Патогенное действие бактерий, вызывающих газовую гангрену. Патогенные анаэробные бактерии Clostridium perfringens, являющиеся возбудителями газовой гангрены, при которой происходит разрушение тканей, выделяют фермент, эффективно катализирующий гидролиз пептидной связи (красный цвет) в изображенной ниже последовательности:
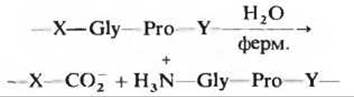
где X и Y любая из 20 аминокислот. Каким образом этот секретируемый фермент помогает бактерии проникать в ткани человека? Почему этот фермент не приносит вреда самой бактерии?