Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Глобулярные белки: структура и функция гемоглобина
Аминокислотная последовательность белка определяет его третичную структуру
Как мы уже поняли из рассмотрения а-спирали и ß-конформации, вторичная структура полипептидной цепи, характеризующая взаимное расположение соседних аминокислотных остатков, определяется ее аминокислотной последовательностью. а-Спираль и ß-конформация возникают самопроизвольно и остаются устойчивыми лишь в том случае, если набор расположенных по соседству аминокислотных остатков в полипептидной цепи имеет соответствующую последовательность R-гpyпп. Третичная структура глобулярных белков тоже обусловлена их аминокислотной последовательностью. Но если вторичная структура определяется последовательностью R-групп в близких участках цепи (т.е. ближним порядком), то третичная структура зависит от аминокислотной последовательности далеко расположенных друг от друга участков цепи (т. е. от дальнего порядка). Образование изгибов полипептидной цепи, а также направление и угол поворота цепи в этих изгибах обусловлены числом и положением определенных аминокислотных остатков, таких, как пролин, треонин и серин, которые способствуют образованию изгибов. Более того, как мы увидим дальше, петли плотно свернутой полипептидной цепи сохраняют характерное для них положение в пространстве также благодаря разного рода взаимодействиям между R-группами соседних петель.
Многие инвариантные аминокислотные остатки гомологичных белков, т. е. остатки, присутствующие всегда в определенных положениях полипептидных цепей независимо от вида организма. из которого получен белок, по всей вероятности, занимают наиболее важные в структурном отношении места в полипептидной цепи. Одни из инвариантных остатков встречаются вблизи изгибов цепи или в самих изгибах, тогда как другие, например остатки цистина, находятся в тех местах цепи, где между близко расположенными петлями третичной структуры возникают поперечные связи. Ряд инвариантных аминокислотных остатков занимает строго определенное положение в каталитических центрах ферментов или в местах связывания простетических групп, например гемогруппы в цитохроме с.
Но наиболее убедительное доказательство того, что третичная структура глобулярного белка определяется его аминокислотной последовательностью, получено в экспериментах, в которых было показано, что денатурация некоторых белков - это обратимый процесс. У большинства глобулярных белков при нагревании или под воздействием экстремальных значений pH происходит развертывание цепей и утрата биологической активности без разрыва ковалентных связей полипептидного остова. Многие годы процесс денатурации белков считался необратимым; например, белок, свернувшийся при варке яиц, после охлаждения уже не возвращается в исходное растворимое состояние. Однако было обнаружено, что у некоторых глобулярных белков, денатурированных путем нагревания или под воздействием экстремальных значений pH, нативная структура и биологическая активность восстанавливаются при медленном охлаждении раствора белка или медленном изменении его pH до нормального значения; такой процесс называется ренатурацией.
Классический пример ренатурации представляет ренатурация рибонуклеазы, одноцепочечного белка с четырьмя внутрицепочечными дисульфидными связями. Кристаллическая рибонуклеаза может денатурировать при обработке ее концентрированным раствором мочевины в присутствии восстановителя, который разрывает дисульфидные связи четырех остатков цистина с образованием восьми остатков цистеина. В этих условиях полипептидная цепь полностью развертывается, образуя множество беспорядочных петель, и фермент утрачивает каталитическую активность (рис. 8-8). Если мы теперь поместим раствор денатурированной рибонуклеазы в диализный мешочек (стр. 144) и погрузим этот мешочек в воду, то низкомолекулярные вещества (мочевина и восстановитель) в результате диффузии будут выходить из раствора рибонуклеазы во внешнюю среду. По мере постепенного удаления этих веществ беспорядочно скрученная денатурированная рибонуклеаза будет самопроизвольно и медленно возвращаться к нативному состоянию, приобретая присущую ей правильную трехмерную третичную структуру с полным восстановлением каталитической активности (рис. 8-8). Этот эксперимент доказывает, что информация, необходимая для правильного свертывания полипептидной цепи рибонуклеазы, заложена в первичной структуре полипептидной цепи, т.е. в ее аминокислотной последовательности.
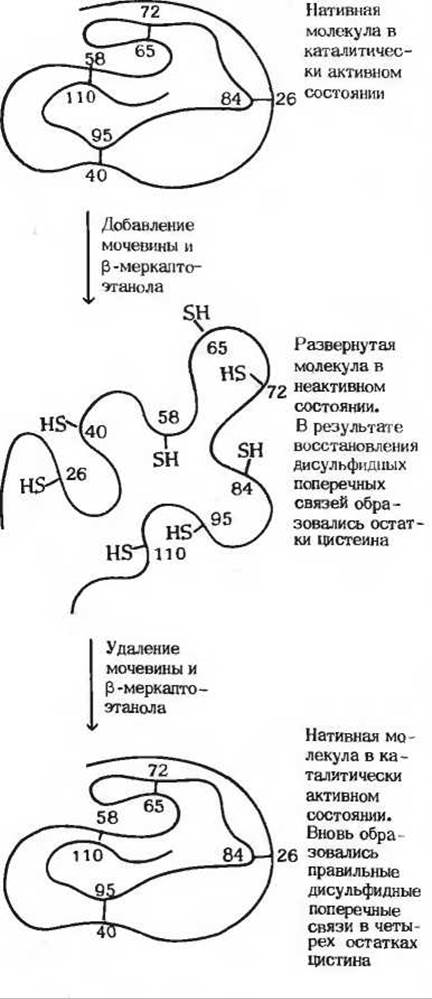
Рис. 8-8. Ренатурация развернутой (денатурированной) рибонуклеазы с воссозданием правильно расположенных дисульфидных поперечных связей. При добавлении мочевины в молекуле рибонуклеазы разрушаются водородные связи, а последующая обработка белка меркаптоэтанолом (CH3CH2SH) приводит к восстановлению и тем самым к разрыву дисульфидных связей четырех остатков цистина, которые при этом превращаются в восемь остатков цистеина.
В ходе того же эксперимента было получено еще одно доказательство точности свертывания рибонуклеазы при ее ренатурации. Оказалось, что восемь остатков цистеина, образовавшихся в реакции восстановления остатков цистина в полностью развернутой рибонуклеазе, постепенно окисляются под действием атмосферного кислорода, в результате чего образуются четыре внутрицепочечные дисульфидные связи точно в тех же положениях, что и в исходной нативной рибонуклеазе. Это замечательное явление. Случайная комбинация восьми остатков цистеина с образованием остатков цистина теоретически может дать 105 различных вариантов, однако в ходе ренатурации реализуется один-единсгвенный специфический набор дисульфидных поперечных связей, характерный для нативной рибонуклеазы (рис. 8-8). Таким образом, полипептидная цепь денатурированной рибонуклеазы свертывается очень точно, что и приводит к формированию уникальной биологически активной конформации, исключая образование какой бы то ни было «неправильной» конформации. Этот классический эксперимент, выполненный Кристианом Анфинсеном в 50-х годах, доказал, что аминокислотная последовательность полипептидной цепи содержит всю информацию, необходимую для того, чтобы цепь свернулась в нативную трехмерную структуру.