Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Глобулярные белки: структура и функция гемоглобина
Оксигенация гемоглобина вызывает изменение его пространственной конформации
Ответ на эти вопросы был получен после того, как выяснилось, что молекула дезоксигемоглобина при связывании кислорода претерпевает конформационные изменения. Первое указание на существование таких изменений относится к тому времени, когда было обнаружено, что кристаллы дезоксигемоглобина, выращенные в бескислородной атмосфере, разрушаются, как только вступают в контакт с кислородом. Это наблюдение наводило на мысль о том, что при связывании кислорода молекулы гемоглобина изменяются в своих размерах и уже не укладываются в кристаллическую решетку дезоксигемоглобина. Это предположение было полностью подтверждено результатами сравнительного рентгеноструктурного анализа, которые показали, что дезоксигемоглобин и оксигемоглобин имеют разные пространственные конформации (рис. 8-10 и 8-18). При оксигенации дезоксигемоглобина третичная структура а- и ß-цепей практически не изменяется, поскольку они остаются плотно пригнанными друг к другу и образуют димеры а1ß1, и а2ß2. Однако, как только кислород присоединяется к гемогруппам дезоксигемоглобина, половинки молекулы a1ß1 и а2ß2, сохраняя свойственную им жесткую конформацию, изменяют свое положение относительно друг друга и теснее сближаются между собой. Иными словами, оксигенация гемоглобина вызывает изменение его четвертичной структуры, т. е. упаковки субъединиц. В результате молекула оксигемоглобина приобретает несколько более компактную структуру по сравнению с дезоксигемоглобином, и центральная полость уменьшается. Гемы двух ß-цепей сближаются друг с другом, а гемы двух a-цепей раздвигаются, что и приводит к сигмоидной форме кривой насыщения кислородом. Вследствие этих изменений аминокислотные остатки в а- и ß-цепях, связывающие ионы Н+, перемещаются из относительно гидрофильного окружения в более гидрофобное, что облегчает отщепление ионов Н+ от протонированных групп; иначе говоря, при оксигенации гемоглобина протонированные группы приобретают свойства более сильных кислот, чем и объясняется эффект Бора. Таким образом, изменение четвертичной структуры гемоглобина в результате его оксигенации находится в прямой связи с существованием обратного соотношения между сродством гемоглобина к кислороду и его сродством к СО2 и ионам Н+.
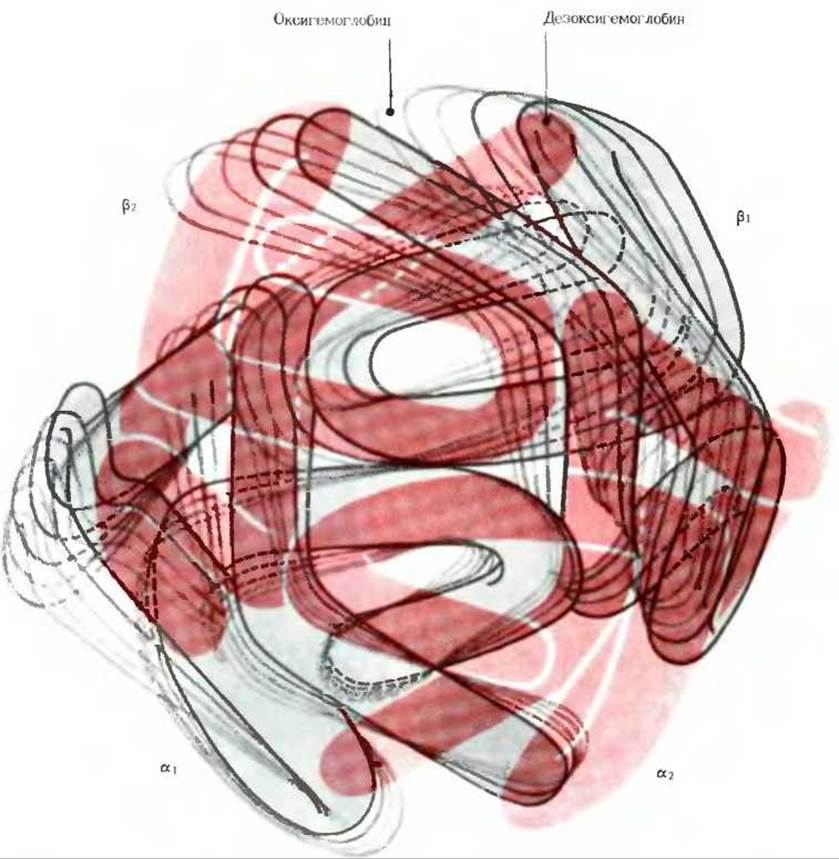
Рис. 8-18. Схематическое изображение (в виде «стоп-кадров») изменений в четвертичной структуре гемоглобина, обусловленных перемещением пары субъединиц а1ß1 относительно неподвижной пары а2ß2 в процессе освобождения кислорода из оксигемоглобина, переходящего в форму дезоксигемоглобина.
Наконец, еще одну особенность регуляторных свойств гемоглобина выявили Рейнгольд Бенеш и Руфь Бенеш, обнаружившие четвертый лиганд гемоглобина -2,3-дифосфоглицерат. Об этой интересной особенности рассказывается в дополнении 8-1.
Дополнение 8-1. Дифосфоглицерат и сродство гемоглобина к кислороду
Уже давно известно, что 2,3-дифосфоглицерат (рис. 1) присутствует в эритроцитах в довольно высоких концентрациях, однако функция этого соединения оставалась загадкой до тех пор, пока не было обнаружено, что он оказывает сильное влияние на сродство гемоглобина к кислороду. При добавлении 2,3-дифосфоглицерата (ДФГ) к раствору чистого гемоглобина сродство гемоглобина к кислороду значительно снижается. Этот эффект обусловлен тем, что ДФГ сам связывается с дезоксигемоглобином. Следовательно, можно написать уравнение еще одной (четвертой по счету) реакции связывания гемоглобина с лигандом:
Нb-ДФГ + O2⇄ HbO2 + ДФГ.
Таким образом, наблюдается обратная зависимость между двумя процессами - связыванием кислорода и ДФГ (присоединяющихся к разным участкам молекулы гемоглобина).
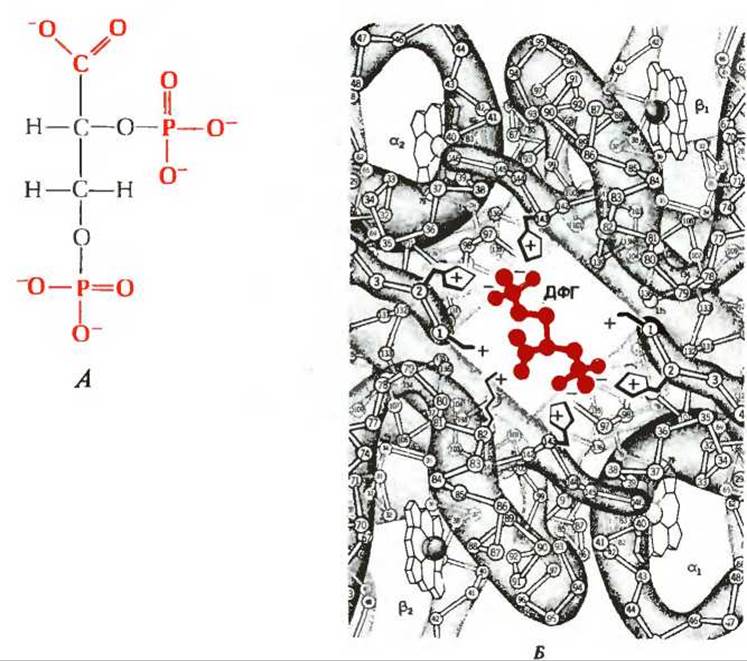
Рис. I. А. Структура 2,3-дифосфоглицерата (ДФГ). Красным цветом выделены заряженные группы, взаимодействующие с двумя ß-цепями. Б. Расположение молекулы ДФГ (выделена красным цветом) в центральной полости гемоглобина. Отрицательно заряженные группы ДФГ притягиваются к находящимся поблизости положительно заряженным R-группам ß-цепей (показаны жирными черными линиями).
Регулирующее влияние ДФГ на сродство гемоглобина к кислороду в эритроцитах зависит от величины парциального давления кислорода в легких. После того как здоровый человек поднимется, скажем, на высоту 4000 м над уровнем моря, в течение первых нескольких часов концентрация ДФГ в его эритроцитах будет возрастать; при этом число молекул ДФГ, связанных с гемоглобином, увеличится, а сродство гемоглобина к кислороду снизится. На большой высоте парциальное давление кислорода значительно ниже, чем на уровне моря. Поэтому и в тканях парциальное давление кислорода снижается. Увеличение содержания ДФГ в эритроцитах при восхождении на большую высоту облегчает освобождение кислорода из гемоглобина в тканях. Изменения противоположного характера наблюдаются у людей, акклиматизировавшихся к условиям высокогорья, например у жителей Гималаев или Андов, когда они спускаются в долины. Повышение концентрации ДФГ в эритроцитах наблюдается также у людей при гипоксии; это патологическое состояние возникает вследствие недостаточного снабжения тканей кислородом, что может быть обусловлено заболеваниями органов дыхания или нарушениями в системе кровообращения.
С каким участком молекулы гемоглобина связывается ДФГ? В молекуле гемоглобина имеется открытая центральная полость, или канал, который хорошо виден на рис. 8-10. Этот канал, выстланный многими положительно заряженными R-группами, и служит местом связывания ДФГ, который присоединяется к дезоксигемоглобину и образует поперечную связь (солевой мостик) между двумя ß-субъединицами. При связывании гемоглобином кислорода ДФГ вытесняется из полости. Гемоглобин связывает только одну молекулу ДФГ (рис. 1); напомним, что он может связывать по четыре молекулы O2 или СO2 и примерно четыре иона Н+.
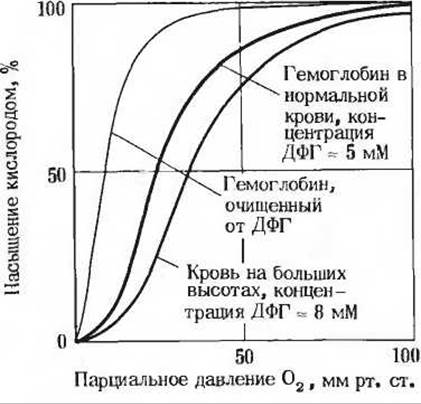
Рис. 2. Влияние ДФГ на кривую насыщения гемоглобина кислородом.
При обычном выделении гемоглобина из крови он содержит довольно большое количество ДФГ, от которого трудно освободиться полностью. При полном удалении ДФГ из гемоглобина кривая связывания его с кислородом в значительной степени утрачивает свою сигмоидную форму и гемоглобин приобретает намного более высокое сродство к кислороду. После добавления избытка ДФГ к гемоглобину способность последнего к связыванию кислорода понижается (рис. 2). Таким образом, присутствие ДФГ весьма существенно для нормального освобождения кислорода из гемоглобина в тканях. В эритроцитах некоторых птиц содержится не ДФГ, а другое фосфатсодержащее соединение - инозитолгексафосфат, который даже еще более эффективно, чем ДФГ, снижает сродство гемоглобина к кислороду.
Гемоглобин можно рассматривать как молекулярную автоматическую систему управления, которая отзывается на изменение концентрации любого из его четырех лигандов, передает соответствующую информацию, преобразуя ее в конформационные изменения молекулы, и таким путем регулирует свое сродство к другим лигандам. Считается, что связывание кислорода с одной или двумя субъединицами вызывает в них небольшие конформационные изменения, способствующие конформационным перестройкам пустых (не заполненных кислородом) субъединиц, в результате чего изменяется четвертичная структура всей молекулы; при этом ее сродство к кислороду повышается, а сродство к СО2 и ионам Н+ понижается. Наоборот, при освобождении кислорода четвертичная структура вновь принимает исходную форму, способствующую связыванию СО2 и ионов Н+. Были предложены различные теории для детального объяснения всех структурных изменений гемоглобина, наблюдаемых в процессе его оксигенации и дезоксигенации, а также происходящих при этом изменений в его способности к связыванию лигандов (рис. 8-19). Но каковы бы ни были детали всех этих изменений, ясно одно - гемоглобин может служить моделью автоматической регулирующей системы при рассмотрении других олигомерных белков. например ферментов, особенно тех из них, которые обладают как каталитической, так и регуляторной активностью. Многие белки, наделенные такими регуляторными свойствами, состоят из двух или большего числа пригнанных одна к другой полипептидных цепей, образующих характерную четвертичную структуру, способную изменяться при переходе белка из одного активного состояния в другое в процессе его функционирования.

Рис. 8-19. Симметричная («все или ничего») и последовательная (индуцированное соответствие) модели кооперативного связывания кислорода гемоглобином. В обеих моделях субъединицы могут находиться в двух различных состояниях. Кружками обозначено состояние, в котором субъединицы имеют низкое сродство к кислороду, а квадратами состояние с высоким сродством к кислороду. А. Согласно симметричной модели («все или ничего»), гемоглобин может находиться только в двух формах: в одной из них все субъединицы имеют низкое сродство к кислороду, а в другой - высокое. При отсутствии кислорода обе эти формы находятся в равновесии, но форма с низким сродством к кислороду доминирует. Если же кислород присутствует, то он связывается преимущественно с формой гемоглобина, имеющей высокое сродство; при этом равновесие сдвигается вправо и вероятность связывания с гемоглобином оставшегося кислорода увеличивается. В симметричной модели не предусматривается существования промежуточных форм но отношению к формам с низким и высоким сродством к кислороду. Б. В последовательной модели (модели индуцированoго соответствия) имеется несколько промежуточных конформаций, последовательно приближающихся к форме с высоким сродством к кислороду. Связывание молекулы кислорода с одной из субъединиц, имеющей низкое сродство к кислороду, индуцирует переход этой субъединицы в форму с высоким сродством. Такой переход в свою очередь повышает вероятность того, что последовательное присоединение кислорода к другим субъединицам будет индуцировать их переход в форму с высоким сродством.