Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Глобулярные белки: структура и функция гемоглобина
Серповидная форма эритроцитов обусловлена склонностью молекул гемоглобина S к агрегации
Замена двух остатков глутаминовой кислоты остатками валина в молекуле белка, содержащей 574 аминокислотных остатка, на первый взгляд кажется не очень значительным изменением, однако остаток, занимающий шестое положение в ß-цепи. оказывает весьма сильное влияние на четвертичную структуру гемоглобина. Появление валина в положении, нормально занимаемом остатком глутаминовой кислоты, приводит к возникновению «липкого» гидрофобного контакта на поверхности молекулы, где расположен шестой остаток ß-цепи. В результате молекулы дезоксигемоглобина S слипаются и образуют аномально длинные нитевидные агрегаты, которые и обусловливают серповидную форму эритроцитов (рис. 8-21).
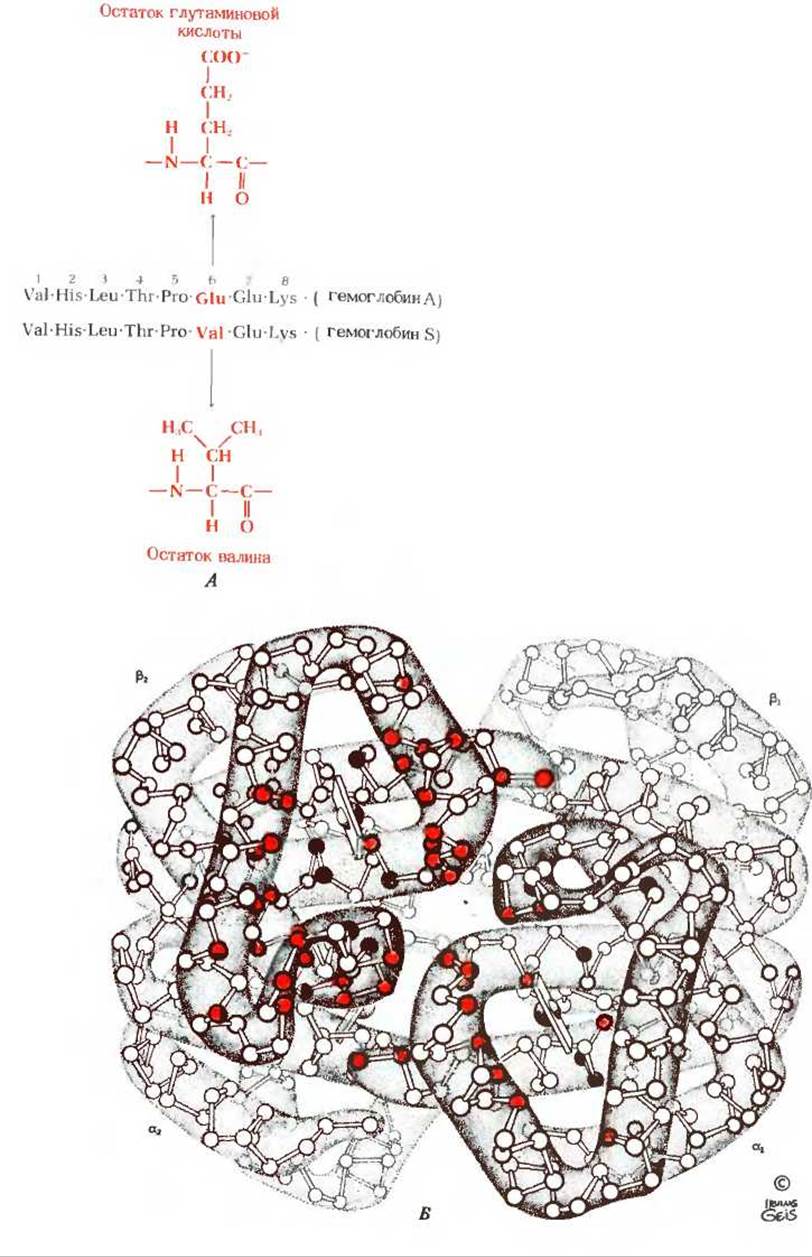
Рис. 8-23. А. Генетическое нарушение в серповидноклеточном гемоглобине.
В результате мутации гена, кодирующего ß-цепь, остаток глутаминовой кислоты, присутствующий в положении 6 ß-цепи нормального гемоглобина А. замещен на остаток валина. Такая замена приводит к утрате одного отрицательного заряда в каждой из двух ß-цепей. Б. Расположение 163 мутаций (кружки, обведенные черной линией), зарегистрированных в гемоглобинах человека к 1979 г. 105 мутаций находится в ß-цепях и 58 мутаций в a-цепях. Инвариантные для обеих цепей остатки обозначены красными кружками. Мутации, локализованные в окрестности гемогруппы, с большой степенью вероятности приводят к серьезным функциональным нарушениям гемоглобина.