Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Глобулярные белки: структура и функция гемоглобина
Краткое содержание главы
Глобулярные белки, судя по результатам исследования их формы и размеров, имеют компактно свернутые полипептидные цепи. Рентгеноструктурный анализ миоглобина и других небольших по размерам одноцепочечных белков, таких, как цитохром, с, лизоцим и рибонуклеаза, показывает, что для каждого из этих белков характерна определенная третичная структура, т.е. специфический способ свертывания полипептидной цепи в пространстве. Во всех глобулярных белках полипептидные цепи очень плотно свернуты, так что внутри молекулы белка если и остается, то лишь немного места для молекул воды. Почти все гидрофобные R-группы скрыты внутри молекулы и экранированы от взаимодействия с водой, большинство же ионных R-групп находится на поверхности в гидратированном состоянии и обращено в сторону водного окружения. Третичная структура свернутой полипептидной цепи стабилизируется целым рядом нековалентных взаимодействий (особенно гидрофобными взаимодействиями между неполярными R-группами), электростатическим притяжением между противоположно заряженными R-группами и водородными связями. Все эти взаимодействия, будучи слабыми по своей природе, в совокупности оказываются очень прочными. В некоторых глобулярных белках определенную роль в формировании и стабилизации третичной структуры играют дисульфидные поперечные связи. Информация, определяющая третичную структуру белков, заложена в аминокислотной последовательности их полипептидных цепей, о чем свидетельствует тот факт, что гомологичные белки из разных видов имеют не только много общих инвариантных аминокислотных остатков, но и одинаковую конформацию. Доказательством этого утверждения служит то, что многие денатурированные глобулярные белки, утратившие свойственную им биологическую активность, способны самопроизвольно ренатурировать с полным восстановлением их биологической активности.
Олигомерные глобулярные белки, содержащие две или большее число полипептидных цепей, представляют собой более крупные по сравнению с одноцепочечными белками молекулы с более сложной структурой, часто наделенные регуляторными свойствами. Способ упаковки отдельных полипептидных цепей (субъединиц) в молекуле олигомерного белка называется его четвертичной структурой. Рентгеноструктурный анализ гемоглобина и других олигомерных белков позволил установить, что они тоже имеют очень компактную структуру, причем большинство гидрофобных R-групп находится внутри глобулы, а большинство гидрофильных R- групп-снаружи. В молекуле гемоглобина, состоящей из двух a-цепей и двух ß-цепей, возникает лишь небольшое число контактов между одинаковыми цепями и множество контактов, соединяющих вместе а- и ß-субъединицы с образованием пар а1β1, и a2ß2. Кривая насыщения гемоглобина кислородом имеет сигмоидную форму, поэтому гемоглобин хорошо приспособлен для связывания кислорода в легких и его освобождения в периферических тканях. Миоглобин в отличие от гемоглобина обладает значительно более высоким сродством к кислороду и характеризуется гиперболической кривой насыщения кислородом, благодаря чему он наделен способностью запасать кислород в мышцах. Кислород легче связывается гемоглобином при более высоких значениях pH и низкой концентрации СО2; освобождению же кислорода из гемоглобина благоприятствуют более низкие значения pH и высокие концентрации СО2. Эти соотношения, равно как и регулирующее воздействие связывающегося с гемоглобином 2,3-дифосфоглицерата (ДФГ) на сродство гемоглобина к кислороду, обусловлены наличием у гемоглобина четырех специфических центров связывания с О2, СО2, ионами Н+ и ДФГ, а также изменениями в четвертичной структуре гемоглобина в цикле оксигенация-дезоксигенация. Таким образом, субъединицы гемоглобина, подобно субъединицам других олигомерных белков, способны передавать сигналы о регуляторных взаимодействиях посредством конформационных изменений молекулы белка. Изменения в аминокислотной последовательности глобулярных белков, обусловленные генными мутациями, например замена двух аминокислотных остатков в молекуле гемоглобина при серповидноклеточной анемии, могут вызвать значительные изменения конформации белка и, следовательно, сказаться на его биологических функциях.
ЛИТЕРАТУРА
Книги
Cantor С. R., Schimmel Р. R. Biophysical Chemistry, р. I, The Conformation of Biological Macromolecules, Freeman, San Francisco, 1980.
Dickerson R.E., Geis I. Hemoglobin: Structure. Function, Evolution, and Pathology, Benjamin/Cummings, Menlo Park. Calif., 1982.
Fermi G., Perutz M. Atlas of Molecular Structures in Biology, vol. 2. Hemoglobin and Myoglobin, Oxford University Press, New York. 1981.
Glusker J.P., Trueblood K.N. Crystal Structure Analysis: A Primer. Oxford University Press, New York, 1972.
Haschemeyer R., Haschemeyer A. H. Proteins: A Guide to Study by Physical and Chemical Methods, Wiley. New York, 1973.
Schultz G. Е., Schirmer R. H. Principles of Protein Structure. Springer-Verlag, New York, 1979.
Статьи
Anfmsen C.B. Principles That Govern the Folding of Polypeptide Chains, Science, 181, 223-230 (1973).
Cerami A., Peterson C.M. Cyanate and Sickle Cell Disease, Sсi. Am., 232, 44, April (1975) (offprint 1319).
Dickerson R. E. Cytochrome C and the Evolution of Energy Metabolism, Sсi. Am. 242, 236, March (1980).
Ingram V.M. Gene Mutation in Hb: The Chemical Difference Between Normal and Sickle Cell Hemoglobin, Nature, 180, 326 328 (1957) Открытие аминокислотной замены в гемоглобине S.
Kendrew J.C. The Three-Dimensional Structure of a Protein Molecule, Sci. Am., 205, 96-111, December (1961) (offprint 121).
Koshland D. Е., Jr. Protein Shape and Biological Control. Sci. Am., 229, 52, October (1973).
Pauling L., liano H.. Singer S.J., Wells I. C. Sickle Cell Anemia: A Molecular Disease, Science, 110, 543 548 (1949). Классическое описание электрофоретических различий между гемоглобинами А и S.
Perutz M.F., Hemoglobin Structure and Respiratory Transport, Sci. Am., 239, 92, December (1978).
Perutz M. Е., Lehmann H. Molecular Pathology of Human Hemoglobin. Nature. 219. 902-909 (1968).
Вопросы и задачи
1. Образование изгибов и внутрицепочечных поперечных связей в полипептидных цепях.
Укажите, где в изображенном ниже полипептиде возможно образование изгибов или поворотов цепи. Где могут образоваться внутрицепочечные дисульфидные поперечные связи?

2. Расположение специфических аминокислот в глобулярных белках. По данным рентгеноструктурного анализа миоглобина и других одноцепочечных глобулярных белков небольших размеров был сделан ряд обобщений, касающихся укладки полипептидных цепей растворимых белков. Исходя из этих обобщений, укажите наиболее вероятное расположение (внутри или на поверхности молекулы нативного глобулярного белка) аминокислотных остатков аспарагиновой кислоты, лейцина, серина, валина, глутамина и лизина. Поясните свой ответ.
3. Образование функционирующих белков из линейных полимеров. Белок обладает биологической активностью лишь в том случае, если он имеет правильную трехмерную структуру. Синтез белков основан на информации, содержащейся в линейной, т.е. одномерной кодирующей последовательности ДНК. В соответствии с этой информацией рибосомы осуществляют сборку линейной, одномерной, последовательности аминокислот. Учитывая эти факты, объясните, каким образом в клетках могут формироваться биологически активные белки, обладающие специфической трехмерной структурой. Приведите какие-нибудь экспериментальные данные, подтверждающие ваши объяснения.
4. Дисульфидные поперечные связи и укладка полипептидной цепи белка. Гипотезу о том, что характер свертывания полипептидной цепи белка (т. е. его вторичная и третичная структуры) определяются его линейной аминокислотной последовательностью, можно проверить, если дать развернутым белковым молекулам снова самопроизвольно свернуться. Определив биологическую активность белка до развертывания его цепей и после их свертывания (ренатудующей обработки 8 М мочевиной. Если затем удалить мочевину путем диализа и создать подходящие условия для образования новых дисульфидных поперечных связей, то активность рибонуклеазы восстанавливается на 95-100%. Схема этого эксперимента показана на рис. 8-8. Ниже приведены результаты аналогичных опытов по ренатурации других белков:

1) Исходя из предположения о случайном образовании дисульфидных связей.
а) Если бы образование четырех дисульфидных поперечных связей в процессе свертывания цепи рибонуклеазы происходило в результате совершенно случайного взаимодействия остатков цистеина, то можно было бы ожидать, что активность фермента после ренатурации составит всего 1% исходной активности. Почему она была бы столь низкой?
б) Активность рибонуклеазы, лизоцима и шелочной фосфатазы, восстанавливающаяся после ренатурации этих белков, оказывается гораздо выше той. которую следовало бы ожидать, исходя из предположения о случайном образовании дисульфидных поперечных связей. Объясните это наблюдение.
в) Один из белков, приведенных в таблице, а именно инсулин, явно выделяется из всех других. Наблюдаемая активность инсулина после его ренатурации оказывается очень низкой и практически совпадает с активностью, предсказанной исходя из предположения о случайном образовании дисульфидных связей. Что можно сказать о нативной структуре инсулина на основе этого наблюдения? Попробуйте представить себе, как формируется нативная структура инсулина.
5. Число полипептидных цепей в олигомерном белке. Некоторое количество (660 мг) олигомерного белка с молекулярной массой 132 000 обрабатывали избытком 2,4-динитрофторбензола в слабощелочной среде вплоть до завершения химической реакции. Затем пептидные связи белка были подвергнуты полному гидролизу путем нагревания белка в присутствии концентрированной НСl. В гидролизате содержалось 5,5 мг следующего соединения:
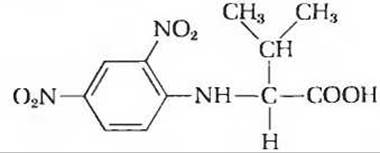
Никаких других 2,4-динитрофенильных производных, образующихся в реакции с a-аминогруппами аминокислот, обнаружено не было.
а) Объясните, почему эти данные можно использовать для определения числа полипептидных цепей в олигомерном белке.
б) Рассчитайте число полипептидных цепей в этом белке.
6. Молекулярная масса гемоглобина. Первое указание на то, что белки по молекулярной массе намного превосходят известные в то время органические соединения, было получено более 100 лет назад. Например, уже тогда было известно, что гемоглобин содержит 0,34 вес. % железа.
а) Исходя из этой информации, определите минимальную молекулярную массу гемоглобина.
б) Последующие эксперименты показали, что истинная молекулярная масса гемоглобина равна 64 500. Какую информацию отсюда можно извлечь о числе атомов железа в гемоглобине?
7. Упаковка гемоглобина в эритроцитах человека. В крови человека содержится 160 г гемоглобина на 1 л крови. На 1 мл крови приходится около 5,0∙109 эритроцитов. Хотя каждый эритроцит имеет форму двояковогнутого диска, для простоты расчетов мы будем рассматривать их просто как цилиндры следующих размеров:
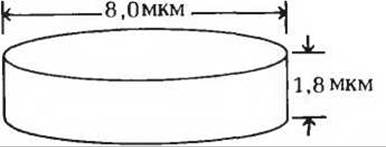
а) Рассчитайте, какое количество гемоглобина (по весу) содержится в одном эритроците.
б) Сколько молекул гемоглобина содержится в одном эритроците?
в) Рассчитайте объем одного эритроцита.
г) Гемоглобин - глобулярный белок, молекула которого имеет диаметр 68 нм. Какую долю объема всех эритроцитов занимает гемоглобин?
д) Отношение общего объема гемоглобина к общему объему эритроцита (см. выше пункт г) не дает четкого представления о том, насколько тесно упакованы в клетке молекулы гемоглобина. Следует помнить, что при упаковке сферических молекул пустое пространство между сферами всегда составляет значительную долю общего объема. Исходя из предположения, что гемоглобин в эритроците упакован в виде кубической решетки, как показано на рисунке рассчитайте общий объем решетки, занятой молекулами гемоглобина в одном эритроците, и сравните его с объемом эритроцита. Насколько тесно упакованы молекулы гемоглобина в эритроците?
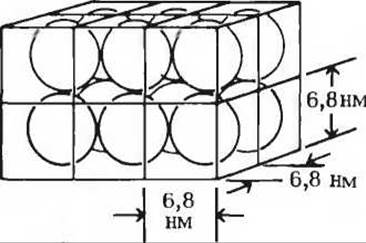
е) В свете вашего ответа на предыдущий вопрос (пункт д) оцените, расположены ли молекулы гемоглобина в эритроцитах достаточно близко друг от друга, чтобы взаимодействовать между собой. Если да, то может ли взаимодействие между молекулами гемоглобина S в серповидных эритроцитах повлиять на их форму?
8. Роль миоглобина в запасании тканями кислорода.
а) Ткани животных содержат около 70% (по весу) воды. Концентрация кислорода в тканевой воде в норме составляет 3,5∙10-5 М. Рассчитайте, какое количество кислорода может быть запасено в 1 кг ткани в виде растворенного в воде газа.
б) В большинстве тканей млекопитающих содержится миоглобин, предназначенный для запасания кислорода. У человека наибольшее количество миоглобина содержится в ткани сердца, где он составляет 0,7% (по весу) всей массы ткани. Рассчитайте, какое количество кислорода (в граммах) может быть запасено в 1 кг сердечной мышечной ткани человека. Сравните полученное значение с ответом на вопрос, поставленный в пункте а.
в) В скелетных мышцах морских млекопитающих. способных длительно находиться под водой, содержится намного больше миоглобина, чем у всех остальных позвоночных, причем его концентрация пропорциональна длительности погружения животного в воду. В свежем тюленьем мясе, находившемся какое-то время на воздухе, оказалось 0,15 г кислорода на 1 кг сырого веса. Рассчитайте процентное содержание миоглобина в мышцах тюленя.
9. Сравнение свойств гемоглобинов, содержащихся в эритроцитах матери и плода. При изучении транспорта кислорода у беременных самок было показано, что кривые насыщения гемоглобина кислородом в крови матери и плода, полученные в одних и тех же условиях, сильно различаются. Это явление обусловлено присутствием в эритроцитах плода гемоглобина (гемоглобин F, a2у2), который по своей структуре отличается от обычного гемоглобина А (a2ß2), содержащегося в эритроцитах матери.
а) Какой гемоглобин обладает при физиологических условиях более высоким сродством к кислороду - гемоглобин А или гемоглобин F? Поясните ответ.
б) Какое физиологическое значение имеет тот факт, что два гемоглобина обладают разным сродством к кислороду? Поясните ответ.
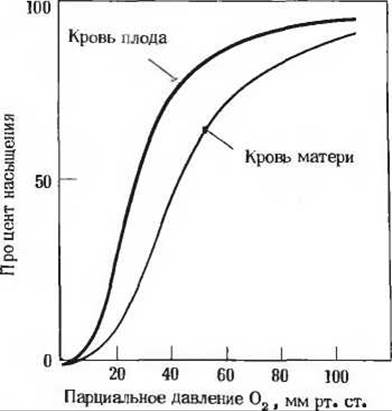
в) Если из препаратов гемоглобина А и F тщательно удалить весь 2,3-дифосфоглицерат (ДФГ), кривые их насыщения кислородом сместятся влево (т.е. сродство гемоглобинов к кислороду повысится). Однако у гемоглобина А сродство к кислороду при этом становится выше, чем у гемоглобина F. Если в препараты гемоглобина вновь добавить ДФГ, то кривые насыщения кислородом примут прежний вид, показанный на рисунке. Какое влияние оказывает ДФГ на сродство гемоглобина к кислороду? Как на основе приведенной выше информации можно объяснить различие в сродстве к кислороду у гемоглобинов матери и плода?
10. Идентификация мутантного гемоглобина. Препарат мутантного гемоглобина подвергли трипсиновому гидролизу, а затем получили пептидную карту. При этом выяснилось, что мутантный гемоглобин отличается от нормального гемоглобина А тем, что содержит в одном из пептидов вместо остатка аспарагина остаток лизина.
а) Для чего проводится гидролиз гемоглобина трипсином?
б) Каким из перечисленных в табл. 8-4 мутантных гемоглобинов мог бы быть исследуемый гемоглобин?
в) Как можно было бы выявить этот мутантный гемоглобин более быстрым и простым способом?
11. Как отличить гемоглобин С от гемоглобина S? При хранении в холодильнике двух проб крови, одна из которых содержала гемоглобин С, а другая гемоглобин S, были потеряны соответствующие наклейки. Как определить, в какой пробе содержится гемоглобин С, а в какой - гемоглобин S (см. табл. 8-4)?