Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Ферменты
Ферменты обнаруживают все свойства белков
Все известные в настоящее время ферменты представляют собой белки, причем их каталитическая активность зависит от степени сохранности нативной структуры белка. Например, разрушение полипептидных цепей в результате кипячения фермента в растворе сильной кислоты или обработки трипсином обычно приводит к потере его каталитической активности. Это свидетельствует о том, что первичная структура белка необходима для проявления его ферментативной активности. Более того, стоит нам только нарушить характерную для нативной молекулы фермента упаковку полипептидной цепи (цепей), нагревая белок или воздействуя на него экстремальными значениями pH или денатурирующими агентами, как каталитическая активность фермента исчезает. Таким образом, для ферментативной активности белков важное значение имеет сохранение их первичной, вторичной и третичной структур.
Молекулярные массы ферментов, как и всех остальных белков, лежат в пределах от 12 000 до 1 000 000, так что их размеры намного превышают размеры их субстратов или функциональных групп, на которые они действуют (рис. 9-2). Некоторые ферменты состоят только из полипептидных цепей и не содержат никаких других химических групп, кроме тех, которые входят в состав аминокислотных остатков; к подобным ферментам относится, например, рибонуклеаза из поджелудочной железы. Однако для каталитической активности многих ферментов необходим еще и дополнительный химический компонент - кофактор. Роль кофакторов могут играть неорганические вещества, например ионы Fe2+, Мn2+ или Zn2+ (табл. 9-1), или сложные органические вещества, которые в этом случае носят названия коферментов (табл. 9-2). Для каталитической активности ряда ферментов требуется как кофермент, так и какой-нибудь один или даже несколько ионов металлов. У одних ферментов коферменты или ионы металлов связываются с белком временно и непрочно, тогда как у других эти связи могут быть прочными и постоянными; в последнем случае небелковую часть фермента называют простетической группой. Весь каталитически активный фермент вместе с коферментом или ионом металла носит название голофермента. Коферменты и ионы металлов термостабильны, тогда как белковая часть фермента, называемая апоферментом, денатурирует при нагревании. Коферменты, которые мы рассмотрим в гл. 10, функционируют как переносчики специфических функциональных групп (табл. 9-2).
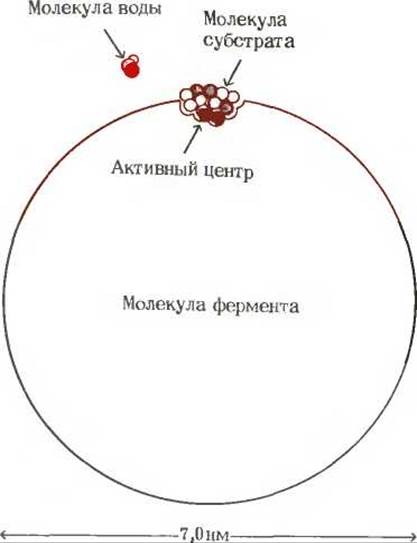
Рис. 9-2. Относительные размеры молекулы фермента (мол. масса 100 000, диаметр 7 нм) и типичной молекулы субстрата (мол. масса 250, длина 0,8 нм). Активный центр занимает лишь незначительную часть поверхности молекулы фермента. Для сравнения показана также молекула воды.
Таблица 9-1. Некоторые ферменты, для действия которых необходимы в качестве кофакторов ионы и атомы металлов
|
Fe2+ или Fe3+ |
Цитохромоксидаза Каталаза Пероксидаза |
|
Сu2+ |
Цитохромоксидаза |
|
Zn2+ |
ДНК-полимераза Карбоангидраза Алкогольдегидрогеназа |
|
Mg2+ |
Гексокиназа Глюкозо-6-фосфатаза |
|
Mn2+ |
Аргиназа |
|
K+ |
Пируваткиназа (нуждается также в ионах Mg2+) |
|
Ni2+ |
Уреаза |
|
Mo |
Нитратредуктаза |
|
Se |
Глутатионпероксидаза |
Таблица 9-2. Коферменты, выполняющие роль промежуточных переносчиков некоторых атомов или функциональных групп1)
|
Кофермент |
Переносимые группы |
|
Тиаминпирофосфатаза |
Альдегиды |
|
Флавинадениндинуклеотид |
Атомы водорода |
|
Никотинамидадениндинуклеотид |
Гидрид-ионы (Н-) |
|
Кофермент А |
Ацильные группы |
|
Пиридоксальфосфат |
Аминогруппы |
|
5-дезоксиаденозилкобаламин |
Атомы водорода и алкильные группы |
|
Биоцитин |
CO2 |
|
Тетрагидро фолат |
Другие одноуглеродные группы |
1) Их структура и механизм действия описаны в гл. 10.