Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Ферменты
Поведение аллостерических ферментов не описывается уравнением Михаэлиса-Ментеи
Для аллостерических ферментов соотношения между концентрацией субстрата и скоростью реакции отличаются от соотношений, отвечающих классическому уравнению Михаэлиса-Ментен, причем характер этих различий зависит от того, подчиняется ли фермент действию ингибирующего или активирующего модулятора. У аллостерических ферментов так же, как и у нерегуляторных ферментов, наблюдается «насыщение» субстратом, когда последний присутствует в достаточно больших концентрациях, однако график зависимости начальной скорости реакции от концентрации субстрата для некоторых аллостерических ферментов представляет собой сигмоидную кривую, а не классическую гиперболу, характерную для нерегуляторных ферментов (рис. 9-21). Хотя на сигмоидной кривой насыщения субстратом для аллостерических ферментов мы можем найти точку, в которой скорость реакции равна половине ее максимальной скорости, эта точка не соответствует величине КМ, поскольку поведение аллостерических ферментов не описывается гиперболической зависимостью, вытекающей из уравнения Михаэлиса-Ментен. В данном случае вместо символа КМ используют символы [S]0,5 и К0,5, обозначающие концентрацию субстрата, при которой скорость реакции, катализируемой аллостерическим ферментом, равна половине ее максимальной скорости.
Гиперболическая кривая насыщения субстратом для нерегуляторного фермента, приведенная выше на рис. 9-4, очень напоминает кривую связывания кислорода миоглобином (разд. 8-13). Что же касается сигмоидной кривой для аллостерического фермента, показанной на рис. 9-21, А, то она похожа на кривую связывания кислорода гемоглобином (разд. 8-13). Действительно, миоглобин и гемоглобин можно рассматривать как удобные модели для сравнительной интерпретации поведения обычных и аллостерических ферментов. Миоглобин имеет только один центр связывания для своего лиганда (кислорода) и одну полипептидную цепь; для него характерна гиперболическая кривая насыщения кислородом. Подобно миоглобину, многие нерегуляторные ферменты также имеют только один центр связывания для своих субстратов и одну полипептидную цепь; их поведение описывается гиперболической кривой насыщения субстратом.
Гемоглобин же содержит четыре центра связывания, по одному в каждой из четырех субъединиц, причем все эти центры действуют кооперативно. Вспомним, что когда один центр связывания гемоглобина занят молекулой кислорода, у других центров связывания сродство к кислороду возрастает. Это проявляется в том, что после связывания первой молекулы кислорода кривая насыщения гемоглобина кислородом резко идет вверх и принимает сигмоидную форму. Аналогичным образом гомотропный аллостерический фермент (рис. 9-21, А) имеет несколько центров связывания для своего субстрата, действующих кооперативно, так что связывание одной молекулы субстрата значительно облегчает присоединение к ферменту последующих молекул субстрата. Поэтому зависимость скорости ферментативной реакции от концентрации субстрата описывается сигмоидной, а не гиперболической кривой.
В случае гетеротропных ферментов, для которых модулятором служит не субстрат, а какой-либо другой метаболит, трудно говорить о какой-то общей для них форме кривой насыщения субстратом, так как она зависит от того, является ли модулятор положительным (активирующим) или отрицательным (ингибирующим). Если модулятор оказывает на фермент активирующее действие, то кривая насыщения субстратом становится ближе по форме к гиперболе; при этом величина К0,5 уменьшается, а величина Vmax остается неизменной. В результате в присутствии положительного модулятора скорость реакции при данной концентрации субстрата повышается (рис. 9-21, Б). Некоторые аллостерические ферменты отвечают на воздействие активирующего модулятора повышением Vmax и небольшим изменением величины К0,5 (рис. 9-21, В). В случае отрицательного, или ингибирующего, модулятора сигмоидная форма кривой насыщения субстратом становится более выраженной, а величина К0,5 повышается (рис. 9-21, Б). Следовательно, поведение аллостерических ферментов описывается различными кривыми зависимости субстрат — активность, так как одни из этих ферментов взаимодействуют с ингибирующими модуляторами, другие - с активирующими, а третьи и с теми и с другими одновременно.
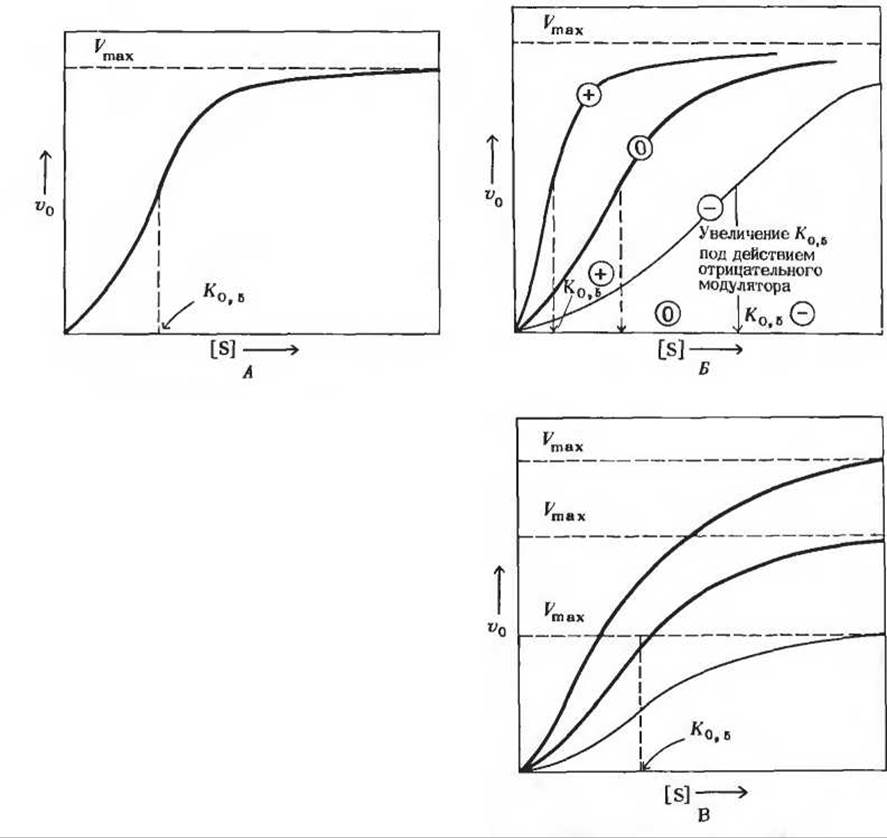
Рис. 9-21. Кривые зависимости активности фермента от концентрации субстрата, характерные для аллостерических ферментов.
А. Сигмоидная кривая, полученная для гомотропного фермента, субстрат которого служит также положительным (активирующим) модулятором. Величина К0,5 - это концентрация субстрата, при которой скорость реакции равна половине максимальной. Обратите внимание, что относительно небольшое повышение концентрации субстрата в крутой части кривой может вызвать весьма значительное увеличение скорости реакции. Обратите внимание также на то, что эта кривая напоминает кривую насыщения гемоглобина кислородом. Б. Влияние положительного (активирующего) модулятора (+), отрицательного (ингибирующего) модулятора (—) и отсутствия модулятора (0) на аллостерический фермент, для которого характерно изменение величины К0,5 при постоянной величине Vmaх. В. Кривые, характеризующие свойства аллостерического фермента менее часто встречающегося типа. Величина Vmаx изменяется, а величина К0,5 остается почти постоянной. Эти примеры иллюстрируют разнообразные, иногда очень сложные ответы аллостерических ферментов на действие их модуляторов.