Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Витамины и микроэлементы: их роль в функционировании ферментов
Никотинамид - это активная группа коферментов NAD и NADP
Недостаточное содержание в пище никотиновой кислоты (рис. 10-6) вызывает у людей заболевание, которое называется пеллагрой (от итальянского слова, означающего «шершавая кожа»). Пеллагра распространена во многих районах мира, где люди питаются в основном кукурузой и едят мало мяса, молока и яиц. В целях профилактики и лечения пеллагры можно использовать как никотиновую кислоту, так и ее амид - никотинамид. Чтобы кому-нибудь не пришла в голову мысль о возможности употребления в пищу табака как источника этого витамина, никотиновой кислоте было дано другое (условное) название - ниацин.
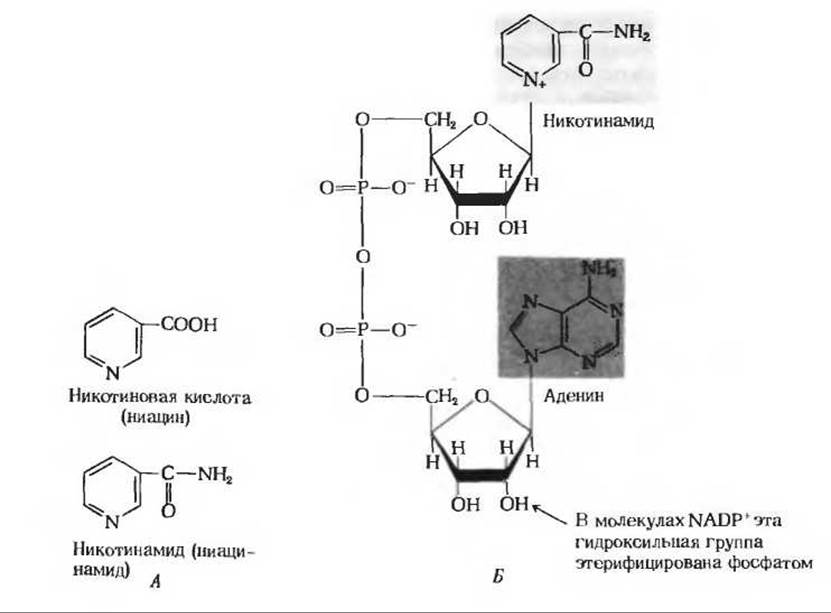
Рис. 10-6. А. Две формы витамина, предотвращающего пеллагру. Б. Строение активных коферментных форм этого витамина - никотинамидадениндинуклеотида (NAD+) и никотинамидадениндинуклеотидфосфата (NADP+). Оба этих соединения содержат по два нуклеотидных остатка, каждый из которых состоит из основания (никотинамида или аденина), пятиуглеродного сахара (D-рибозы) и фосфатной группы. На рисунке изображены окисленные формы нуклеотидов. Восстановленная форма NAD показана на рис. 10-7.
Никотинамид - компонент двух близких по структуре коферментов - никотинамидадениндинуклеотида (NAD) и никотинамидадениндинуклеотидфосфата (NADP). Строение этих коферментов показано на рис. 10-6. NADP отличается от NAD наличием в молекуле фосфатной группы. Эти коферменты могут находиться как в окисленной (NAD+ и NADP+), так и в восстановленной (NADH и NADPH) формах. Никотинамидный компонент этих коферментов играет роль промежуточного переносчика гидрид-иона, который ферментативно отщепляется от молекулы субстрата под действием специфических дегидрогеназ (рис. 10-7). В качестве примера можно привести реакцию, катализируемую малатдегидрогеназой, которая дегидрирует малат, превращая его в оксалоацетат; эта реакция представляет собой один из этапов окисления углеводов и жирных кислот. Малатдегидрогеназа катализирует также обратимый перенос гидрид-иона от малата к NAD+, в результате чего образуется NADH; второй атом водорода отщепляется от гидроксильной группы молекулы малата в виде свободного иона Н+:
![]()
Известно большое число дегидрогеназ такого типа, из которых каждая обладает специфичностью по отношению к какому-нибудь определенному субстрату. Одни из этих ферментов используют в качестве кофермента NAD+, другие-NADP+, а третьи могут функционировать с любым из этих двух коферментов. У большинства дегидрогеназ NAD (или NADP) связывается с белковой частью фермента только во время каталитического цикла, однако известны и такие ферменты, с которыми эти коферменты связаны очень прочно и постоянно присутствуют в активном центре.

Рис. 10-7. Общее уравнение, показывающее, как NAD+ действует в качестве кофермента в реакциях ферментативного дегидрирования. Молекула субстрата и продукты реакции выделены красным цветом. Изображена только никотинамидная часть молекулы NAD+, остальная же ее часть обозначена буквой R.