Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Растворенные вещества изменяют свойства воды
Водные растворы обладают четырьмя важными свойствами, известными под названием коллигативных свойств, в основе которых лежит изменение физической константы воды под влиянием растворенных в ней веществ. К этим свойствам относятся: 1) температура замерзания, 2) температура кипения, 3) давление пара и 4) осмотическое давление. Слово «коллигативный» означает «взаимосвязанный». Коллигативные свойства растворов - это свойства, имеющие общую основу и изменяющиеся под влиянием растворенных веществ так, что эти изменения можно заранее предсказать.
Раствор 1,00 моля любого идеального нелетучего вещества в 1000 г воды (или какого-либо другого растворителя) называется моляльным (1 т) раствором. В таком растворе влияние растворенного вещества проявляется в том, что при давлении 760 мм рт. ст. температура замерзания воды (0°С в случае чистой воды) снижается до — 1,86 °С, температура кипения (обычно 100 °С) повышается до 100,543°С, а осмотическое давление, измеряемое при помощи специальной аппаратуры (рис. 4-8), достигает 22,4 атм. Идеальным растворенным веществом называется такое вещество, которое не диссоциирует на две или более составные части и не претерпевает ассоциации, приводящей к уменьшению общего числа растворенных частиц. Коллигативные свойства зависят только от числа растворенных частиц в единице объема растворителя и не зависят от их химического строения. Это объясняется тем, что один моль любого деионизированного соединения содержит строго определенное число (6,02∙1023) молекул (число Авогадро). Отсюда следует, что 1т растворы глицерина (мол. масса 92) и глюкозы (мол. масса 180) должны иметь одинаковые температуры замерзания (-1,86 °С), температуры кипения (100,543 °С) и осмотические давления (22,4 атм), поскольку оба этих раствора содержат одно и то же число молекул в 1000 г (1 л) воды. Температура замерзания 0,100 m раствора глюкозы должна быть в 10 раз меньше, чем температура замерзания 1,0 т раствора, т.е. - 0,186°С, так как число молекул в этом растворе (на 1 л воды) в 10 раз меньше, чем в 1m растворе. 0,100 m раствор NaCl, в котором все молекулы полностью диссоциированы на ионы Na+ и Сl-, должен замерзать при — 0,372 °С, поскольку число частиц растворенного в нем вещества (на 1 л воды) в два раза больше, чем в 0,100 m растворе глюкозы. Все эти правила, позволяющие предвидеть коллигативные свойства и предсказывать численные значения соответствующих констант, точно соблюдаются только в случае разбавленных водных растворов.
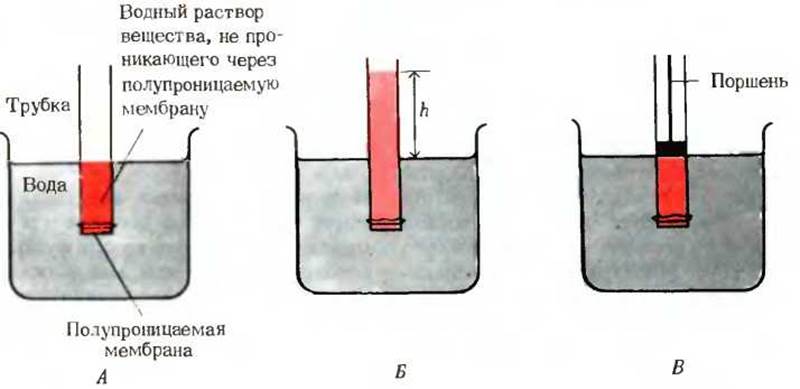
Рис. 4-8. Осмос и осмотическое давление. А. Исходное состояние. Вода перетекает из внешнего пространства через мембрану внутрь раствора, стремясь выравнять концентрации воды по обе стороны мембраны. Б. Конечное состояние. Вода проникла в раствор вещества, молекулы которого неспособны проходить сквозь мембрану, в результате чего произошло разбавление раствора. В состоянии равновесия давление столба раствора, имеющего высоту h, точно уравновешивает осмотическое давление, характеризующее стремление воды перетекать в зону с более низкой ее концентрацией. В. Осмотическое давление - это сила, которую необходимо приложить к поршню, чтобы предотвратить направленный в противоположную сторону осмотический ток жидкости. Оно численно равно гидростатическому давлению столба жидкости высотой h.
Рассмотренная выше способность воды изменять свои свойства под влиянием растворенных в ней веществ имеет очень важное биологическое значение. Она позволяет, например, пресноводным рыбам сохранять активность в воде при температуре ее замерзания, так как общая концентрация всех растворенных веществ в крови рыб достаточно высока, чтобы температура ее замерзания оказалась ниже температуры замерзания воды. Кроме того, благодаря наличию в крови растворенных веществ, в частности белков, не способных проходить сквозь капиллярные мембраны, в крови создается более высокое осмотическое давление, чем в межклеточной жидкости. В результате вода диффундирует из межклеточной жидкости в кровеносные капилляры, что способствует заполнению сосудистой системы и предохраняет ее от коллапса.
Другая причина, по которой растворенные вещества влияют на свойства воды, состоит в том, что эти вещества стремятся разрушить водородные связи между молекулами воды. Присутствие в воде веществ ионной природы, таких, как NaCl, приводит к заметному изменению структуры жидкой воды. Это обусловлено тем, что каждый ион (в частности, ионы Na+ и Сl) окружен гидратной оболочкой, состоящей из дипольных молекул воды, причем геометрия и свойства таких гидратированных ионов несколько отличаются от геометрии и свойств ассоциатов (кластеров), образуемых молекулами воды за счет водородных связей; гидратированные ионы имеют более упорядоченную и более регулярную структуру. Таким образом, растворенные соли стремятся разрушить нормальную структуру жидкой воды и изменить ее свойства как растворителя. Ниже мы увидим, что растворимость белков резко уменьшается при повышении концентрации нейтральных солей, например NaCl, Na2SО4 и (NH4)2SО4, изменяющих свойства воды и снижающих ее способность растворять белки. Такое влияние растворенных нейтральных солей может быть использовано для разделения смеси белков, поскольку многие белки различаются по своей способности осаждаться из солевых растворов.