Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Свойства кислот и оснований тесно связаны со свойствами воды
Молекулы соляной, серной и азотной кислот, называемых обычно сильными кислотами, полностью ионизированы в разбавленных водных растворах. Аналогично молекулы сильных оснований NaOH и КОН также полностью ионизированы.
В биологии мы чаще встречаемся со слабыми кислотами и слабыми основаниями, которые при растворении в воде ионизируются не полностью. Примером слабой кислоты может служить уксусная кислота (СН3СООН), придающая уксусу кислый вкус; в качестве примера слабого основания можно привести аммиак (NH3), водный раствор которого применяется для чистки различных предметов домашнего обихода. Слабые кислоты и основания - эго обычные компоненты биологических систем, играющие важную роль в метаболизме и его регуляции. Поведение водных растворов слабых кислот и оснований легче будет понять, если дать сначала точные определения некоторых терминов.
Кислоты можно определить как доноры протонов, а основания как акцепторы протонов. Донор протона и соответствующий ему акцептор протона образуют сопряженную кислотно-основную пару (табл. 4-3). Примером сопряженной кислотно-основной пары могут служить уксусная кислота (СН3СООН), играющая роль донора протона, и ацетат-анион (СН3СОО-), выполняющий функцию акцептора протона; они связаны между собой следующей обратимой реакцией:
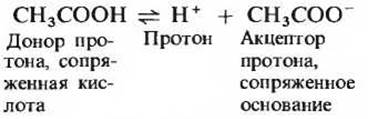
Таблица 4-3. Некоторые сопряженные кислотно-основные пары. Каждая пара состоит из донора и акцептора протонов
|
Донор протона |
Акцептор протона |
|
СН3СООН |
СН3СОО- |
|
Н3РО-4 |
Н2РО2-4 |
|
NH+4 |
КН3 |
Характерная особенность каждой кислоты состоит в том, что в водном растворе она стремится отщепить свой протон. Чем сильнее кислота, тем сильнее выражена эта тенденция. Способность любой кислоты НА отщеплять протон и образовывать сопряженное с ней основание А- характеризуется константой равновесия обратимой реакции
![]()
равной
![]()
Константы равновесия таких реакций чаще называются константами ионизации, или константами диссоциации. Численные значения констант диссоциации некоторых кислот, часто обозначаемых символом К'а (индекс «а» от англ. acid — кислота), приведены в табл. 4-4. Обратите внимание, что все эти кислоты различаются по своей способности отдавать протон. Для более сильных кислот, таких, как муравьиная или молочная, характерны более высокие значения констант диссоциации, тогда как для более слабых кислот, к которым относятся, например, ион Н2РO-4, - более низкие значения. Одна из наиболее слабых кислот, приведенных в табл. 4-4, -ион NH+4, обладающий лишь весьма слабо выраженной способностью отдавать протон, о чем свидетельствует очень низкое значение константы диссоциации. Сопряженное основание этой кислоты, аммиак (NH3), очень легко присоединяет протон.
Таблица 4-4. Константы диссоциации и величины рК' некоторых широко распространенных кислот при 25°С
|
Кислота (донор протона) |
К', M |
РК' |
|
НСООН (муравьиная кислота) |
1,78 x 10-4 |
3,75 |
|
СН3СООН (уксусная кислота) |
1,74 x 10-5 |
4,76 |
|
СН3СН2СООН (пропионовая кислота) |
1,35 x 10-5 |
4,87 |
|
СН3СНОНСООН (молочная кислота) |
1,38 x 10-4 |
3.86 |
|
Н3РO4 (фосфорная кислота) |
7,25 x 10-3 |
2,14 |
|
Н2РO4 (дигидрофосфат-ион) |
1,38 x 10-7 |
6,86 |
|
HPO2-4 (моногидрофосфат-ион) |
3,98 x 10-13 |
12,4 |
|
Н2СO3 (угольная кислота) |
1,70 x 10-4 |
3,77 |
|
НСО3 (бикарбонат-ион) |
6,31 x 10-11 |
10,2 |
|
NH+ (ион аммония) |
5,62 x 10-10 |
9,25 |
В табл. 4-4 приведены величины рК', определяемые уравнением
![]()
Символ р, так же как и в случае pH, означает «отрицательный логарифм». Чем легче диссоциирует кислота, тем меньше значение ее рК'. Как мы сейчас увидим, определение величины рК' любой слабой кислоты не представляет особого труда.