Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Краткое содержание главы
Вода это самое распространенное соединение в живых организмах. Относительно высокие значения температуры замерзания, температуры кипения и теплоты испарения воды обусловлены сильными межмолекулярными взаимодействиями, проявляющимися в форме многочисленных водородных связей между соседними молекулами воды. Жидкая вода состоит из короткоживущих скоплений (кластеров) молекул, связанных друг с другом водородными связями. Полярность воды и сильно выраженная способность ее молекул образовывать водородные связи делает воду прекрасным растворителем для многих ионных соединений и других веществ, имеющих полярные молекулы. Вода диспергирует также амфипатические вещества, например мыла, с образованием агрегатов молекул, называемых мицеллами. в которых гидрофобные группы спрятаны внутри и не контактируют с водой, тогда как заряженные группы расположены на внешней поверхности.
Вода очень слабо диссоциирует, образуя ионы Н+ и ОН-. В разбавленных водных растворах концентрации ионов Н+ и ОН- связаны между собой обратной зависимостью: Kw = [Н+][ОН] = 1∙10-14(при 25°С). Концентрацию ионов водорода в биологических системах обычно выражают в виде pH, величина которого численно равна отрицательному логарифму концентрации ионов Н+ (pH = - lg[H+]). Величину pH водных растворов измеряют при помощи стеклянных электродов, чувствительных к концентрации ионов Н+.
Кислоты можно определить как доноры протонов, а основания - как акцепторы протонов. Сопряженная кислотно-основная пара состоит из донора протона НА и соответствующего ему акцептора протона А-. Способность кислоты НА отдавать свой протон характеризуется ее константой диссоциации
![]()
или величиной рК' определяемой как — lgA-. Величина pH водного раствора слабой кислоты количественно связана со значением ее рK' и с отношением концентраций ее протонно-донорной и протонно-акцепторной форм.
Сопряженная кислотно-основная пара может функционировать в качестве буфера, препятствующего изменениям pH при добавлении к раствору щелочи или кислоты; ее буферная емкость максимальна при значении pH, численно равном ее рК'. Наиболее важными в биологическом отношении буферными парами являются Н2СO3 - НСO-3 и H2PO-4 - HPO2-4. Каталитическая активность ферментов сильно зависит от pH.
ЛИТЕРАТУРА
Callewaert D.M., Jenyea J. Basic Chemistry: General, Organic, Biological, Worth, New York, 1980. Полезно просмотреть как этот, так и другие учебники общей химии.
Dick D. А. Т. Cell Water, Butterworths, Washington, 1966. Свойства и функции воды в живых организмах.
Eisenberg D., Kauzmann W. The Structure and Properties of Water, Oxford University Press, Fair Lawn, N.J., 1969. Трактовка физической химии воды, рассчитанная на подготовленных читателей.
Likens G. Е, Wright R. F., Galloway J. N, Butler T.J. Acid Rain, Sci. Am., 241, 43-51, October (1979).
Montgomery R., Swenson C. A. Quantitative Problems in Biochemical Sciences, 2d ed. Freeman, San Francisco, 1976.
Segel I. H. Biochemical Calculations, 2d ed., Wiley, New York, 1976.
Solomon A.K., The State of Water in Red Cells, Sci, Am., 244, 88-96, February (1971). Статья, посвященная исследованию структуры воды в клетке.
Вопросы и задачи
1. Автомобильный антифриз. В качестве вещества, понижающего температуру замерзания воды в радиаторе автомобиля, обычно используется этиленгликоль- спирт, содержащий две гидроксильные группы (СН2ОН—СН2ОН). Рассчитайте, какова должна быть приблизительная концентрация этиленгликоля, которая будет достаточной для предотвращения замерзания воды при — 18 °С.
2. Имитация уксуса. Один из способов приготовления уксуса (отнюдь не лучший) состоит просто в том, что уксусную кислоту, единственный кислый компонент уксуса, разводят водой до нужного pH (см. табл. 4-4 и рис. 4-9) и добавляют соответствующие приправы. Уксусная кислота при 25 С представляет собой жидкость с плотностью 1,049 г/мл. Рассчитайте, какое количество уксусной кислоты нужно растворить в дистиллированной воде, чтобы получить 1 л раствора, имитирующего уксус.
3. Кислотность желудочной соляной кислоты. В клинических лабораториях для определения кислотности желудочного сока оттитровывают 10,0 мл желудочного сока, взятого через несколько часов после еды, 0,1 н. раствором NaOH до нейтральной реакции. Допустим, что для этого потребовалось 7,2 мл раствора NaOH. Так как желудок к этому времени уже не содержит непереваренной пищи или напитков, никаких буферов в нем нет. Какова величина pH желудочного сока?
4. Измерение содержания ацетилхолина по изменению pH. Концентрацию нейромедиатора ацетилхолина можно определить по изменению pH, сопровождающему гидролиз ацетилхолина. При инкубации ацетилхолина с каталитическими количествами фермента ацетилхолинэстеразы он количественно превращается в холин и уксусную кислоту, которая диссоциирует с образованием ацетат-иона и иона водорода:

Согласно данным анализа, водный раствор, содержащий неизвестное количество ацетилхолина объемом 15 мл, имел pH 7,65. После инкубации с ацетилхолин-эстеразой pH раствора снизился до 6,87. Сколько молей ацетилхолина содержалось в 15 мл исходного раствора, если считать, что в анализируемой смеси отсутствовали буферы?
5. Смысл величины рК' кислоты. Согласно одному из наиболее широко распространенных определений рК', эта величина есть не что иное, как pH, при котором кислота ионизирована на 50%, т.е. представляет собой смесь недиссоциированных молекул кислоты и сопряженного с ней основания в соотношении 50:50. Докажите, что это правильно, исходя из выражения для константы равновесия.
6. Свойства буфера. Аминокислота глицин часто используется в биохимической практике в качестве главной составной части буферного раствора. Аминогруппа глицина, имеющая рК' 9,3, может существовать либо в протонированной форме (-NH3), либо в виде свободного основания (—NH2), которые находятся между собой в равновесии:
![]()
а) В каком интервале pH глицин может быть использован в качестве эффективного буфера за счет его аминогруппы?
б) Какова доля молекул глицина, имеющих в 0,1 М растворе при pH 9,0 аминогруппу в протонированной форме (-NH+3)?
в) Какой объем 5 М раствора КОН нужно добавить к 1,0 л 0,1 М раствора глицина (pH 9,0), чтобы величина pH смеси была равна точно 10,0?
г) Каково должно быть численное соотношение между величинами pH раствора и рК' аминогруппы глицина, чтобы у 99% молекул глицина аминогруппа находилась в протонированной форме?
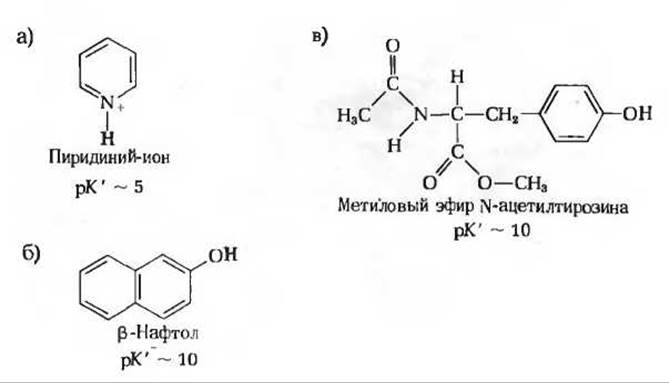
Задача 7
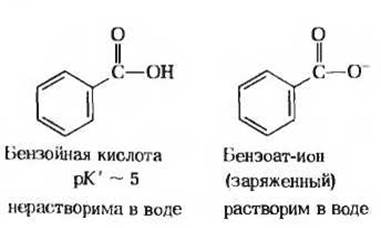
7. Зависимость растворимости от pH. Сильно выраженная полярность воды и ее способность легко образовывать водородные связи делает ее прекрасным растворителем для веществ ионной природы. Вместе с тем эта особенность воды обусловливает плохую растворимость в ней неионизируемых неполярных органических веществ, таких, как бензол. В принципе растворимость всех органических кислот и оснований в воде можно повысить путем соответственно депротонирования и протонирования, что приводит в обоих случаях к образованию заряженных частиц. Например, бензойная кислота плохо растворима в воде, однако добавление бикарбоната натрия вызывает повышение pH раствора и депротонирование молекул бензойной кислоты с образованием бензоат-ионов, которые хорошо растворимы в воде. Какой из растворов-0,1 М NaOH или 0,1 М НСl нужно добавить к воде, чтобы повысить растворимость веществ А, Б, В?
8. Лечение сыпи, возникающей на коже при соприкосновении с растением сумахом. Содержащиеся в тканях сумаха производные пирокатехола с длинными цепями алкильных групп вызывают характерную зудящую сыпь.
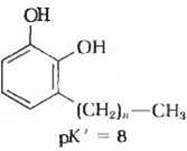
Если вы случайно дотронулись до сумаха, то какой способ обработки пораженного участка кожи из перечисленных ниже вы изберете и почему?
(а) Промывание поверхности кожи холодной водой.
(б) Промывание поверхности кожи разбавленным уксусом или лимонным соком.
(в) Промывание поверхности кожи мылом и водой.
(г) Промывание поверхности кожи мылом, водой и пищевой (питьевой) содой (бикарбонатом натрия).
9. Величина pH и всасывание лекарственных веществ. Широко используемый лекарственный препарат аспирин представляет собой слабую кислоту с рК' = 3,5

Аспирин всасывается в кровь человека через клетки слизистой желудка и тонкого кишечника. Для того чтобы вещество всасывалось, оно должно легко проходить через клеточные мембраны. Возможность прохождения вещества через клеточную мембрану определяется полярностью его молекул: ионизированные (заряженные) и сильно полярные молекулы проходят медленно, тогда как нейтральные гидрофобные молекулы проходят сквозь мембраны быстро. Где аспирин легче всасывается в кровяной поток - в желудке или в тонком кишечнике, если величина pH желудочного сока в желудке близка к 1, а в тонком кишечнике к 6? Дайте четкое обоснование своего выбора.
10. Приготовление стандартного буфера для калибровки pH-метра. Стеклянный электрод используемый в имеющихся в продаже pH-метрах, дает электрический сигнал, величина которого пропорциональна концентрации ионов водорода. Для того чтобы по величине сигнала можно было правильно судить о величине pH, необходимо провести калибровку стеклянного электрода, используя для этого стандартные растворы с известной концентрацией ионов водорода. Определите, какие количества (в граммах) первичного кислого фосфата натрия (NaH2PО4∙Н2О; мол. масса 138,01) и вторичною кислого фосфата натрия (Na2HPО4; мол. масса 141,98) необходимы для приготовления 1 л стандартного буфера с pH 7,00, в котором суммарная концентрация фосфатов равна 0,100 М. (Мол. масса смеси фосфатов будет зависеть от их соотношения). Величина рК' первичного кислого фосфата при 25 С равна 6,86.
11. Контроль pH крови путем изменения интенсивности дыхания.
а) Парциальное давление СО2 в легких может быстро меняться в зависимости от интенсивности и глубины дыхания. Известно, что для избавления от икоты необходимо повысить концентрацию СО2 в легких. Этого можно добиться, если частично задержать дыхание, медленно и неглубоко вдыхая воздух (гиповентиляция), или вдыхать и выдыхать воздух, прижав к лицу бумажный пакет. В этих условиях парциальное давление СО2 в воздушном пространстве легких превысит нормальное. Объясните. почему эти процедуры влияют на pH крови.
б) Бегуны на короткие дистанции непосредственно перед стартом обычно интенсивно и глубоко дышат (гипервентиляция) примерно в течение 1,2 мин для удаления СО2 из легких. Величина pH крови может подскочить при этом до 7,60. Объясните, почему pH крови повышается в этих условиях.
в) Во время бега на короткую дистанцию мышцы производят большое количество молочной кислоты из запасов глюкозы. Исходя из этого факта, объясните, почему перед стремительным бегом полезна гипервентиляция?