Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Общие структурные свойства аминокислот
При кипячении белков в присутствии сильных кислот и щелочей ковалентные связи между аминокислотами, из которых построены белковые цепи, разрываются. Образующиеся при этом свободные аминокислоты представляют собой сравнительно небольшие молекулы с известной структурой. Первая аминокислота, аспарагин, была открыта в 1806 г. Последним из 20 обнаруженных в белках аминокислот оказался треонин, который удалось идентифицировать лишь в 1938 г. Каждая аминокислота имеет тривиальное (традиционное) название, происходящее иногда от источника, из которого аминокислота была впервые выделена. Например, аспарагин, как нетрудно догадаться, впервые обнаружили в аспарагусе, а глутаминовую кислоту - в клейковине (по-английски «gluten») пшеницы; глицин был назван так за его сладкий вкус (от греч. «glykos» - сладкий).
Все 20 аминокислот, встречающиеся в белках, характеризуются общей структурной особенностью - наличием карбоксильной группы и аминогруппы, связанных с одним и тем же атомом углерода (рис. 5-2). Различаются же аминокислоты только боковыми цепями (R-группами), которые у разных аминокислот неодинаковы по структуре, электрическому заряду и растворимости в воде. 20 аминокислот, входящие в состав белков, часто называют стандартными, основными или нормальными аминокислотами, чтобы отличить их от других аминокислот, присутствующих в живых организмах, но не встречающихся в белках. Стандартные аминокислоты имеют трехбуквенные и однобуквенные условные обозначения (табл. 5-1), которыми пользуются для сокращенной записи аминокислотного состава и последовательностей аминокислот в полипептидных цепях.
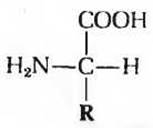
Рис. 5-2. Общая структурная формула аминокислот (в неионной форме), входящих в состав белков. Часть структуры, показанная черным цветом, одинакова у всех а-аминокислот (кроме пролина). Буквой R, выделенной красным цветом, обозначена боковая цепь (R-гpyппa). Каждая аминокислота имеет свою, характерную для нее R-гpyппy. Во всех аминокислотах, за исключением глицина, а-атом углерода связан с четырьмя различными замещающими группами и, следовательно, является асимметрическим, или хиральным, атомом углерода.
Таблица 5.1. Сокращенные обозначения аминокислот
|
Аминокислота |
Трехбуквенное сокращенное обозначение |
Однобуквенное обозначение |
|
Аланин |
Ala |
А |
|
Аргинин |
Arg |
R |
|
Аспарагин |
Asn |
N |
|
Аспарагиновая кислота |
Asp |
D |
|
Валин |
Val |
V |
|
Гистидин |
His |
H |
|
Глицин |
Gly |
G |
|
Глутамин |
Gln |
Q |
|
Глутаминовая кислота |
Glu |
E |
|
Изолейцин |
Ile |
I |
|
Лейцин |
Leu |
L |
|
Лизин |
Lys |
К |
|
Метионин |
Met |
M |
|
Пролин |
Pro |
p |
|
Серин |
Ser |
s |
|
Тирозин |
Tyr |
Y |
|
Треонин |
Thr |
T |
|
Триптофан |
Trp |
W |
|
Фенилаланин |
Phe |
F |
|
Цистеин |
Cys |
C |