Основы биохимии Том 1 - А. Ленинджер 1985
Биомолекулы
Вода
Краткое содержание главы
Каждая из 20 аминокислот, которые обычно обнаруживают как продукты гидролиза белков, содержит а-карбоксильную группу, а-аминогруппу и специфическую для данной аминокислоты R-гpyппy, замещающую водород при a-атоме углерода. а-Атом углерода во всех аминокислотах (за исключением глицина) является асимметрическим, и, следовательно, каждая из этих аминокислот может существовать по меньшей мере в двух стереоизомерных формах. В белках встречаются только L-стереоизомеры, соответствующие по своей конфигурации L-глицеральдегиду. Классификация аминокислот основана на различиях в полярности их R-гpyпп. К классу неполярных аминокислот принадлежат аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин. В класс полярных нейтральных аминокислот входят глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин. Класс отрицательно заряженных (кислых) аминокислот включает аспарагиновую и глутаминовую кислоты, а класс положительно заряженных (основных) аминокислот - аргинин, лизин и гистидин.
При низких значениях pH моноаминомонокарбоновые аминокислоты представляют собой двухоснoвные кислоты (+NH3CHRCOOH). При повышении pH примерно до 6, т. е. до изоэлектрической точки, от карбоксильной группы отщепляется протон, что приводит к образованию цвиттерионов - электрически нейтральных биполярных ионов типа +NH3CHRCOO-. В результате дальнейшего повышения pH происходит отщепление второго протона с образованием ионов типа NH2CHRCOO-. Аминокислоты с ионизируемыми R-группами могут существовать и в других ионных формах, образование которых зависит от pH. При взаимодействии аминокислот с нингидрином образуются окрашенные продукты. Для разделения сложных смесей аминокислот, а также для идентификации и определения количества разделенных аминокислот используют методы электрофореза и ионообменной хроматографии.
Аминокислоты, ковалентно соединенные друг с другом при помощи пептидных связей, образуют пептиды, которые могут быть получены также как продукты неполного гидролиза полипептидов. Кислотно-основные свойства пептида определяются его концевыми NH2- и СООН-группами, а также входящими в его состав ионизируемыми R-группами. При полном гидролизе пептидов образуются свободные аминокислоты. Взаимодействие аминоконцевого остатка пептида с 1-фтор-2,4-динитробензолом приводит к образованию производного, имеющего характерную желтую окраску. Некоторые пептиды присутствуют в свободном состоянии в клетках и тканях и выполняют специфические биологические функции. К ним относятся многие гормоны, антибиотики и другие соединения, обладающие высокой биологической активностью.
ЛИТЕРАТУРА
Cantor С. R., Schimmel P.R. Biophysical Chemistry, pt. I. The Conformation of Biological Macromolecules, Freeman, San Francisco, 1980. Прекрасный учебник, в котором рассматриваются свойства биологических макромолекул и составляющих их строительных блоков.
Cooper T G. The Tools of Biochemistry, Wiley, New York, 1977. Теория и практические указания по хроматографии и электрофорезу аминокислот.
Corrigan J. Т. D-Amino Acids in Animals, Science, 164, 142-148 (1969).
Dickerson R.E., Geis I. Proteins: Structure, Function and Evolution, 2d ed, Benjamin/Cummings, Menlo Park, Calif., 1983.
Haschemeyer R., Haschemeyer A.H. Proteins: A Guide to Study by Physical and Chemical Methods, Wiley, New York, 1973.
Lehninger A. L. Biochemistry, 2d ed., Worth, New York, 1975. Главы 4 и 5 содержат более подробное описание свойств аминокислот и пептидов.
Meister A.: Biochemistry of the Amino Acids, 2d ed, 2 vols. Academic, New York, 1965. Энциклопедическое изложение вопросов, касающихся свойств и распространения аминокислот, а также их участия в процессах метаболизма живых организмов.
Segel I. Н. Biochemical Calculations, 2d ed, Wiley, New York, 1976.
Вопросы и задачи
1. Удельное оптическое вращение аминокислоты, выделенной из арбуза. Аминокислота цитруллин впервые была выделена из арбуза (Citrullus vulgaris), но она присутствует и в большинстве животных тканей. Хотя цитруллин не входит в состав белков, он служит предшественником аргинина, а также мочевины - экскретируемого конечного продукта метаболизма аминогрупп. Структурная формула цитруллина выглядит следующим образом:

При 25°С стеклянная трубка длиной 20 см, заполненная 5%-ным раствором цитруллина в 0,3 н. НСl, вращает плоскость поляризации света на 1,79° вправо. Какова величина удельного оптического вращения цитруллина? Можно ли по удельному вращению цитруллина определить, является ли он D- или L-аминокислотой?
2. Абсолютная конфигурация цитруллина. Какую конфигурацию (D или L) имеет выделенный из арбуза цитруллин (см. формулу, приведенную в предыдущем вопросе)? Дайте обоснованный ответ.
3. Соотношение между структурой и химическими свойствами аминокислот. Поскольку аминокислоты служат строительными блоками белков, знание их структуры и химических свойств имеет первостепенное значение для понимания того, как белки выполняют свои биологические функции. Ниже приведены структурные формулы боковых цепей (R-гpyпп) 16 аминокислот (Ala, Arg, Asn, Asp, Cys, Glu, Gly, His, Lys, Met, Phe, Pro, Ser, Trp, Туr и Val). Назовите аминокислоты, которым принадлежат изображенные здесь R-группы. Какие из перечисленных ниже свойств характерны для каждой из этих аминокислот? Некоторые из этих свойств можно использовать для характеристики более чем одной аминокислоты. Свойства R-групп и соответствующих аминокислот.

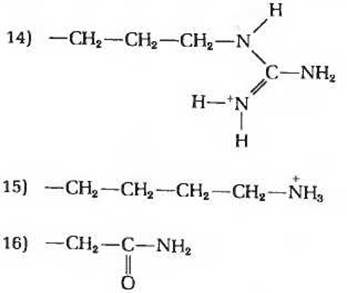
а) Небольшая полярная R-группа, содержащая гидроксильную группу. Соответствующая аминокислота играет важную роль в функционировании активных центров некоторых ферментов.
б) R-группа создает наименьшие стерические ограничения.
в) R-группа имеет рК' ≈ 10,5 и при физиологических значениях pH несет положительный заряд.
г) Серусодержащая R-группа; нейтральна при всех значениях pH.
д) Ароматическая R-группа; имеет гидрофобную природу и нейтральна при всех значениях pH.
е) R-группа, представляющая собой остаток насыщенного углеводорода; вносит важный вклад в гидрофобные взаимодействия.
ж) Единственная аминокислота, содержащая ионизируемую R-группу с величиной рК', близкой к 7. Играет важную роль в функционировании активных центров ряда ферментов.
з) Единственная аминокислота, содержащая замешенную а-аминогруппу. Влияет на процесс свертывания белковой цепи, так как служит местом вынужденного изгиба цепи.
и) R-группа имеет величину рК' около 4 и при pH7 несет отрицательный заряд.
к) Ароматическая R-группа, способная участвовать в образовании водородных связей; имеет величину рК', близкую к 10.
л) Образует дисульфидные поперечные связи между полипептидными цепями; величина рК' функциональной группы близка к 8.
м) R-группа с величиной рК' ≈ 12; несет положительный заряд при всех физиологических значениях pH. В некоторых белках играет важную роль в связывании отрицательно заряженных фосфатных групп.
н) Если эту полярную, но незаряженную R-гpyппy подвергнуть гидролизу, то содержащая ее аминокислота превращается в другую аминокислоту с отрицательно заряженной R-группой при pH около 7.
4. Связь между кривой титрования и кислотно-основными свойствами глицина. 0,1 М раствор глицина (100 мл), имеющий pH 1,72, был оттитрован 2 М раствором NaOH. В ходе титрования производилась регистрация pH. полученные данные были отложены на графике, представленном на рисунке. Наиболее важные точки на графике обозначены римскими цифрами от І до V. Какую из этих пяти точек на кривой титрования следует указать, отвечая на поставленные ниже вопросы? Поясните свой выбор.
Задача 4
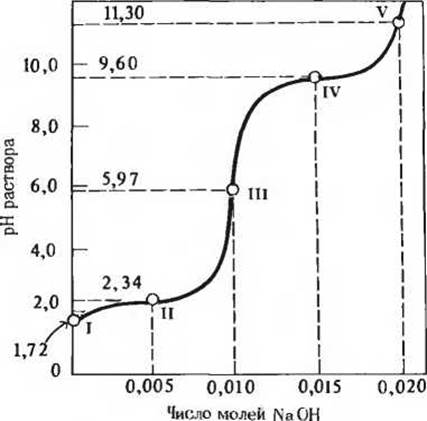
а) Какая точка соответствует pH, при котором в 0,1 М растворе глицина эта аминокислота существует в форме ионов +NH3—СН2—СООН?
б) В какой точке средний суммарный заряд молекулы глицина равен![]()
в) В какой точке аминогруппы ионизированы у половины молекул глицина?
г) В какой точке значение pH равно величине рК' ионизации карбоксильной группы глицина?
д) В какой точке значение pH равно величине рК' ионизации протонированной аминогруппы (—NH+3) глицина?
е) В какой точке глицин обладает максимальной буферной емкостью?
ж) В какой точке средний суммарный заряд глицина равен нулю?
з) В какой точке карбоксильная группа глицина оказывается полностью оттитрованной (первая точка эквивалентности)?
и) В какой точке ионизирована половина карбоксильных групп?
к) В какой точке глицин полностью оттитрован (вторая точка эквивалентности)?
л) В какой точке глицин существует преимущественно в форме ионов H3N+—СН2—СОС-?
м) В какой точке молекулы глицина превращаются на 50% в ионы H3N+ —СН2—СОО и на 50% в ионы H2N—СН2—СОО ?
н) В какой точке средний суммарный заряд молекулы глицина равен — 1 ?
о) В какой точке 50% молекул глицина превращаются в ионы H3N+—СН2—СООН, а остальные 50%-в ионы H3N+—СН2— СОО-?
п) Какой точке соответствует изоэлектрическая точка глицина?
р) В какой точке средний суммарный заряд глицина равен ![]()
с) Какой точке соответствует конец титрования?
т) Для того чтобы использовать глицин в качестве эффективного буфера, необходимо знать, при каких значениях pH раствор глицина обладает минимальной буферной емкостью. Укажите на кривой титрования глицина соответствующие точки.
у) В какой точке в ходе титрования преобладающей формой глицина становятся ионы H2N-CH2-COO-?
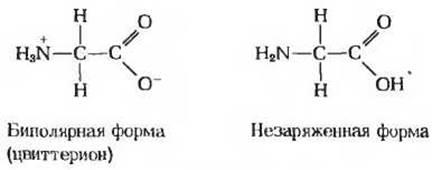
5. Какую долю составляют полностью незаряженные формы глицина? При значении pH, соответствующем изоэлектрической точке, суммарный заряд глицина равен нулю. Хотя нулевой суммарный заряд имеют две формы глицина (биполярная и незаряженная), его преобладающей формой в изоэлектрической точке является биполярная.
а) Объясните, почему в изоэлектрической точке глицин представлен главным образом биполярной, а не полностью незаряженной формой.
б) Определите долю молекул глицина, которые в изоэлектрической точке находятся в полностью незаряженной форме. Приведите свои соображения в пользу сделанной оценки.
Задача 5
б. Состояние ионизации аминокислот. Каждая ионизируемая группа аминокислоты может находиться в одном из двух состояний - заряженном или нейтральном. Электрический заряд на функциональной группе определяется соотношением между величиной рК' этой группы и значением pH раствора. Это соотношение описывается уравнением Хендерсона - Хассельбаха.
а) Гистидин имеет три ионизируемые функциональные группы. Напишите уравнения для трех соответствующих процессов ионизации гистидина и укажите примерные величины констант равновесия (рК'), характеризующих каждый из этих процессов. Нарисуйте структуру гистидина во всех трех состояниях ионизации. Какой суммарный заряд имеет молекула гистидина в каждом из состояний ионизации?
б) Нарисуйте ионные структуры гистидина, преобладающие при pH 1,4,8 и 12; учтите, что состояние ионизации можно определить, рассматривая каждую ионизируемую группу независимо от остальных.
в) Каков суммарный заряд молекулы гистидина при pH 1,4, 8 и 12? Куда будет двигаться гистидин при каждом из этих значений pH в ходе электрофореза - к аноду (+) или катоду (—)?
7 Приготовление глицинового буфера. Раствор глицина часто применяют в качестве буфера. Для приготовления 0,1 М глицинового буфера используют 0,1 М растворы солянокислого глицина (+NH3—СН2—СООН-Сl-) и глицина (+NH3—СН2—СООН-) - две формы глицина, имеющиеся в продаже. Какие объемы этих двух растворов следует смешать, чтобы приготовить 1 л 0,1 М глицинового буфера, имеющего pH 3,2?
8. Электрофорез аминокислот на бумаге. Каплю раствора, содержащего смесь глицина, аланина, глутаминовой кислоты, лизина, аргинина и гистидина, нанесли на середину полоски бумаги и дали ей высохнуть. Затем бумагу смочили буфером с pH 6,0 и к концам полоски приложили электрическое напряжение.
а) Какая аминокислота(ы) будет двигаться к аноду?
б) Какая аминокислота(ы) будет двигаться к катоду?
в) Какая аминокислота(ы) останется на стартовой точке или вблизи нее?
9. Разделение аминокислот методом ионообменной хроматографии Анализ смеси аминокислот начинают с разделения этой смеси на компоненты методом ионообменной хроматографии. Небольшое количество смеси вносят в верхнюю часть колонки, заполненной частицами полистирола, содержащими остатки сульфоновой кислоты (см. рис. 5-14). Затем через колонку пропускают буферный раствор. Аминокислоты проходят через колонку с разными скоростями, поскольку их движение тормозят два фактора 1) электростатическое притяжение между отрицательно заряженными остатками сульфоновой кислоты и положительно заряженными функциональными группами аминокислот и 2) гидрофобное взаимодействие между боковыми цепями аминокислот и сильно гидрофобным остовом полистирольной смолы. Для каждой из выписанных ниже пар аминокислот определите, какая аминокислота данной пары будет сходить с колонки первой (т.е. испытывать наименьшее торможение) при пропускании через колонку буфера с pH 7,0.
а) Asp и Lys
б) Arg и Met
в) Glu и Val
г) Gly и Leu
д) Ser и Ala
10 Набор трипептидов. Предположим, что вы хотите синтезировать трипептиды, используя в качестве строительных блоков глицин, аланин и серин.
а) Сколько различных трипептидов можно приготовить при условии, что любая из этих трех аминокислот может занимать любое из трех возможных положений, причем каждую аминокислоту можно использовать более одного раза?
б) Сколько различных трипептидов можно приготовить, если использовать каждую аминокислоту только один раз?
11. Обозначение оптических изомеров изолейцина. Структурная формула изолейцина изображена ниже
Задача 11

а) Сколько хиральных центров имеет молекула изолейцина?
б) Сколько оптических изомеров может быть у изолейцина?
в) Нарисуйте перспективные формулы всех оптических изомеров изолейцина.
г) Как вы обозначите каждый из этих изомеров в рамках RS-системы? (Указание: по своему приоритету группа СН3СН2 занимает промежуточное положение между группами C6H-5 и СН3.
12. Сравнение величин рК' аминокислоты в свободном виде и в составе пептидов. Кривая титрования аминокислоты аланина отражает процессы ионизации двух функциональных групп с рК' 2,34 и 9,69, что отвечает ионизации соответственно карбоновой кислоты и протонированного амина. Титрование ди-, три- и олигопептидов аланина, содержащих более четырех остатков этой аминокислоты, свидетельствует об ионизации только двух функциональных групп, хотя экспериментально найденные величины их рК' различны.
|
Аминокислота или пептид |
pK'1 |
рK'2 |
|
Ala |
2,34 |
9,69 |
|
Ala-Ala |
3,12 |
8,30 |
|
Ala-Ala-Ala |
3,39 |
8,03 |
|
Аlа-(Аlа)n-Аlа, n > 4 |
3,42 |
7,94 |
а) Нарисуйте структурную формулу пептида Аlа-Аlа-Аlа. Укажите функциональные группы, которым соответствуют величины рК'1 и рК'2.
б) При переходе от Ala к олигопептидам, состоящим из остатков Ala, величина рК'1 возрастает. Объясните, почему это происходит?
в) При переходе от Ala к олигопептидам, состоящим из остатков Ala, величина рК'2 уменьшается. Объясните причину этого.