Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Биосинтез аминокислот и нуклеотидов
Биосинтез аминокислот регулируется аллостерическими механизмами
Наиболее чувствительный тип регуляции синтеза аминокислот - это аллостерическое ингибирование первой реакции биосинтетического пути конечным продуктом данной последовательности реакций (разд. 9.18 и 13.11). Первая реакция биосинтетического пути обычно необратима и катализируется аллостерическим ферментом. На рис. 22-8 аллостерическая регуляция показана на примере синтеза изолейцина из треонина, о котором мы уже говорили ранее (разд. 9.18). Конечный продукт - изолейцин - действует как отрицательный модулятор первой реакции этого пути. Такого рода аллостерическая, или нековалентная, модуляция синтеза аминокислот обеспечивает у бактерий быстрый ответ на изменение ситуации.
Другим заслуживающим внимания примером может служить регуляция активности глутаминсинтетазы у Е. coli, в которой участвует целый набор аллостерических эффекторов. У этой бактерии глутамин играет роль донора аминогрупп при биосинтезе многих метаболических продуктов (рис. 22-9). Известно восемь продуктов обмена глутамина, которые выполняют у Е. coli функцию отрицательных модуляторов активности глутаминсинтетазы, действуя по типу обратной связи. Глутаминсинтетаза - один из самых сложных регуляторных ферментов, какие мы знаем.
Поскольку 20 обычных аминокислот требуются для белкового синтеза в определенных соотношениях, в клетках выработались механизмы, обеспечивающие не только регуляцию скорости синтеза отдельных аминокислот, но и координирование их синтеза. Особенно хорошо выражено такое координирование у быстро растущих бактериальных клеток. На рис. 22-10 показано, каким образом координируется у Е. coli синтез четырех аминокислот, образующихся из аспартата, - лизина, метионина, треонина и изолейцина. Этап, ведущий от аспартата к аспартилфосфату, катализируется тремя изоферментами, регулируемыми независимо друг от друга. Этапы, на которых из полуальдегида аспартата образуется гомосерин, а из треонина - а-кетобутират, катализируются двумя изоферментами, также регулируемыми независимо. Один из изоферментов, катализирующих превращение аспартата в аспартилфосфат, может аллостерически ингибироваться двумя различными модуляторами - лизином и изолейцином, действие которых более чем аддитивно. Это еще один пример согласованного ингибирования (разд. 17.24). В последовательности реакций, ведущих от аспартата к изолейцину, действуют множественные взаимно перекрывающиеся виды ингибирования по типу обратной связи: изолейцин подавляет превращение треонина в а-кетобутират, а треонин тормозит свое собственное образование на трех стадиях, в которых субстратами служат гомосерин, полуальдегид аспартата и аспартат. Такое ингибирование называют последовательным ингибированием по типу обратной связи.
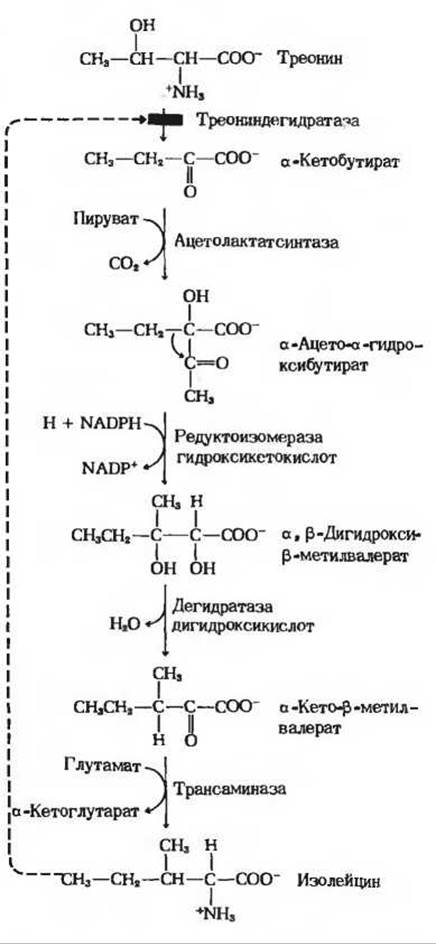
Рис. 22-8. Биосинтез изолейцина из треонина у Е. coli. Первая реакция этого биосинтетического пути ингибируется его конечным продуктом изо лейцином. Это один из первых изученных примеров аллостерического ингибирования по типу обратной связи. Валин способен устранять или предотвращать ингибирующее действие изолейцина.
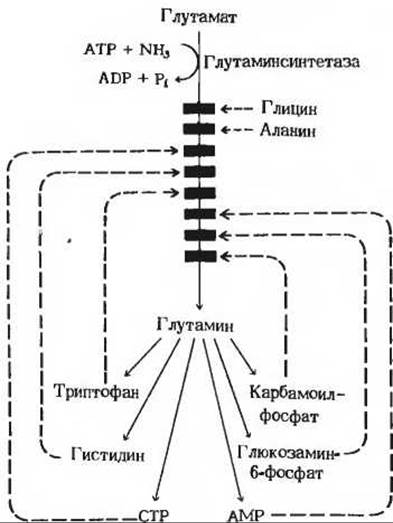
Рис. 22-9. Аллостерическое ингибирование глутаминсинтетазы у Е. coli. У этого организма глутамин является предшественником указанных здесь продуктов. Все они способны ингибировать фермент по типу обратной связи. Такое действие нескольких отрицательных модуляторов называется согласованным ингибированием. Глутаминсинтетаза резко ингибируется также избытком АТР, под влиянием которого она переходит в неактивную форму вследствие ковалентной модификации тех остатков тирозина в ее субъединицах, которые важны для каталитической активности. В животных тканях активность глутаминсинтетазы регулируется гораздо более простым способом.
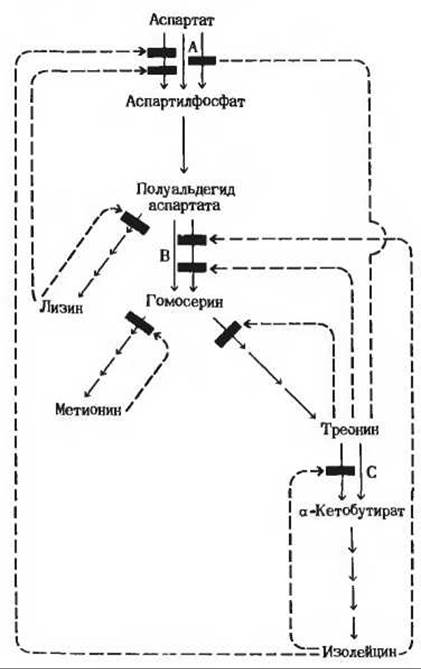
Рис. 22-10. Сложная сеть регуляторных механизмов. контролирующих у Е. coli биосинтез нескольких аминокислот, образующихся из аспартата. Представленные здесь различные типы регуляции описаны в тексте. Там же разъяснены и обозначения, приведенные на рисунке.